自身免疫性肝炎患者血清抗延胡索酸水合酶抗体检测及其临床意义探讨*
程 源,张 洋,毛海洲,段红光
自身免疫性肝炎(autoimmune hepatitis,AIH)主要发病原因为肝脏免疫耐受机制被破坏,使得机体免疫系统攻击肝脏细胞自身抗原,以血清非器官和肝特异性自身抗体水平升高、肝脏实质与间质交界处细胞坏死为主要特点[1,2]。目前,AIH的诊断多参照1999年国际AIH小组制定并经修订的标准[3],但肝脏炎症性疾病均有机体自身免疫反应的参与,因此在临床诊断中与药物性肝损伤(drug induced liver injury,DILI)、慢性乙型肝炎(chronic hepatitis B,CHB)等其他肝脏疾病的区分成为AIH诊断的难点。近年来,有研究显示抗延胡索酸水合酶抗体(fumaric hydrate,FH)可能是AIH的一种新型靶抗原[4],且作为血清学指标,具有简便的优势,但目前其对AIH的诊断价值尚未明确。本研究对我院内科收治的AIH、CHB和DILI患者进行了研究,旨在分析抗-FH对AIH的诊断及其鉴别诊断的价值。
1 资料与方法
1.1 一般资料 2018年2月~2019年5月我院内科收治的肝病患者166例,其中AIH患者52例,男性34例,女性18例;年龄29~73岁,平均年龄为(51.4±7.6)岁。AIH诊断符合《自身免疫性肝炎诊断和治疗共识(2015年)》标准[5,6],包括血清免疫球蛋白G(immunoglobulin G,IgG)、抗核抗体(antinuclear antibody, ANA)、抗平滑肌抗体、抗肝肾微粒体抗体等血清指标改变特征,并经肝脏组织活检诊断;CHB患者81例,男性55例,女性26例;年龄31~76岁,平均年龄为(52.1±7.5)岁。CHB的诊断符合《慢性乙型肝炎防治指南》的标准;DILI患者33例,男性21例,女性12例;年龄28~77岁,平均年龄为(52.4±7.7)岁。DILI诊断包括:①药物治疗与肝损伤发生有明显的时间关联性;②停止使用药物后相关血生化指标迅速复常;③排除其他病因所致的肝损伤;④复用药物后血清ALT水平再次升高至2倍正常值上限或以上[8]。三组患者性别和年龄比较无统计学差异(P<0.05)。排除标准:①合并甲、丙、丁和(或)戊型肝炎病毒感染;②合并心、脑、肾等重要脏器功能障碍;③合并类风湿性关节炎、风湿性肾炎、系统性红斑狼疮等自身免疫性疾病;④合并肝癌、肝硬化或肝豆状核变性。所有患者对研究内容知情并签署相关文件。本研究已经我院医学伦理委员会审核并通过。
1.2 检测 使用NSA-400P全自动生化分析仪检测血生化指标(沈阳东软医疗系统有限公司);采用 ELISA法检测血清IgG水平(吉林省凯瑞诊断制品有限公司)[8];采用ELISA法筛查ANA(深圳市亚辉龙生物科技有限公司);采用ELISA法检测血清抗-FH(北京义翘神州生物有限公司)。

2 结果
2.1 三组血清指标比较 AIH组血清GGT、ALP和IgG水平显著高于CHB组,血清IgG水平显著高于DILI患者(P<0.05,表1)。
2.2 三组血清抗-FH和ANA阳性率比较 AIH组血清抗-FH和ANA阳性率均显著高于CHB组或DILI组(P<0.05,表2)。
2.3 诊断价值分析 虽然血清抗-FH诊断的灵敏度较低,但特异度很高,联合应用血清抗-FH和ANA可以提高诊断的灵敏度,但特异度大大降低(表3)。
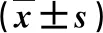
表1 三组血清指标比较
与AIH组比,①P<0.05;与CHB组比,②P<0.05
表2 三组血清抗-FH和ANA阳性率(%)比较

例数抗-FH阳性ANA阳性AIH5219(36.5)①38(73.1)①CHB813(3.7)41(50.6) DILI332(6.1)18(54.5)
与其他两组比,P<0.05

表3 血清抗-FH和ANA诊断AIH价值(%)分析
3 讨论
AIH为免疫介导的肝损伤,其发病机制及病因未完全明确,但当下以“基因易感性学说”和“分子模拟学说”为主流[9,10]。AIH的临床表现较为复杂,少部分患者病情进展迅速,表现为急性发作的肝功能衰竭,多数患者常表现为嗜睡、乏力、恶心等症状,伴随肝脾肿大、水肿和腹水等体征,肝脏出现隐匿性极强的炎症改变,其临床症状与病毒性肝炎十分相似[11]。研究显示超过1/4的患者在确诊时就已经具有肝硬化的临床表现[12,13]。因此,寻找准确性较好、便捷、创伤小的血清学诊断指标已成为AIH临床研究的热点。本研究对AIH、CHB和DILI患者血清学指标及血清抗-FH的诊断价值进行了探索,取得了一定的研究成果。
AIH患者肝组织免疫耐受被打破,可介导机体免疫系统识别肝脏自身抗原,并被攻击,使得肝脏内自由基及炎症因子爆发、内质网应激反应,诱导肝细胞变性或凋亡,最终导致肝组织损伤[14,15]。本研究发现AIH患者血清GGT、ALP和IgG水平显著高于CHB或DILI患者,而三组血清胆红素和ALT水平差异无统计学意义。AIH和DILI患者在血清生化学表现上更加趋于存在肝内胆汁淤积[16-18]。有人对AIH患者进行血清学指标检测也发现,GGT水平升高为急性表现的标志[19]。AIH患者病情隐匿性更强,患者在确诊时病情进展更为明显,ALP水平更高。AIH患者血清ALP水平显著升高,而治疗后下降幅度很大[20]。IgG水平可有效反映肝脏异常免疫情况,血清IgG水平升高为AIH的主要病理学表现之一[21]。本研究结果亦显示AIH组血清IgG水平显著高于CHB组或DILI组,与AIH患者IgG介导的肝实质与间质交界处存在破坏和细胞浸润有关。
肝组织活检为诊断肝脏疾病最准确的方法,但由于创伤、操作复杂等使其临床应用受限,因血清指标具有可动态和重复应用、监测方便、几乎不存在对机体的损伤,而受到广大临床工作者的青睐。目前,AIH的血清学诊断以IgG、自身抗体(ANA、抗平滑肌抗体、抗可溶性肝抗原抗体、抗肝肾微粒体抗体等)为主要指标。国内外相关文献报道指出,AIH 患者ANA阳性率约为 70%,抗平滑肌抗体阳性率仅为20%左右,因此诊断的灵敏性较低,而抗可溶性肝抗原抗体对AIH诊断特异性较高,但其灵敏度仅约为6%。此外,血清IgG检测和动态观察其变化对判断AIH发生和病情发展有一定的帮助[22]。进一步发掘新的补充性血清学指标具有重要的意义。FH为三羧酸循环酶,可促进催化延胡索酸转变成 L-柠檬酸。研究显示,人类和小鼠FH缺失可导致细胞呼吸功能下降,并伴有不同程度的呼吸链复合体I和II功能障碍,导致脱氧核糖核酸损伤[23]。FH水平降低还可导致酮戊二酸受到抑制,进而导致组蛋白脱甲基酶等,诱导癌症等疾病的发生。AIH由遗传易感个体的体质和环境因素共同引起自身免疫性肝病[24]。通过免疫蛋白组学策略研究,针对健康对照组人员和AIH患者进行研究,发现抗-FH为差异性蛋白。本研究建立并优化抗-FH检测方法,发现AIH、CHB和DILI三组血清抗延胡索酸水合酶抗体阳性率不同,以AIH组显著高于CHB组或DILI组。AIH发生后正常肝细胞不断受到机体防御机制的攻击,使得肝组织处于不断损伤、重建的状态,可能导致抗-FH异常出现。FH水平降低,诱发肝脏细胞代谢异常,促进肝脏损伤。临床诊断AIH是基于血清转氨酶、丙种球蛋白、自身抗体阳性率升高和组织学特征的表现,但需排除产生慢性肝炎的其他原因也很重要,抗-FH阳性更多见于AIH组,可能对排除其他肝脏损伤原因有帮助[25]。
研究证明延胡索酸被累积可介导上皮细胞向间充质转化,在纤维化疾病中发挥重要作用[26]。本研究进一步对抗-FH诊断AIH的价值进行了分析,发现抗-FH诊断AIH的灵敏度尽管只有为36.5%,但特异度为95.6%,阳性预测值为79.%,阴性预测值为76.8%,说明抗-FH对AIH具有一定的诊断价值,尤其是在众多肝病需要鉴别时,其阳性可能对诊断有很大的帮助。因血清抗-FH的灵敏度很低,不能仅依靠此项检查来诊断疾病。AIH患者血清存在多种自身抗体,因此可综合多种血清抗体进行判断。本研究发现联合血清ANA进行诊断,其灵敏度为76.9%,而特异度却降至44.7%,其他指标如约登指数为0.2,阳性预测值为38.8%,阴性预测值为80.9%,可为临床诊断提供一定的帮助,也就是说血清抗-FH阴性时,诊断AIH就需要综合其他指标。但本研究样本量较小,因此血清抗-FH对AIH患者诊断的临床意义有待进一步大样本的临床试验予以证实。
综上所述,AIH、CHB或DILI 在血清学指标上具有明显的差异,血清抗-FH对鉴别其他肝病具有一定的价值。抗-FH亦可为AIH的发病机制研究提供新思路,可能作为临床诊断或治疗的新靶点。由于自身免疫性肝病包括了广泛的疾病谱,临床表现复杂,有时诊断较为困难,治疗疗效也不巩固,尤其在多种自身免疫性疾病合并存在时。大多自身抗体的检测方法和试剂也需要统一,各实验室建立的检测方法需要标定,纳入人群的均衡性和诊断标准的统一都需要认真考虑。新的具有高灵敏性和特异性的标志物的开发还需要进一步研究。

