血清CYP2R1含量对慢性乙肝患者病毒载量及抗病毒的疗效研究*
李凤中,陈卫国,刘剑荣,陈小林
(江西省萍乡市人民医院,1.检验科;2.肝病科,萍乡 337055)
乙型肝炎病毒(HBV)感染呈世界性流行,有超过3.5亿人是HBV的慢性携带者[1]。目前尚无可有效治疗慢性乙型肝炎(CHB)的药物。当前临床可用的药物包括具有抗病毒活性和抑制HBV DNA 的核苷(酸)类似物[2],如恩替卡韦[3],但大多数患者需要终身治疗[4]。因此除了抗病毒药物之外,寻找辅助性治疗CHB的药物尤为重要。25-羟维生素D3[25(OH)D3]由维生素D3前体在肝细胞内经25-羟化作用合成,这个过程由两种羟化酶催化,其均是细胞色素 (Cytochrome P450 proteins,CYP)的同工酶[5],分别为肝细胞微粒体羟化酶CYP2R1和线粒体羟化酶CYP27A1,而正常情况下CYP2R1在合成25(OH)D3中发挥主导作用[6]。有研究表明,CHB患者血清25(OH)D3含量与HBV DNA水平呈负相关[7,8]。也有研究表明,对CHB患者补充维生素D可以提高患者的抗病毒治疗效果,提示维生素D在CHB患者的抗病毒治疗可能发挥重要作用[9]。目前有关维生素D3合成酶CYP 2R1与CHB患者体内HBVDNA水平的关系及其对抗病毒治疗效果的影响尚少见报道。本研究旨在探讨CHB患者血清CYP2R1含量与恩替卡韦治疗后的抗病毒效果之间的关系。
1 资料与方法
1.1 研究对象 选择2016年9月-2017年9月就诊于我院的CHB患者100例,其中男55例,女45例,年龄 21-52岁,平均(40.6±2.6)岁。所选患者均符合中华医学会肝病学分会和感染病学分会2015年制订的 《乙型肝炎防治指南》中CHB的诊断标准。纳入标准:⑴患者乙肝表面抗原 (HBsAg)阳性≥6个月;⑵年龄>18岁;⑶既往未接受过抗病毒药物或者干扰素治疗。排除标准:⑴失代偿肝硬化(Child-Pugh)评分>6分;⑵肝癌或者甲胎蛋白(AFP)>50ng/ml;⑶患其他肝脏疾病或细菌感染;⑷恶性肿瘤或者严重的慢性疾病。
1.2 方法
1.2.1 治疗方法 给予CHB患者恩替卡韦(恩替卡韦片,南京正大天晴)常规治疗,每次0.5 mg,每天1次,治疗12个月后停用,在治疗前及治疗期间的第6个月和第12个月时收集患者静脉血5ml,分离血清后及时检测HBV DNA含量及肝功能生化指标。
1.2.2 实验室常规指标检测 乙肝病毒学指标乙肝表面抗原(HBsAg)、乙肝表面抗体(HBsAb)、乙肝e抗原(HBeAg)、乙肝e抗体(HBeAb)、乙肝核心抗体(HBcAb)采用免疫发光法检测,所用仪器及试剂盒均购自罗氏公司,仪器为罗氏CobasE411;试剂盒为HBsAg定性试剂盒 (批号:168216-04)、HBeAg定量试剂盒(批号:169476-01),按照试剂盒说明书进行操作。血清CYP2R1含量采用酶联免疫吸附法(ELISA)检测,试剂盒购自上海江莱生物科技有限公司(JL20581-96T),按照试剂盒说明书进行操作。肝功能指标血清谷草转氨酶(AST,IFCC速率法)、谷丙转氨酶(ALT,IFCC速率法)、总胆红素(TBiL,重氮盐法,STB070)等采用生化仪贝克曼库尔特AU5800生化仪检测,试剂盒购自北京利德曼生化股份有限公司。
1.2.3 血清HBVDNA检测 采用实时荧光定量PCR法对患者血清中HBV DNA进行定量检测。检测试剂为中山大学达安基因 (PCR-荧光探针法)HBV DNA试剂盒(货号DA0031)最低检测限值为500 IU/ml,分离血清后将200μl血清样本与450μl DNA提取液混合,置于100℃温育器中预热10min。反应总体积 20μl,SYBR Green Master 10μl,上下游引物各 2μl,血清 DNA 模板 2μl,RNase-free H2O补足至20μl,将定量所需试剂加入后,轻弹混匀后离心,按照如下反应体系进行:95℃预变性5min;95℃变性 15s,60℃退火 30s,72℃延伸 30s,共 35 个循环,最后维持4℃。引物序列达安基因试剂盒中提供。设置阴性对照、弱阳性与强阳性对照、阳性标准品对照。所有操作均严格按照说明书执行。
1.3 统计学方法 实验数据采用SPSS17.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,组内多时间点比较采用重复测量设计的方差分析。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同血清CYP2R1含量患者的基线资料比较根据患者中位血清CYP2R1含量 (26.5 ng/L),把CYP2R1>26.5 ng/L分为CYP2R1高浓度组 (50例)和 CYP2R1<26.5 ng/L为低浓度组(50例)。CYP2R1高浓度组患者 25(OH)D3水平高于CYP2R1 低浓度组(P<0.05),两组患者性别、年龄、身体质量指数(BMI)、Child-Pugh评分差异均无统计学意义(P>0.05),见表1。

表1 2组患者基线资料比较
2.2 不同浓度CYP2R1的CHB患者治疗后肝功能的变化 2组患者治疗前、治疗6个月、治疗12个月AST、ALT和TBiL水平依次降低,组间多重比较差异均有统计学意义(P<0.05);各时间点2组间差异均无统计学意义(P>0.05),见表2。
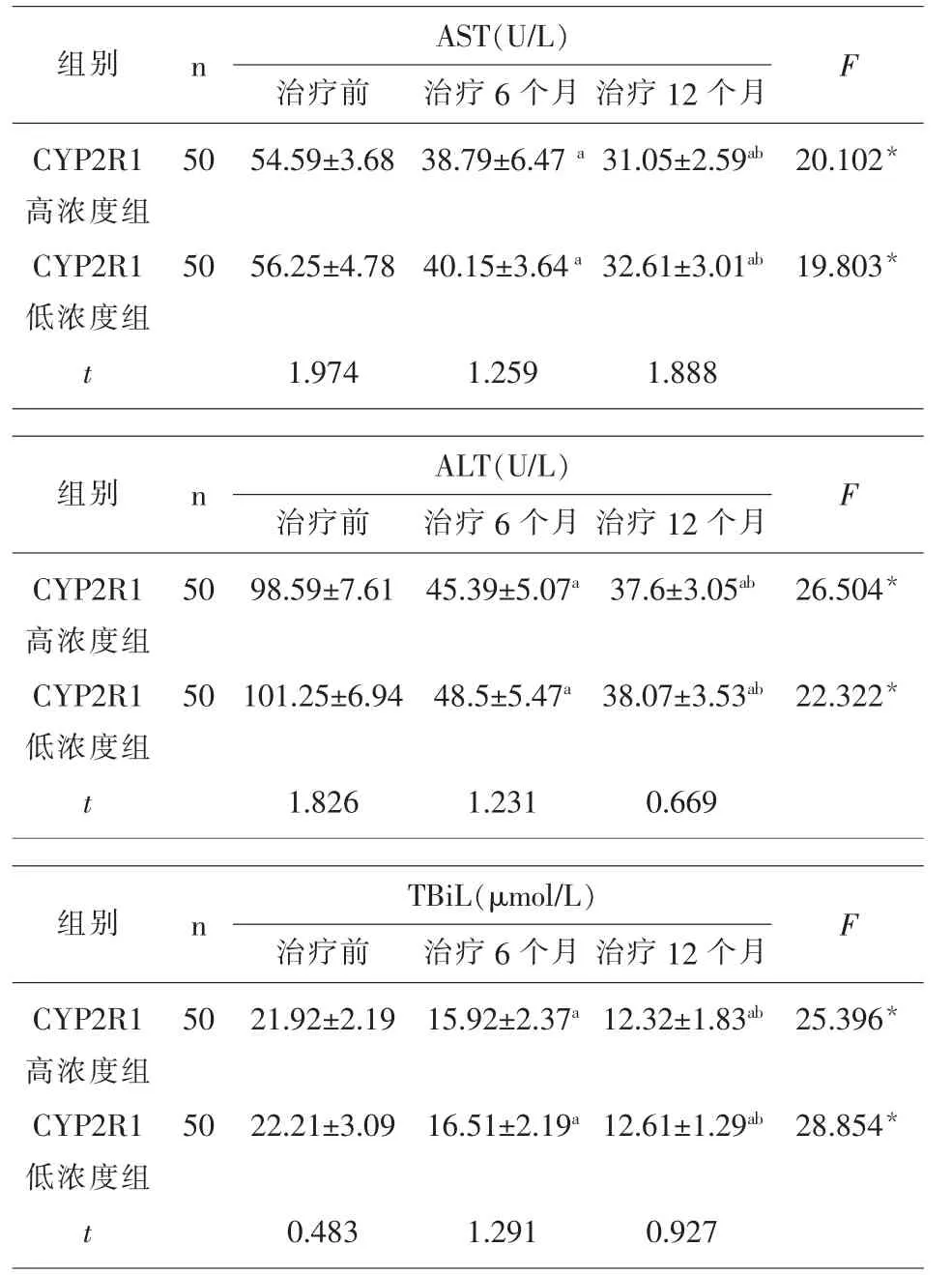
表2 恩替卡韦治疗前后2组CHB患者肝功能指标比较
2.3 不同浓度CYP2R1的CHB患者抗病毒治疗后HBV DNA含量改变 2组患者治疗前、治疗6个月、治疗12个月病毒载量HBV DNA依次降低,组间多重比较差异均有统计学意义 (P<0.05);治疗前,2组病毒载量HBV DNA差异无统计学意义,治疗6个月和12个月时,CYP2R1高浓度组均低于 CYP2R1 低浓度组(P<0.05),见表3。

表3 2组患者治疗后病毒载量HBV DNA的变化
3 讨论
在HBV通过体液入侵机体后,造成肝脏组织慢性炎症感染的过程中,病毒因素、环境因素及宿主本身因素均在此过程中起重要作用[10]。大量的临床试验和临床荟萃分析均显示,患者维生素D缺乏与CHB感染病情发生进展有关[11],维生素D合成障碍或维生素D缺乏均是促进CHB慢性病理炎症发生的因素之一[12]。有研究报道,体内维生素D缺乏的CHB患者,通常都伴随着高乙肝病毒载量(HBV DNA含量高),而且维生素D含量高的患者治疗结局会优于水平较低者[13]。研究还发现补充维生素D与抗病毒治疗手段联合应用时,可显著提高机体的免疫应答率,提示维生素D可用于抗病毒治疗[14]。机体25(OH)D3的含量与其代谢酶的关系密切[15]。25(OH)D3由维生素D3前体在肝细胞内经25-羟化作用合成,主要由CYP2R1酶催化。CHB患者25(OH)D3降低不仅与维生素D3的合成原料不足[16],也与肝细胞合成维生素D相关代谢酶的活性下降、表达减少、线粒体损伤有关[17]。目前的报道都是仅针对患者血清维生素D3的含量与HBV在体内复制致病的相关性及其对抗病毒治疗的作用。而对于机体本身维生素D的合成和代谢在CHB发生发展中的作用尚不明确。
本研究结果显示,2组患者治疗前、治疗6个月、治疗12个月病毒载量HBV DNA依次降低,且治疗6个月和12个月时,CYP2R1高浓度组均低于CYP2R1低浓度组,提示CHB患者血清CYP2R1浓度可能与患者病毒DNA复制情况呈负相关,与Zhao等[18]研究结果一致。但是血清CYP2R1含量对CHB患者治疗后肝功能指标AST、ALT和TBiL并没有差异,提示血清CYP2R1含量是影响CHB患者HBV DNA的因素之一,其机制可能是通过影响维生素D的合成,进而影响患者体内的乙肝病毒复制,而不影响宿主的本身肝功能水平。和本研究的结果一致,有相关的研究表明乙肝患者的CYP2R1的水平与患者肝功能AST、ALT和 TBiL等指标没有关联,但是和患者的HBV DNA水平由呈负相关,具体的作用机制并不清楚[19]。
最近大规模的全基因组关联研究结果显示,血清CYP2R1含量与基线25(OH)D3水平相关[20]。本研究结果显示,使用恩替卡韦抗病毒治疗12个月后,CYP2R1高浓度组HBsAg、HBeAg阳性率均低于CYP2R1低浓度组,CYP2R1高浓度组患者能更好地获得病毒学应答,提示血清CYP2R1水平可能与CHB的发病机制以及抗病毒治疗的病毒学应答有关,而且是通过影响维生素D3合成而产生的作用。有研究显示,在HBV感染初期,HBV携带者体内25(OH)D3的含量与健康人相比无明显变化,但是其羟化酶CYP2R1含量已出现异常[21],在此基础上,随着肝病进展至失代偿期肝硬化阶段,25(OH)D3含量降至最低[11]。但是是否因HBV感染引起肝细胞功能受损,导致羟化酶CYP2R1降低,目前尚不明确,有待进一步研究验证。

