PD-1在4NQO诱导的小鼠口腔黏膜鳞状细胞癌中表达变化
张柏林,李 岩,朱雪琴,蒋英英,,陈万涛
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是全球范围内重要的致死性头颈恶性肿瘤之一[1-2]。传统治疗方法往往存在预后效果差、临床易复发等多种问题。免疫治疗作为一种新型的肿瘤治疗手段,疗效持久,不良反应低,对多种肿瘤治疗效果显著,受到国内外广泛关注。目前,程序性死亡蛋白1及其配体(programmed cell death1/programmed cell death 1 ligand,PD-1/PD-L1)和细胞毒性T淋巴细胞抗原(cytotoxic T lymphocyte antigen 4,CTLA-4)是免疫检查点领域中的研究热点[3-5]。PD-1单抗药物在治疗黑色素瘤、肺癌、前列腺癌等恶性肿瘤中也取得了显著效果[6]。近期临床试验表明,PD-1对头颈部鳞癌术后复发与转移的治疗也表现出令人满意的疗效,且安全性和耐受性良好,但关于PD-1与口腔黏膜鳞癌发展进程的研究少有报道[7]。本研究旨在探讨免疫检查点PD-1与小鼠口腔黏膜鳞癌发展的相关性,为口腔黏膜鳞癌的免疫治疗提供实验依据。
1 材料与方法
1.1 实验材料和主要仪器
C57BL/6(H-2b)成年野生型小鼠购自上海斯莱克实验动物有限公司,4-硝基喹啉-1-氧化物(4-nitroquinoline-1-oxide,4NQO)购自美国Sigma公司,FITC Anti-Mouse CD4、APC Anti-Mouse CD279(PD-1)均购自美国BD公司,PrimescriptTMRT reagent Kit、SYBR®Premix Ex TaqTM均购自日本Takara公司,引物由上海生工生物工程股份有限公司合成。流式细胞仪购自美国FACSCaliburBD公司,实时荧光定量PCR仪购自美国ABI公司。
1.2 方法
1.2.1 小鼠口腔鳞癌模型建立 本研究综合相关文献报道与实验室前期研究结果,取8~10周龄成年野生型小鼠10只,随机分为实验组和对照组两组,每组各5只。实验组小鼠在饮水中加入100 mg/L的4NQO,饲喂20周(每周更换1次)后换成正常饮水;对照组小鼠给予正常饮水。28周后模型诱导结束[8-9]。处死、解剖小鼠,取舌、脾组织,10%甲醛溶液固定,组织病理切片、HE染色,显微镜下观察并比较其病理变化。实验组小鼠口腔鳞癌诱导成功率100%;对照组小鼠均无口腔鳞癌发生。
1.2.2 实时逆转录聚合酶链反应(RT-PCR) 取实验组小鼠5只舌部病变黏膜组织,对照组小鼠5只舌部相同位置黏膜组织,研磨,加入1 mL TRIzol,提取总RNA。经紫外分光光度仪检测A260/A280比值,验证RNA纯度和浓度。根据试剂盒说明书合成cDNA,进行Real-time PCR。反应体系如下:SYRB Green Master mix 10 μL,ROX Reference Dye Ⅱ(50×)0.4 μL,上下游引物各0.4 μL,cDNA 2 μL,补水至 20 μL。反应条件为:预热;95 ℃,35 s变性,60 ℃ 34 s退火延伸,42次循环。每个样本重复3次。用2-ΔΔCt法计算相对值用于数据统计与分析。所用引物序列见表1。
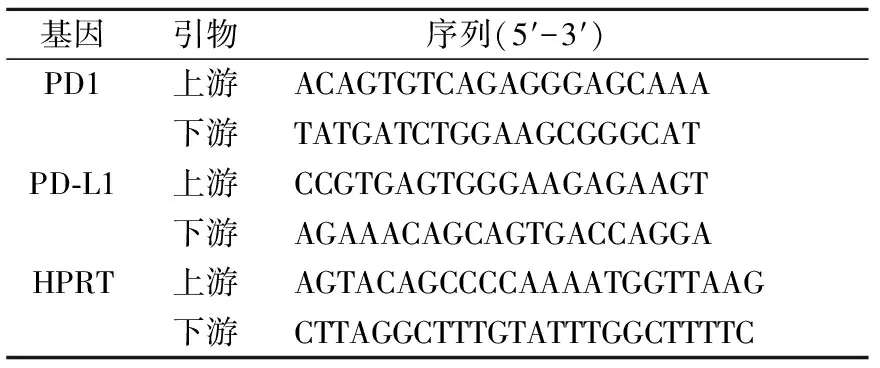
表1 Real-time PCR引物
1.2.3 流式细胞术 取实验组、对照组小鼠各3只,将小鼠安乐死后,取出舌部病变组织、脾脏、引流淋巴结2对,制成组织单细胞悬液。每个样本取2×106个细胞行流式细胞术,加入50 μL CD4-FITC和PD-1-APC流式抗体混合液,冰箱避光染色15 min,加入400 μL PBS溶液,高速离心后弃上清,加入250 μL PBS溶液重悬,将样本转移到流式管中上机检测,在流式细胞仪控制软件中圈门选出CD4+T细胞群,检测其PD-1的平均荧光强度。
1.2.4 数据统计与分析 流式数据采用Novoexpress软件进行分析,采用GraphPad Prism 8.0软件对Real-time PCR数据进行作图与分析,组间样本均数的统计学分析采用t检验法,P<0.05差异有统计学意义。
2 结 果
2.1 成功建立小鼠口腔鳞癌模型及组织病理学评价
在成年小鼠的饮水中加入100 mg/L浓度的4NQO,饮水暴露20周后,观察到28周,成功诱导小鼠发生口腔鳞癌(图1A)。处死小鼠后,取舌组织和脾脏组织用于后续研究。形态学结果显示:对照组小鼠舌背黏膜呈粉红色,富有弹性,舌乳头分布均匀,舌体柔软,无白斑样改变;4NQO组小鼠舌背黏膜粗糙不平,广泛白色斑块样改变,可见数个白色外生性肿物,表面光滑,未见溃疡和坏死舌。4NQO组小鼠脾脏色暗红,充血,体积明显小于对照组小鼠(图1B)。组织病理学结果显示:对照组小鼠舌背黏膜上皮为角化的复层鳞状上皮,层次清楚,细胞排列正常,未发现上皮异常增生等变化,上皮和肌层之间为薄层结缔组织,无明显炎细胞浸润;4NQO组小鼠舌背病变组织呈外生性生长,棘层可见癌细胞团,细胞及核异形性明显,核分裂像明显,基底层完整,肿瘤细胞未发生基底下浸润,上皮与基层之间可见炎细胞浸润。对照组小鼠脾脏白髓、红髓清晰可见,界限明显,红髓分布于白髓及边缘区的外侧,边缘区结构清晰,把白髓和红髓间隔开;淋巴细胞染色呈深蓝色;4NQO组小鼠脾脏白髓减少或消失,红髓、白髓界限模糊,淋巴细胞染色呈深蓝色,广泛浸润,数量增多(图1C)。
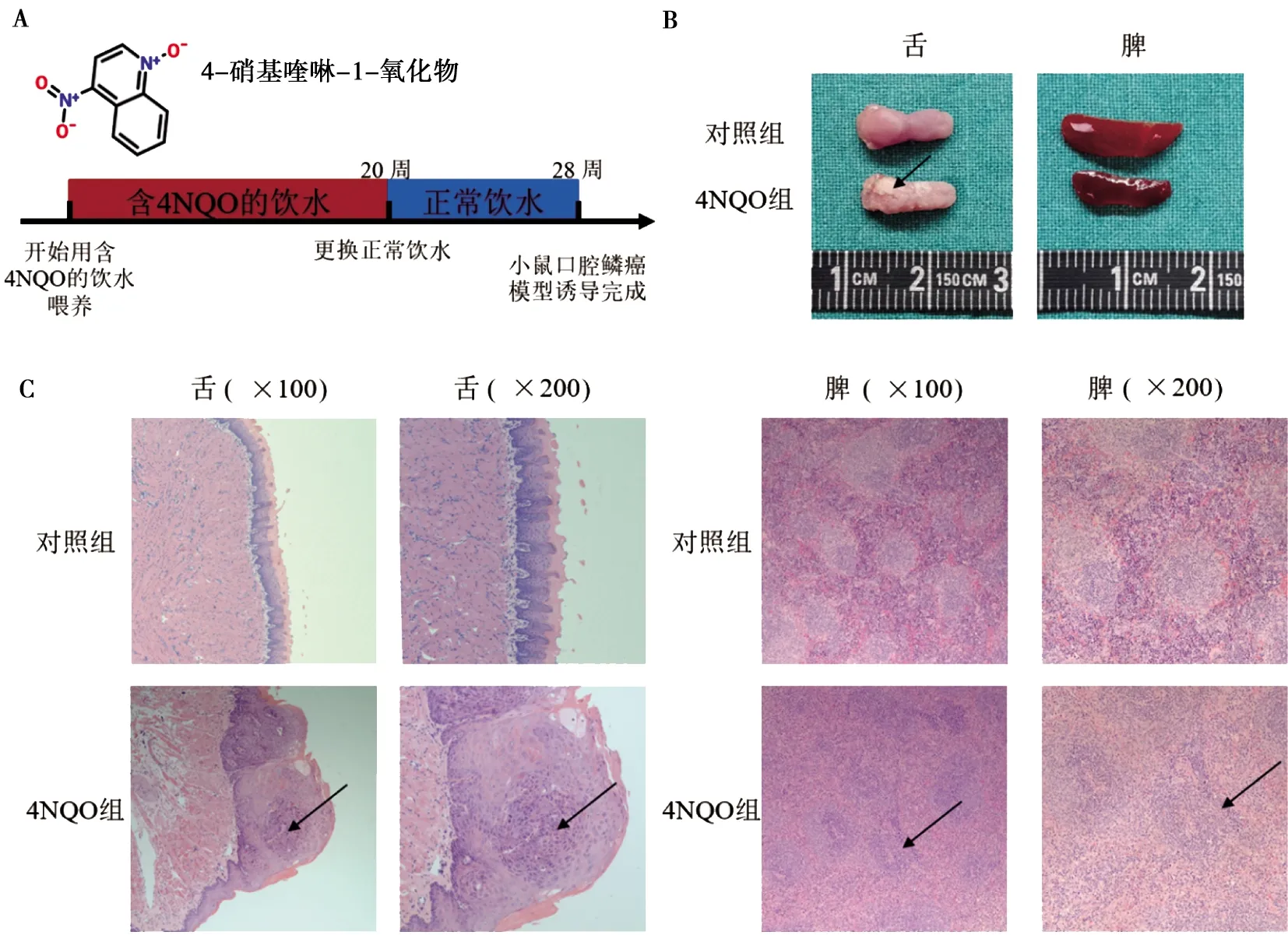
A:小鼠口腔鳞癌模型的建立; B:小鼠舌部、脾脏形态学改变(箭头示); C:小鼠舌黏膜病变组织内可见癌细胞团,脾脏白髓结构改变(箭头示,HE染色)
2.2 PD-1在小鼠口腔黏膜鳞癌发生后表达明显升高
成功诱导小鼠产生口腔鳞癌后,取小鼠舌部病变组织,利用Real-time PCR检测病变组织中PD-1、PD-L1基因的mRNA表达,结果显示,4NQO诱导组小鼠PD-1的mRNA表达量明显高于对照组小鼠(图2A)。取小鼠的舌病变组织、脾脏、引流淋巴结等组织,制成单细胞悬液,利用流式细胞术检测CD4+T细胞中PD-1的表达。结果显示,4NQO诱导组小鼠舌黏膜病变组织、脾脏和引流淋巴结组织中CD4+T细胞PD-1平均荧光强度均明显高于对照组小鼠(图2B)。
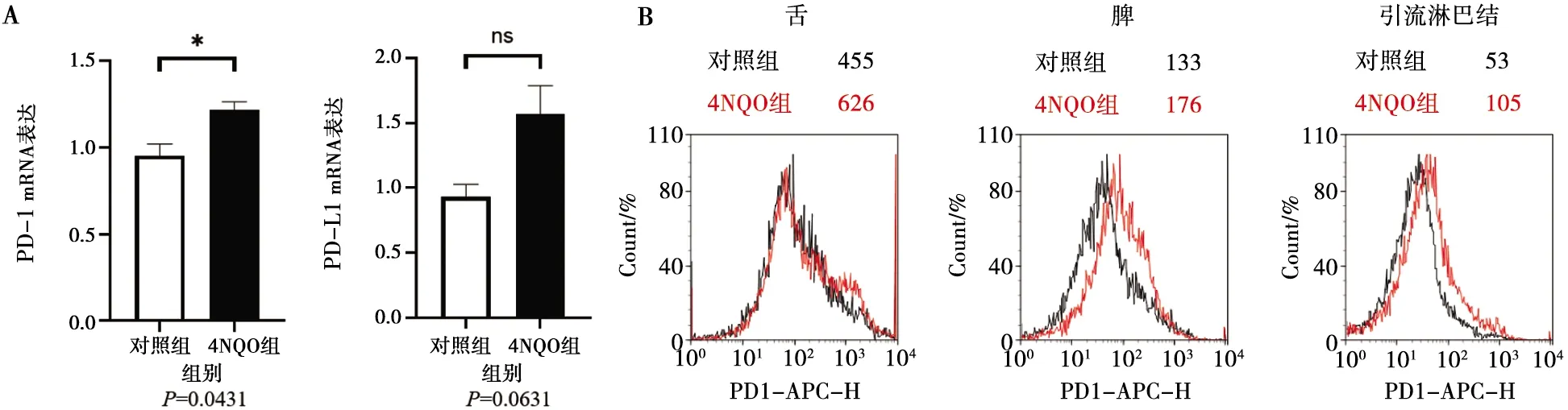
A:对照组和4NQO组小鼠PD-1、PD-L1 mRNA的表达(*:P<0.05);B:对照组和4NQO组小鼠舌黏膜组织、脾脏、引流淋巴结PD-1的变化
3 讨 论
口腔鳞状细胞癌是常见的头颈部恶性肿瘤之一。据统计,口腔鳞癌患者经过手术、放疗和化疗为主的综合治疗后,其5年生存率为60%左右,而晚期患者5年生存率仅为20%~40%[10-12]。根据肿瘤细胞免疫应答反应的原理,肿瘤微环境中的树突状细胞在识别并捕捉具有肿瘤特异性抗原的癌细胞后,迁移至引流淋巴结,使T细胞活化,经外周血从淋巴结迁移至肿瘤部位,在识别具有肿瘤抗原的癌细胞后继续发挥杀伤作用,使肿瘤细胞释放出更多的抗原形成一个“免疫循环”,直至彻底清除肿瘤[13]。T细胞的活化可被负向调控分子抑制,这些负向调控分子被证实是免疫治疗的“检查点”,具有调控T细胞初级应答与二次应答的作用,而抑制此类“检查点”蛋白(PD-1、CTLA-4)的活性,临床治疗多种肿瘤效果显著,但具体调控的分子机制仍需深入探讨[14-16]。因此,研究免疫检查点在肿瘤发生发展过程中的表达,对临床诊断与治疗肿瘤具有重要参考价值。
本研究应用经典化学致癌剂4NQO诱导小鼠口腔黏膜肿瘤的发生[17-18]。课题组前期研究发现,4NQO饮水暴露16周后换成正常饮水再饲养8周,80%以上的小鼠舌部发生外生性肿瘤[9]。因此,本实验选择100 mg/L浓度的4NQO饮水暴露20周后更换正常饮水再饲养8周,与对照组小鼠相比,4NQO组小鼠的舌背黏膜出现多个外生性肿物,组织病理学结果显示,模型建立成功。已有研究发现,舌癌患者的肿瘤组织出现大量T淋巴细胞和肿瘤相关巨噬细胞浸润,并且PD-1表达显著升高,但研究结果仅在组织中利用免疫荧光法粗略展现,存在一定的局限性[19]。本研究基于健康小鼠和4NQO诱导小鼠,检测PD-1在舌部病变肿瘤组织、引流淋巴结、脾脏的变化,阐明PD-1在口腔鳞癌发生后的变化,具有重要的参考价值。对头颈肿瘤基因表达谱的研究发现,该种疾病患者的基因组存在高突变性,其中PI3K信号通路分子具有最高的突变率,其中PIK3CA分子是该信号通路突变率最高的基因[20]。Pik3ca基因的突变将引起AKT2、RICTOR、RAPTOR、TSC1/TSC2的表达改变,进而导致PI3K及其下游信号AKT/mTOR信号通路活化[21]。目前PI3K/AKT/mTOR相关信号抑制剂作为治疗头颈肿瘤的新药已获得FDA批准上市,但治疗机制仍不十分明确,可结合PD-1抗体探究2种药物的协同作用和治疗效果,具有应用前景。
综上所述,本研究检测了PD-1在小鼠发生口腔鳞癌时的变化,发现与正常小鼠相比,在舌黏膜肿瘤组织、引流淋巴结、脾脏中PD-1的表达显著升高,为口腔鳞癌免疫治疗的研究提供实验依据,对临床具有一定的参考价值。

