外源氧载体和前体L-谷氨酸添加策略提高Bacillus subtilis HB-1 发酵产γ-聚谷氨酸
任东雪, 陈鹏程, 郑 璞*, 徐志南, 卢 松
(1. 江南大学 生物工程学院,江苏 无锡214122;2. 浙江大学 化学工程与生物工程学院,浙江 杭州310027;3. 内蒙古阜丰生物科技有限公司,内蒙古 呼和浩特010030)
γ-聚谷氨酸(γ-PGA)[1]是一种富含游离羧基的天然环保型生物高分子材料,相对分子质量一般在100~1×104左右, 是由多个D 型和L 型谷氨酸通过酰胺键连接而成的高分子聚合物。γ-PGA 作为一种亲水性和生物相容性良好的天然聚合物, 在食品、医药[2-5]、化妆品、农业和工业等领域应用广泛。 目前制备γ-PGA 的方法主要有提取法, 化学合成法和微生物发酵法等。γ-PGA 最早是从纳豆中分离提取出来的,但是纳豆中γ-PGA 浓度甚微,因此提取工艺十分复杂,生产成本甚高;化学制备一般是通过二聚体缩聚法将D/L 型的谷氨酸连接制备成多肽的形式,所需化学试剂较多,制备流程复杂,难以工业化。
微生物发酵法[6]具有环境污染小,天然产物纯度高和反应条件温和的优势。 微生物将内源的或者外源的L-谷氨酸通过自身谷氨酸异构酶的作用合成D-谷氨酸,然后通过γ-PGA 合成酶将D/L 型的谷氨酸连接成多肽,并且不断延长形成多肽,自发分泌到胞外。 目前生产γ-PGA 的菌株主要是芽孢杆菌属[7-9],包括L-谷氨酸外源依赖型和非L-谷氨酸依赖型菌株,非L-谷氨酸依赖型主要利用自身合成的L-谷氨酸通过γ-PGA 合成酶[10-11]聚合形成γ-PGA,但是因为其内源L-谷氨酸水平有限,严重限制了γ-PGA 的产量水平。 Nuttawut[12]筛选了一株非外源L-谷氨酸依赖型菌株Bacillus licheniformisTISTR 1010, 在7 L 发酵罐扩大培养得到27.5 g/L的γ-PGA;徐艳萍等[13]利用亚硝基胍和60CO 诱变地衣芽孢杆菌,产量仅有23 g/L。随着代谢工程的发展,很多研究者关注γ-PGA 合成酶的异源表达,彭英云[14]将来源于Bacillus methylotrophicusSK19.001的γ-PGA 合成酶基因在大肠杆菌中克隆表达,以L-谷氨酸为底物获得0.65 g/L 产物γ-PGA;Jun[15]在Bacillus amyloliquefaciens中过表达γ-PGA 合成酶基因(PgsBCA),发现γ-PGA 产量反而下降;Cao[10]在谷氨酸棒杆菌(C. glutamicum)中表达PgsBCA 基因,但是γ-PGA 产量仅有0.69 g/L;Hao 等[16]在大肠杆菌(Escherichia coliBL21)中表达γ-PGA 合成酶基因,在添加了40 g/L (NH4)2SO4的情况下,γ-PGA产量也仅有3.7 g/L。
由于非L-谷氨酸依赖型菌体和γ-PGA 合成酶异源表达所得的目的产物γ-PGA 产量低,Zhu[17]筛选出一株可以利用秸秆水解糖作为碳源的外源L-谷氨酸依赖型菌株Bacillus subtillisHB-1,在3 L发酵罐上分批发酵可获得23.63 g/L 的γ-PGA。 但是由于发酵液的黏度较大(1900 mPa·s)[18],极大地限制了发酵培养基的溶氧水平,阻碍了菌体的生长和产物的进一步生成,造成前体L-谷氨酸的转化率较低,代谢副产物较多。 作者比较了几种常见的氧载体对Bacillus subtilisHB-1 菌体生长和γ-PGA产量的影响,选用PDMS 明显提高了菌体生长和γ-PGA 产量, 并通过前体L-谷氨酸添加时间及其添加量的单因素实验,提高了前体L-谷氨酸的转化效率。 同时发酵罐上放大培养,获得了52 g/L 的目的产物γ-PGA,其相对分子质量高达1000 万,为医药材料、工业农业等领域提供了高相对分子质量的天然原料,具有比较重要的应用价值。
1材料与方法
1.1 材料
1.1.1 菌种实验室保存枯草芽孢杆菌HB-1(BacillussubtilisHB-1)。
1.1.2 培养基LB 液体培养基:酵母提取物5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L;pH 7.0。
LB 固体培养基:在LB 液体培养基的基础上加入质量分数1.6%的琼脂粉。
发酵培养基:胰蛋白胨30 g/L,玉米秸秆混合糖水解液[17]60 g/L,氯化钠10 g/L,L-谷氨酸40 g/L,氯化钙1 g/L,七水硫酸镁1 g/L,一水硫酸锰0.34 g/L;pH 7.0。
1.1.3 主要仪器和设备冷冻干燥机: 购自美国Labconco 公司;SBA-40C 生物传感分析仪: 购自山东省科学院生物研究所;氨基酸分析仪:购自美国安捷伦公司;凝胶过滤色谱仪:购自美国沃特世公司。
1.1.4 主要试剂聚二甲氧基硅烷(PDMS)、正庚烷,购自麦克林生物科技有限公司;1-氟-2,4-二硝基苯基-5-L-丙氨酸酰胺 (FDAA), 购自Sigma 公司;醋酸钠、三乙胺、四氢呋喃、甲醇、乙腈(分析纯),购自上海生工生物工程有限公司。
1.2 实验方法
1.2.1 种子培养取10 ~20 μL 甘油管保存的Bacillus subtilis HB-1, 接种30 mL LB 液体培养基中,37 ℃、110 r/min 培养12 h, 取菌液稀释涂布于LB 固体培养基平板,37 ℃培养箱孵育12 h 左右,挑取单菌落,置于LB 液体培养基,用于下一步培养和发酵实验。
1.2.2 氧载体添加量的确定按照1.2.1 种子培养的方法培养种子至对数期,按照10%的接种体积分数将生长到对数期的种子液接种于发酵培养基,分别添加体积分数0、0.5%、1%、3%、5%、10%的正庚烷和体积分数0、1%、5%、10%、15%、20%的聚二甲氧基硅烷(PDMS),37 ℃、110 r/min 培养48 h,收集发酵液用于测定OD600和γ-PGA 产量。
1.2.3 氧载体添加时间的确定按照1.2.1 种子培养的方法培养种子至对数期,按照10%的接种体积分数将生长到对数期的种子液置于发酵培养基,设置不同的时间梯度(0、6、12、18、24、30、36 h)添加体积分数10%的氧载体 (PDMS),37 ℃,110 r/min 培养48 h, 收集发酵液用于测定OD600和γ-PGA产量。
1.2.4 前体L-谷氨酸的添加时间的确定按照1.2.1 种子培养的方法培养种子至对数期,按照10%的接种体积分数将生长到对数期的种子液置于发酵培养基, 设置不同的时间梯度(0、6、12、18、24、30、36 h) 添加终质量浓度为5 g/L 的前体L-谷氨酸,37 ℃、110 r/min 培养48 h, 收集发酵液用于测定OD600和γ-PGA 产量。
1.2.5 前体L-谷氨酸添加量的确定按照1.2.1 种子培养的方法培养种子至对数期,按照10%的接种体积分数将生长到对数期的种子液置于发酵培养基, 分别添加终质量浓度为0、5、10、15、20、30 g/L的前体L-谷氨酸,37 ℃、110 r/min 培养48 h, 收集发酵液用于测定OD600和γ-PGA 产量。
1.2.6 发酵罐培养3 L 发酵罐, 装液量1.5 L,氧载体PDMS 添加体积分数为10%, 种子液OD600为6.0 左右时,按照体积分数为5%的接种量接入发酵罐,温度自控为37 ℃,通气量1~2 vvm,搅拌转速400~1000 r/min 维持溶氧水平在体积分数20%以上, 体积分数10%氨水和2 mol/L 盐酸控制发酵过程pH 稳定在7.0。 在一次性补料中,在发酵25 h 一次性向培养基中添加终质量浓度为10 g/L 的前体L-谷氨酸;在流加发酵中,当葡萄糖质量浓度低于5 g/L 时, 使用蠕动泵按照15~20 mL/h 的流速将200 g/L 的玉米秸秆混合糖溶液[17]注入发酵罐,维持罐中质量浓度在5~10 g/L 范围内; 当前体L-谷氨酸质量浓度低于10 g/L 时, 使用蠕动泵按照20~30 mL/h 的流量添加300 g/L 的前体L-谷氨酸,维持其质量浓度在10 g/L。 间隔3~5 h,取10 mL 发酵液,测定OD600,前体L-谷氨酸、葡萄糖、木糖及其产物γ-PGA 质量浓度。
1.3 分析方法
1.3.1 生物量检测以去离子水为空白对照,利用可见光分光分度计在波长为600 nm 处检测培养液的吸光值OD600,表示生物量。
1.3.2 葡萄糖以及前体L-谷氨酸的检测用蒸馏水将离心后的发酵上清液稀释100 倍后, 取25 μL稀释后的样品液注入SBA-40C 测量剩余葡萄糖和剩余前体L-谷氨酸的量。
1.3.3 γ-PGA 产量测定取5 mL 发酵液12000 r/min离心30 min 除去菌体, 加入15 mL 乙醇沉淀,4 ℃沉淀12 h 左右,12000 r/min 离心30 min 除去杂质,沉淀置于60 ℃真空干燥箱烘干称质量,为粗略计算的γ-PGA 产量。取水解管,称取100.0 mg 左右固体发酵产物γ-PGA,加8 mL 6 mol/L 盐酸,充氮气3 min,调流量,使溶液呈微沸状态,拧紧水解管盖。放入已设定为120 ℃的烘箱中,水解22 h。2 mol/L NaOH 中和后滤纸过滤,15000 r/min 离心30 min,取400 μL 上清液用于D/L 谷氨酸衍生化。
D/L 谷氨酸衍生化方法[19]:取10 μL 上述制备的γ-PGA 酸水解上清液, 加入8 μL 的1 mol/L 的NaHCO3和40 μL 1-氟-2,4-二硝基苯基-5-L-丙氨酸酰胺(FDAA)丙酮溶液(10 mg/mL)于1.5 mL 的离心管中,40 ℃水浴锅加热1 h,加热结束后冷却至室温,加入8 μL 1 mol/L 的盐酸,最后加入934 μL体积比为40∶60 的乙腈和水混合液, 混匀后过有机滤膜。 色谱柱:Develosil ODS-UG-5 (150 mm×4.6 mm),流动相A:水(含体积分数为0.05%的三氟乙酸),流动相B:乙腈(含体积分数为0.05%的三氟乙酸),流速:1.0 mL/min,检测波长:340 nm,柱温:40℃,进样量:20 μL,洗脱程序:0 min:流动相B 的体积分数为20%,40 min: 流动相B 的体积分数为40%,45 min:流动相B 的体积分数为50%。
1.3.4 γ-PGA 提取纯化取50 mL 发酵液12000 r/min 离心30 min 除去菌体,加入150 mL 无水乙醇反复沉淀3~5次,12000 r/min 离心30 min 去除上清液,取沉淀下来的γ-PGA 溶于50 mL 无菌水中,置于透析袋,放入2 L 蒸馏水中透析3~5 d,去除杂质和小相对分子质量的γ-PGA, 将透析袋内的γ-PGA 水溶液冷冻干燥,得到白色γ-PGA 纯品。
1.3.5 傅立叶变换红外光谱 (FTIR)干燥成粉末状的发酵产物采用傅立叶变换红外光谱进行检测其特定吸收峰,扫描波长为4500~500 cm-1。
1.3.6 氨基酸分析仪测定发酵产物中氨基酸组分酸水解后的发酵产物使用氨基酸分析仪检测单体氨基酸组成。色谱柱:Agilent Hypersil ODS(4.0 mm×250 mm), 流动相A:27.6 mmol/L 醋酸钠-三乙胺-四氢呋喃(体积比为500∶0.11∶2.5), 流动相B:80.9 mmol/L 醋酸钠-甲醇-乙腈(体积比为1∶2∶2),流速:1.0 mL/min,检测器波长:338 nm,柱温:40 ℃,进样量:20 μL,洗脱程序:0 min:流动相B 的体积分数为8%;17 min: 流动相B 的体积分数为50%;20 min:流动相B 的体积分数为100%;24 min:流动相B 的体积分数为0%。
1.3.7 γ-PGA 相对分子质量测定凝胶过滤色谱法(Gel filtration chromatography,GFC)[20]测 定γ-PGA 相 对 分 子 质 量, 色 谱 柱:UltrahydrogelTMLinear(300 mm×7.8 mm),流动相:0.1 mol/L NaNO3,流速:1.0 mL/min,柱温:45 ℃,进样量:20 μL。
2 结果与讨论
2.1 氧载体的选择
氧气在好氧发酵中起着重要的作用,特别是对于高黏度的聚合物生产中。 γ-PGA 黏度大,在发酵过程中严重影响了菌体的正常生长和γ-PGA 产量的进一步提高。 一种获得更好的氧供应的方法是通过添加氧载体来增加氧在培养基中的溶解度。 氧载体一般为疏水性液体, 其中氧的溶解度比水高15~20 倍,可以大幅度提高空气中的氧气在液体培养基中的溶解度,供给菌体生长和代谢充足的氧气。 有报道表明,正十二烷被添加到培养基中,改善了透明质酸(HA)、多糖、二十二碳六烯酸、番茄红素、β-胡萝卜素等的生产[21]。 因此作者选择正己烷、正庚烷、正十二烷、正十六烷和PDMS 等5 种氧载体添加到发酵培养基中,发现5 种氧载体都明显提高了菌体的生长(图1),其中PDMS、正十二烷和正十六烷最为明显,但后两者却降低了γ-PGA 的产量,而正庚烷和PDMS 能够有效提高γ-PGA 的产量。 因此选用正庚烷和PDMS 作为氧载体,研究其体积分数对生物量和γ-PGA 产量的影响。

图1 不同氧载体对菌体生长和γ-PGA 产量的影响Fig. 1 Effect of different oxygen carriers on cell growth and γ-PGA production
2.2 正庚烷和PMDS 添加量对生物量和γ-PGA产量的影响
Zhang 等[22]报道氧载体正庚烷的添加使得细胞的NADH/NAD+比例升高,糖酵解(EMP)和三羧酸循环(TCA)的碳代谢流量增加,从而提高了γ-PGA的产量。 因此本研究中推测氧载体可以提供EMP、TCA 循环中需要ATP 的酶和γ-PGA 合成酶足够的氧气,促进了菌体生长和γ-PGA 的产生。 本研究在发酵培养基中初始添加体积分数为1%的正庚烷,发现菌体量明显提高,γ-PGA 产量也由原来的23 g/L 提高到28 g/L(图2 (a)),但是过量的正庚烷对菌体毒害作用明显,使得菌体OD600明显下降,体积分数为10%的正庚烷使得菌体完全不能生长,因此正庚烷对菌体的毒性限制了其应用。 PDMS 作为一种无毒无害的聚合物, 在发酵培养基中添加PDMS,发现随着PDMS 添加量的增加,菌体生长速率明显提高, 产物质量浓度随着菌体的生长而增加。 添加体积分数10%~20%左右的PDMS 后,菌体生长较原来提高了3~5 倍,γ-PGA 产量能达到32 g/L,较对照组提高了39%(图2(b))。

图2 正庚烷和PDMS 添加量对菌体生长和γ-PGA 产量的影响Fig. 2 Effects of the addition of n-heptane and PDMS on cell growth and γ-PGA production
2.3 正庚烷和PDMS 添加时间对生物量和γ-PGA 产量的影响
进一步考察了氧载体在菌株前期、中期和后期添加对菌体生长和产γ-PGA 的影响。 如图3 所示,无论是正庚烷还是PDMS, 都是在发酵前期添加利于菌体生长和γ-PGA 的产生, 推测其原因可能在于Bacillus subtilis HB-1 产γ-PGA 属于生长偶联型, 菌体快速生长的同时才能产生更多的目的产物,一旦菌体生长受到限制,就会引起产物γ-PGA合成的相关酶的酶活降低,进而降低前体L-谷氨酸的转化率,降低了产物γ-PGA 的质量浓度。 通过比较γ-PGA 产量, 发现正庚烷和PDMS 最适添加时间均为0 h,鉴于正庚烷的细胞毒性,最终选择在初始发酵培养基中添加体积分数10% PDMS 来提高γ-PGA 产量。
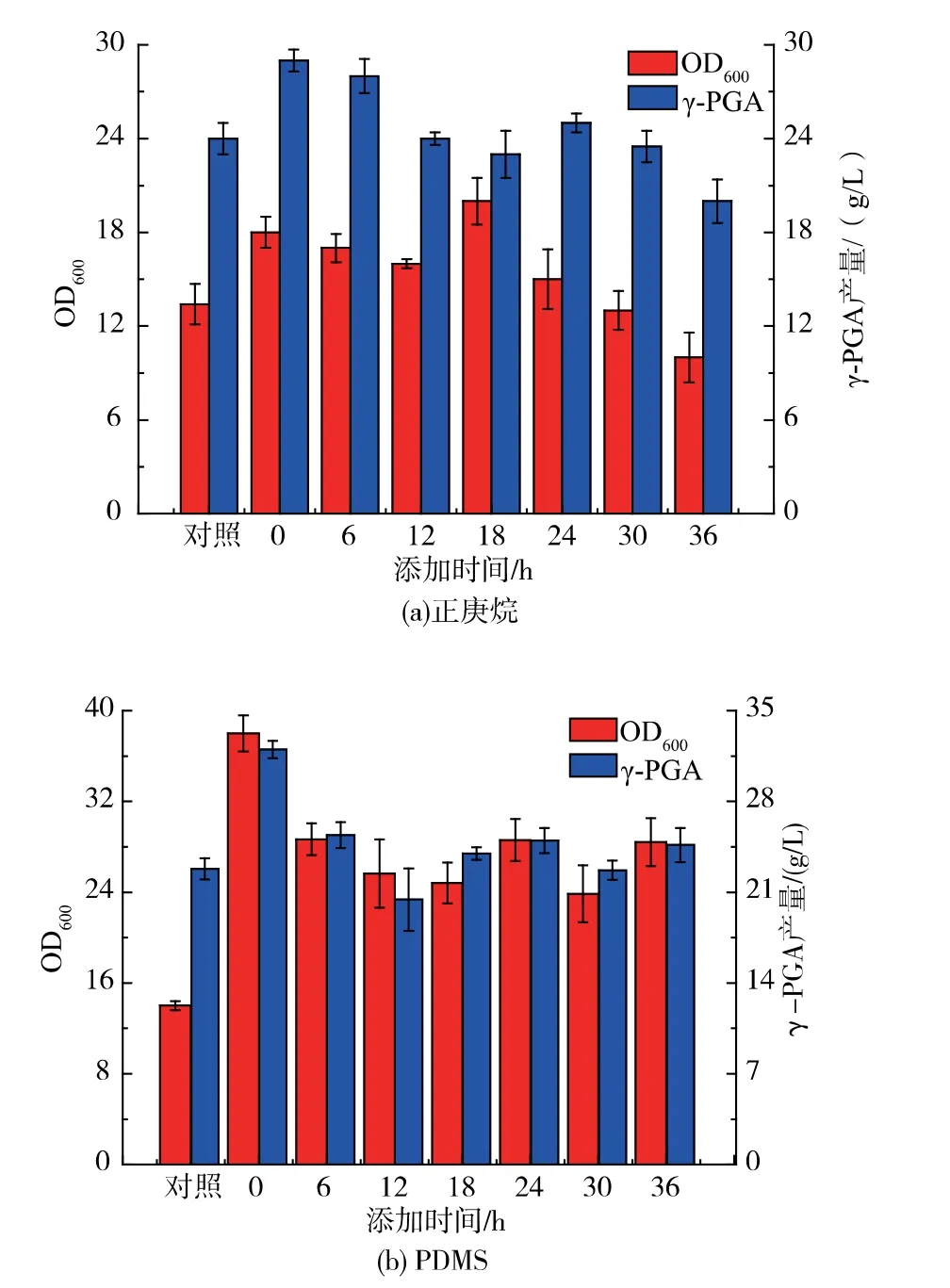
图3 正庚烷和PDMS 添加时间对菌体生长和γ-PGA 产量的影响Fig. 3 Effects of the addition time of n-heptane and PDMS on cell growth and γ-PGA production
2.4 前体L-谷氨酸添加时间和添加量的确定
作为L-谷氨酸依赖型的菌株, 前体L-谷氨酸的添加是决定γ-PGA 产量的重要的因素之一,前期实验发现原始培养基添加少量的前体L-谷氨酸不能满足菌体合成大量的γ-PGA,而培养基中直接添加过量的前体L-谷氨酸会使得菌体将其作为碳源利用而造成前体L-谷氨酸的浪费难以高效合成产物γ-PGA。因此选择在菌体生长对数期及稳定期前后一次性添加一定量前体L-谷氨酸(终质量浓度为5 g/L)。 如图4(a),在发酵18 h 添加时,γ-PGA产量较高,约为34 g/L,比对照组产量提高了30%,前体L-谷氨酸的转化率为75%,相比对照组提高了15%。推测γ-PGA 合成酶的活性与菌体生长密切相关,在对数生长期间菌体γ-PGA 合成酶酶活较高,在此期间加入前体L-谷氨酸,可以促进其高效转化为产物γ-PGA,待菌体生长到稳定期后,γ-PGA 合成酶酶活降低, 导致前体L-谷氨酸利用率降低,产物质量浓度降低。 同时,合适的前体L-谷氨酸添加质量浓度对产物产量也很重要,图4(b)显示,添加终质量浓度为10 g/L 的前体L-谷氨酸得到了43 g/L的产物,前体L-谷氨酸转化率提高到86%。

图4 前体L-谷氨酸添加时间和添加质量浓度对菌体生长和γ-PGA 产量的影响Fig. 4 Effects of precursor L-glutamic acid addition time and addition amount on cell growth and γ-PGA production
2.5 3 L 发酵罐分批发酵
在添加了体积分数为10%的氧载体PDMS 的基础上,进行3 L 发酵罐发酵。 从图5(b)可以看出发酵初期菌体生长迅速,在20 h 左右OD600达到55以上,生物量比没有添加氧载体的对照(图5(a))提高了1.2 倍, 菌体快速生长的同时伴随葡萄糖、木糖、 前体L-谷氨酸的快速消耗和产物γ-PGA 的同步生成,说明菌体生长和产γ-PGA 是同步进行的。氧载体的添加促进菌体生长的同时也促进了前体L-谷氨酸的转化, 对照组40 g/L 的前体L-谷氨酸最终得到26 g/L 的γ-PGA, 前体L-谷氨酸转化率为65%;而添加了体积分数10% PDMS 后,得到35 g/L 的γ-PGA,转化率提高到87.5%。说明氧载体的添加有效提高了前体L-谷氨酸的转化率,从而提高了γ-PGA 的产量。
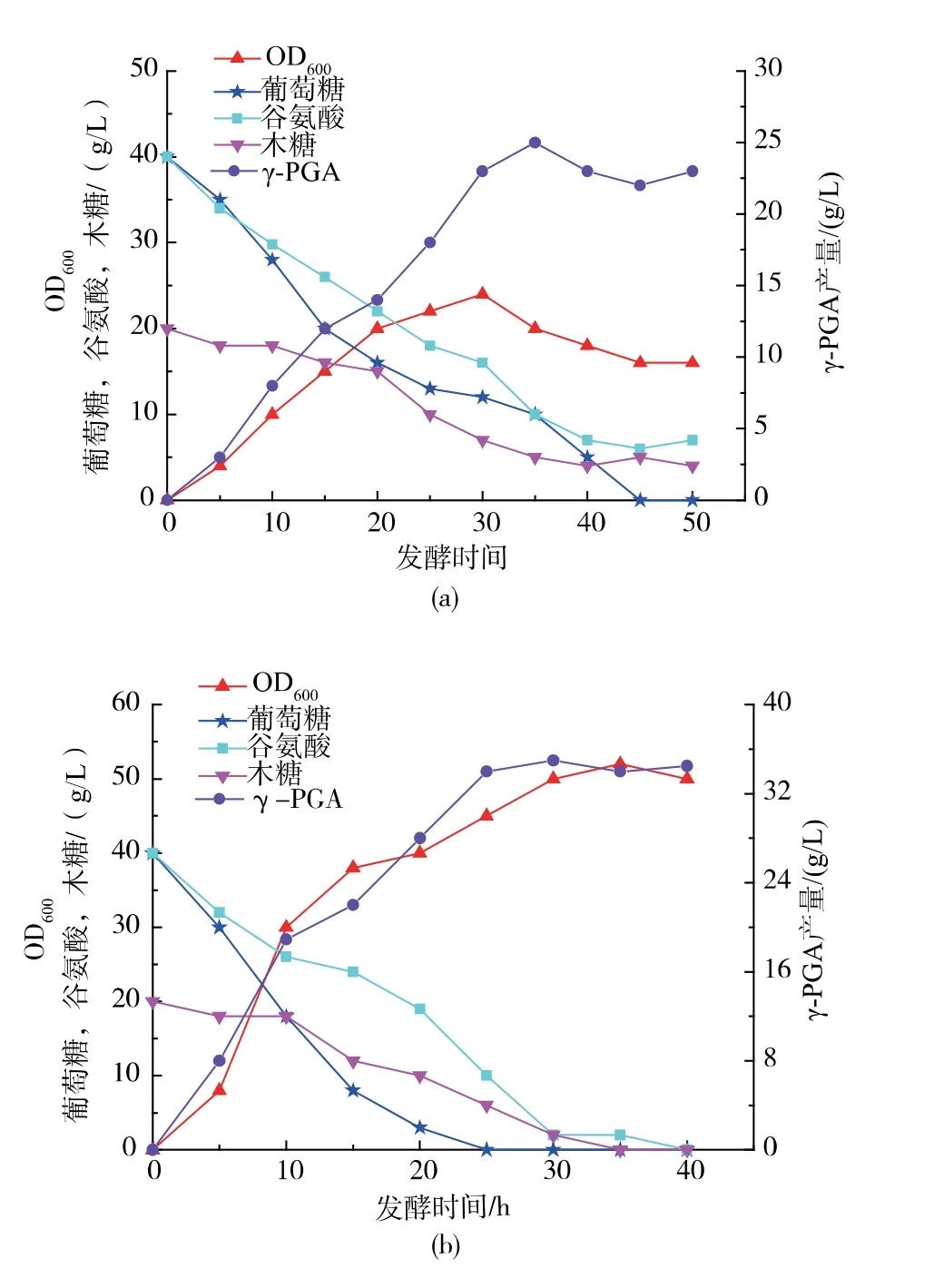
图5 3 L 发酵罐批次发酵曲线对照添加体积分数10%PDMSFig. 5 Batch fermentation curves of control and 10%PDMS in 3 L fermentation tank
2.6 3 L 发酵罐一次性补加前体谷氨酸发酵
前体L-谷氨酸供应不足也可能会造成产物γ-PGA 的产量无法进一步提高, 在发酵过程中,25 h左右前体L-谷氨酸开始大量消耗,质量浓度降低到20 g/L,此时添加终质量浓度为10 g/L 的前体L-谷氨酸,菌体开始大量利用其产生γ-PGA,最终获得了45 g/L 的γ-PGA, 前体L-谷氨酸的转化率进一步提高到90%(图6)。
2.7 3 L 发酵罐流加碳源和前体谷氨酸发酵
在发酵过程中,碳源是菌体生长的主要因素[23],枯草芽孢杆菌HB-1 生长和发酵产γ-PGA 是同步进行的,因此如果碳源消耗殆尽,菌体不再生长,那么即使有充足的前体L-谷氨酸,γ-PGA 合成酶的合成能力也有限。 故采用流加碳源的方式以满足菌体的能量供应,同时流加前体L-谷氨酸使得菌体大量合成γ-PGA。 结果如图7 所示,维持碳源质量浓度在5 g/L 上下, 维持前体L-谷氨酸在10 g/L 左右,在发酵50 h 后产物γ-PGA 高达52 g/L,较单纯补加前体L-谷氨酸提高了15%,比摇瓶发酵提高了1 倍左右。
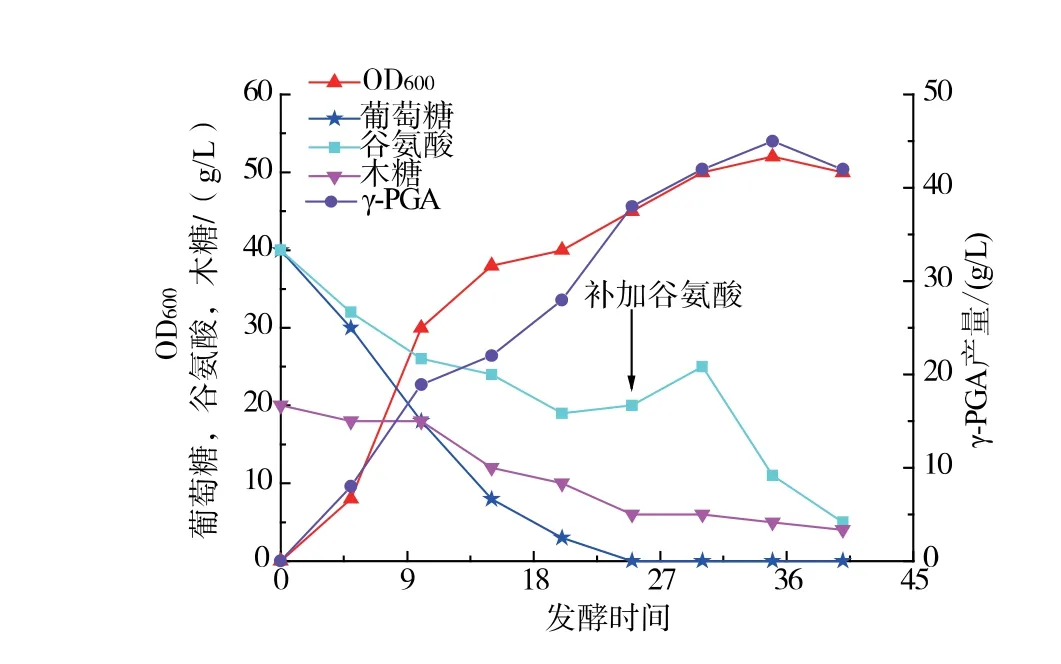
图6 枯草芽孢杆菌HB-1 一次性补加前体L-谷氨酸发酵曲线(体积分数10% PDMS)Fig. 6 Fermentation curve of Bacillus subtilis HB-1 with one -time supplement of precursor L -glutamate(10% PDMS)

图7 枯草芽孢杆菌HB-1 流加碳源和前体L-谷氨酸发酵曲线(体积分数10% PDMS)Fig. 7 Fed-batch fermentation curve of Bacillus subtilis HB-1 (10% PDMS)
2.8 发酵产物的提取与鉴定
2.8.1 发酵产物的提取发酵获得的混合液离心去除菌体,根据γ-PGA 不溶于乙醇的性质,采用3倍体积的乙醇沉淀目的产物, 将其烘干后得到图8(a)所示的黄色粗品,之后将其重新溶于蒸馏水中,采用透析的方法除去粗品中的小分子杂质,将透析得到的产物冷冻干燥得到白色的纯品γ-PGA(图8(b)),采用酸水解的方法测定产物中D/L 谷氨酸的含量,确定γ-PGA 的纯度为96%(质量分数)。

图8 提取的发酵产物样品Fig. 8 Extracted crude and pure fermentation products
2.8.2 发酵产物的红外图谱傅立叶红外光谱可以根据吸收峰的位置和强度判断未知化合物的化学基团,从而确定其分子结构。 图9 为发酵纯化的产物在4000 ~500 cm-1的傅立叶红外光谱图,3374.87 cm-1处吸收峰为N-H 对称伸缩振动带; 2919.75 cm-1为-CH2的伸缩振动吸收峰;1592.06 cm-1处吸收峰为酰胺中-C=O 伸缩振动带(酰胺吸收带I);1402.95 cm-1处吸收峰为酰胺中N-H 弯曲振动和C-N 伸缩振动的耦合(酰胺吸收带II); 1259.82 cm-1为C-N 伸缩振动(酰胺吸收带III), 以上特征峰的存在表明产物为聚酰胺类化合物。

图9 发酵产物的红外光谱图Fig. 9 Infrared spectrum of the fermentation product
2.8.3 发酵产物酸水解混合液分析鉴定采用酸水解的方法分解发酵产物,采用氨基酸分析仪测定目的产物的氨基酸组成,结构如图10 所示,发酵产物的单体组成全部是D/L 谷氨酸,无其他氨基酸组分,D/L 谷氨酸衍生化后, 测定D/L 谷氨酸的比例,结果表明发酵产物D/L 配比为1∶3(图11)。 结合红外光谱的结果,证明发酵产物为D/L 谷氨酸通过酰胺键连接而成的多肽类化合物。

图10 氨基酸分析仪测定发酵产物的氨基酸组分Fig. 10 Determination of the amino acid composition of the fermentation product by an amino acid analyzer

图11 谷氨酸衍生化法测定发酵产物的D/L 谷氨酸比例Fig. 11 Determination of D/L glutamic acid ratio of fermentation products by glutamic acid derivatization
2.8.4 产物相对分子质量的测定采用凝胶过滤色谱法测定发酵产物的相对分子质量,得到不同相对分子质量的峰吸收,主要峰为peak Ⅰ,相对分子质量为1000 万左右, 目前没有报道其他微生物发酵制备如此高相对分子质量的γ-PGA,此外还存在一些小峰,但是含量较低,说明γ-PGA 在前体L-谷氨酸在发酵过程中逐步合成低相对分子质量的短链γ-PGA,在发酵过程中不断延长,最终得到高达1000 万的γ-PGA,见图12。
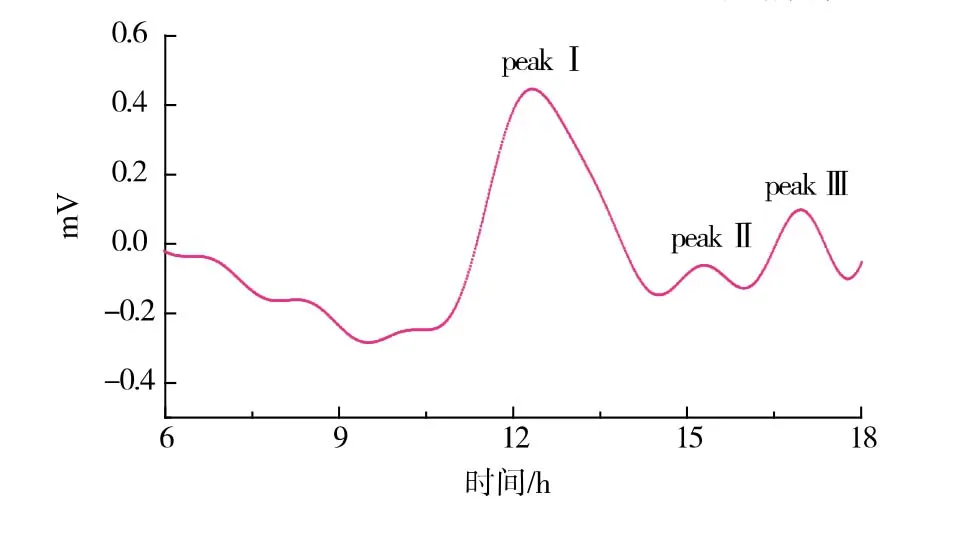
图12 γ-PGA 相对分子质量的测定Fig. 12 Molecular weight of γ-PGA
3 结 语
作者采用在发酵过程中添加氧载体(PDMS)和前体L-谷氨酸来提高Bacillus subtilis HB-1 产γ-PGA 的能力,在摇瓶发酵实验中,在发酵培养基中添加体积分数10%的PDMS, 使得菌体生物量提高了3~5 倍,γ-PGA 产量提高了39%;在菌体生长对数期添加终质量浓度为10 g/L 的前体L-谷氨酸,γ-PGA 产量达到43 g/L,前体L-谷氨酸转化率达到86%。 在3 L 发酵罐上控制流加碳源和前体L-谷氨酸的质量浓度,γ-PGA 产量最终达到52 g/L,较原始提高了1 倍。 发酵产物经红外,氨基酸分析仪测定为D/L 谷氨酸经过酰胺键连接成的多肽类化合物,产物γ-PGA 中D/L 谷氨酸比例为1∶3,相对分子质量高达1000 万。

