马铃薯气孔密度表皮模式因子StSTOMAGEN的克隆和功能分析
王艳丽,谢 天,张春丽,李娟娟,刘溢健,李红兵,殷俐娜,王仕稳,邓西平,,可庆波
(1.西北农林科技大学生命科学学院,陕西 杨凌 712100; 2.西北农林科技大学水土保持研究所,陕西 杨凌 712100)
随着全球气候变化和生态环境的恶化,植物经常会遭受到高温、高盐、干旱等各种各样的非生物胁迫[1],而干旱胁迫会影响植物的生长发育、地理分布以及农作物的产量[2]。因此,提高农作物的抗旱性,保证干旱胁迫下农作物的产量对保障全球粮食安全具有重要意义。
气孔是高等植物茎叶等器官表皮上由1对保卫细胞特化而成的小孔结构,在植物蒸腾作用、呼吸作用和光合作用中发挥重要作用[3]。植物通过气孔吸收CO2进行光合作用,从而促进自身生长;同时,植物通过气孔的蒸腾作用推动物质运输[4]。植物完成自身生长需要在最大化光合作用效率的同时最小化水分流失[5],所以气孔调控对于植物生存是至关重要的。
随着陆地植物的进化,气孔的形成方式也经历了一系列的演化[4],但是大量研究表明植物气孔发育都经历不对称分裂、细胞命运转化、胞间信号转导等一系列复杂的发育调控事件[6],其分布几乎都遵循“单细胞间隔法则(One cell spacing)[7]”。转录因子、信号肽以及促分裂原活化蛋白激酶信号等在气孔发育过程中发挥重要作用[6]。目前已发现的在气孔发育过程中发挥作用的细胞间信号转导因子都是属于类表皮模式因子家族(EPIDERMAL PAT-TERNING FACTOR-LIKE family, EPFL)的小分子分泌多肽,这些多肽通常具有N末端的分泌信号序列和C末端的相对保守的6个或8个半胱氨酸残基, 前者在蛋白成熟过程中被剪切掉, 后者可能参与形成分子内二硫键[4]。拟南芥的EPFL家族包含11个成员[9],EPF1和EPF2是以负调控因子的作用来调节特定时期的气孔发育。EPF1是最早发现的EPFL家族成员, 该基因在晚期的拟分生细胞、保卫母细胞和早期的保卫细胞中表达,EPF2的氨基酸序列与EPF1有很高的同源性,其作用时间早于EPF1,在早期的气孔谱系细胞中表达[10]。EPF1和EPF2都依赖类受体膜蛋白TOO MANY MOUTHS(TMM)和ER家族(ERECTA family,ERf)类受体激酶发挥功能[11]。而STOMAGEN是EPFL家族中目前已知唯一的正调控因子,其蛋白质包括N末端分泌信号序列,前肽结构域和成熟肽结构域[4]。过表达STOMAGEN基因可以产生簇状气孔群, 而利用RNAi敲除STOMAGEN则使得植株几乎不形成气孔,这些均表明STOMAGEN能够促进气孔发育[12]。与EPF1和EPF2类似,STOMAGEN发挥作用需要TMM存在。这表明STOMAGEN可能是通过与EPF1和EPF2竞争性地结合TMM从而促进气孔的形成[4]。前人研究表明,细胞中STOMAGEN的表达水平与气孔密度呈正相关,在拟南芥中过表达STOMAGEN可以显著增加气孔密度,同时植株的光合作用得到明显改善[12],但是STOMAGEN基因在植物逆境胁迫响应中的作用尚不清楚。
本研究克隆了马铃薯气孔密度表皮模式因子StSTOMAGEN基因,分析了该基因的表达模式,并通过农杆菌介导的遗传转化获得了过量表达StSTOMAGEN基因的拟南芥株系。通过分析转基因拟南芥的气孔密度和抗旱性,初步揭示StSTOMAGEN在气孔运动及植物干旱胁迫响应中的作用,以期为通过基因编辑技术改变马铃薯气孔密度调节因子StSTOMAGEN基因的表达水平,培育抗旱节水型马铃薯新品种奠定基础。
1 材料与方法
1.1 试验材料
植物材料有拟南芥[哥伦比亚生态型(Col-0)]和马铃薯(大西洋品种)。将拟南芥种子在超净台中用75%的酒精、1%次氯酸钠溶液消毒后,用灭菌水冲洗3次,4℃低温处理3 d。随后播种在MS [1/2MS+3%蔗糖+0.5%琼脂(pH 5.6~5.8)]培养基,放于光照培养箱中(光周期为14 h/10 h,光/暗、相对湿度80%、光照强度120 μmol·m-2·s-1、温度22℃)培养。生长7 d后,选取长势一致的幼苗移栽到基质∶蛭石∶珍珠岩=3∶1∶1的土壤中,放置于22℃,16 h/8 h,光/暗,60%的相对湿度的温室中生长。
将继代培养15 d长势一致的马铃薯组培苗转移至花盆(7 cm×7 cm×6.5 cm)中,生长温度为25℃,相对湿度为60%,光周期为16 h/8 h(光/暗),光照强度为120 μmol·m-2·s-1。驯化1周,将马铃薯苗转移至温室中培养45 d。将马铃薯植株的茎尖、茎、叶、根和块茎进行取样,迅速放于液氮冷冻用于RNA的提取。对于不同胁迫处理,将继代培养18 d的马铃薯组培苗移至霍格兰营养液中培养,3周后对植株进行逆境处理。包括:5%的聚乙二醇(PEG6000)溶液、100 mM NaCl溶液、50 μm脱落酸(ABA)溶液,分别在处理0、1、4、8、12、16、20 h和24 h后从顶部取第二片完全展开叶并立即置于液氮中冷冻,用于胁迫条件下基因表达模式研究。
1.2 研究方法
1.2.1 RNA的提取及荧光定量PCR 采用Trizol(Invitrogen)提取马铃薯不同组织的总RNA,用DNase进行纯化处理。然后取2 μg纯化后的总RNA,用TaKaRa公司的反转录试剂盒PrimScriptTMII 1st Strand cDNA Synthesis Kit,按照说明书进行反转录反应。得到cDNA后进行实时定量PCR,实时定量 PCR 采用QuantiTect SYBR Green PCR 试剂盒(TaKaRa,Dalian,China),用LightCycler 480 II系统(Roche,Basel,Switzerland)进行相关基因表达量分析。qRT-PCR所用的反应体系:2× UltraSYBR Mixture 10 μL,上游引物(10 mmol·L-1)1 μL,下游引物(10 μmol·L-1)1 μL,cDNA 1 μL,ddH2O 7 μL,共20 μL。最后采用 2-ΔΔCT法进行定量数据分析,每一处理进行3次生物学重复。引物序列见表1。
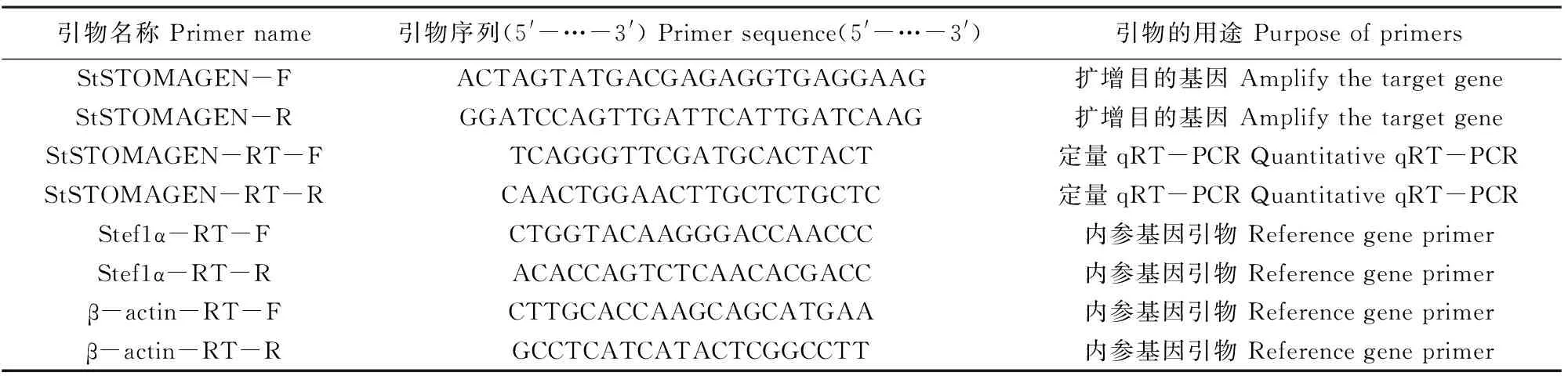
表1 研究所用引物序列
1.2.2StSTOMAGEN基因的克隆和表达载体的构建 以1.2.1中获得的马铃薯的cDNA为模板,按照KOD Plus-Neo(Toyobo, Osaka, Japan)试剂盒的说明书进行PCR扩增,得到目的基因StSTOMAGEN,引物见表1。PCR反应程序为:95℃预变性3 min,95℃ 变性10 s,55℃ 退火30 s,72℃延伸30 s,35个循环。利用SpeI和BamH I对克隆序列和表达载体pCAMBIA1305进行双酶切,利用DNA连接酶(TaKaRa,大连)连接获得重组质粒,并将其转化至农杆菌(Agrobacterium)EHA105。
1.2.3 系统进化分析 以StSTOMAGEN基因推导的氨基酸序列为目标序列在NCBI BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)网站上进行BlastP分析,获得各物种同源基因的蛋白序列,并用MEGA 6.0软件对StSTOMAGENA蛋白序列与荠菜(Capsellarubella, XM_023779504.1)、亚麻荠(Camelinasativa, XR_757444.2)、琴叶拟南芥(Arabidopsislyrate,XM_002863154.2)、拟南芥(Arabidopsisthaliana,NM_117366.4)、山嵛菜(Eutremasalsugineum, XM_006414920.2)、白菜(Brassicarapa, XM_009109421.3)、石榴(Punicagranatum, XM_022160362.1)、大豆(Glycinemax, NM_001255343.2)、木薯(Manihotesculenta, XM_021776765.1)、橡胶树(Heveabrasiliensis, XM_021821217.1)、猩红猴面花(Erythrantheguttatus, XM_012979755.1)、番茄(Solanumlycopersicum, XM_004245347.4)、辣椒(Capsicumannuum, XM_016723913.1)、胡萝卜(Daucuscarota, XM_017397194.1)和烟草(Nicotianatabacum, XM_016654878.1)的蛋白序列进行比对,并使用最大似然法生成系统进化树,分析StSTOMAGEN的进化关系。
1.2.4StSTOMAGEN的亚细胞定位 将含有pCaMV35S-StSTOMAGEN-GFP表达载体的农杆菌和含P19沉默抑制基因表达载体的农杆菌用注射缓冲液(10 mM MES,10 mM MgCl2和100 μM acetosyringone)稀释到OD600=1,然后按照1∶1将二者混合后,注射到4周龄的烟草叶片中,每株注射3片叶片,每片叶片4个注射点,室温暗处培养3 d后,通过生物激光共聚焦显微镜(Leica TCs SP2,488 nm,633 nm)观察绿色荧光蛋白(GFP)信号,根据荧光的位置确定蛋白的亚细胞定位。
1.2.5 转基因拟南芥的获得 将pCaMV35S-StSTOMAGEN-GFP表达载体转化至农杆菌GV3101后,利用浸花法[13]将该重组载体对拟南芥Col-0进行遗传转化,获得转基因植株(称为ST),收获浸染后的T0代种子,消毒后再播种于含有25 μg·mL-1潮霉素的1/2 MS固体培养基上,种子萌发后,根部正常延伸且叶片保持绿色的即可初步认定为筛选的T1代转基因阳性苗,移栽至土壤中进一步生长,收获T2代种子。在1/2 MS筛选培养基(含25 μg·mL-1潮霉素)继续筛选,可获得纯合株。最后分别进行DNA水平(基因组DNA的PCR)和RNA水平(qRT-PCR)鉴定,确定T-DNA成功插入拟南芥基因组并且StSTOMAGFEN基因在拟南芥中得到表达。
1.2.6 气孔密度的观察 分别取生长30 d的ST和WT拟南芥幼苗同一叶位、长势健康的叶片,根据Sugano等[12]的方法,首先用固定液(无水乙醇∶乙酸=9∶1)对叶片固定7 h以上,然后用脱色液(水合氯醛溶液∶水∶甘油=8∶2∶1)进行脱色,最后用1 μg·mL-1番红染色,在奥林巴斯BX51电子显微镜(Olympus America Inc., Melville, NY, USA)下观察气孔数目。每片莲座叶上表皮选取4~6个视野进行拍照,统计气孔数目,计算气孔密度(个·mm-2),每组重复3次。
1.2.7 转基因拟南芥的光合指标测定 待ST和WT拟南芥生长6周后,选取同一叶位的叶片用LiCOR 6800(Li-COR, Lincoln, NE, USA)便携式光合作用测定系统,在9∶00—12∶00进行测定。通过开放式气路,设定温度为25℃,CO2浓度为719.6 mg·m-3,空气相对湿度为50%,光强梯度为1 000、800、600,400、300、250、200、150、100、50 μmol·m-2·s-1和0 μmol·m-2·s-1PAR,间隔2~3 min的条件下测定叶片在每一光强下的净光合速率(Pn)、气孔导度(gs)和蒸腾速率(Tr)。同时使用FluorPen FP 100(PSI, Drasov, Czech Republic)测定Fv/Fm,即PSⅡ最大光量子产量。
1.2.8 叶片相对含水量的测定 对于对照和干旱处理的拟南芥,采用烘干称量法测定叶片相对含水量。每组处理采集5片新鲜的完全展开叶,迅速测定其鲜重(FW),然后将叶片浸入去离子水中,放置24 h后称其饱和鲜重(SW),之后将叶片置于烘干箱内烘至恒量,称其干重(DW),采用以下公式计算叶片相对含水量:
1.2.9 离体叶片水分散失速率测定 摘取生长6周的WT和ST植株的相同叶位的成熟叶片,置于25℃环境下,自然风干2 h。每10 min测1次样品重量,重复3次。叶片失水率=(鲜重-风干后重量)/鲜重×100%。
1.2.10 叶面积测定 为了测定不同株系拟南芥的叶面积,将正常供水与干旱处理后采的新鲜叶片用扫描仪Epson Perfection V700 Photo scanner(Seiko Epson Corporation,Beijing,China)扫描后,用WinRRHIZO PRO 2009软件(Regent Inc.,Quebec,Canada)对其叶面积进行统计,每个株系重复3次。
1.2.11 开花时间测定 参照Zhai等[14]的方法,将移栽后的拟南芥放于光照培养箱,按1.1中的条件正常光照培养生长,等拟南芥抽薹1 cm后,统计莲座叶叶片数,用叶片数衡量开花时间。
1.2.12StSTOMAGEN过表达拟南芥的抗旱性分析 用干旱法[15]测定转基因拟南芥的抗旱性。分别将正常生长6周的ST和WT拟南芥干旱处理7 d后,然后复水2 d。在干旱处理5 d后观察植株的抗旱表型并统计转基因和野生型拟南芥的存活率并拍照,同时测量WT与ST拟南芥的地上部生物量、H2O2含量、相对含水量(RWC)、水分利用效率(iWUE)和其他气体交换参数。
1.2.13 DAB染色 取WT 和ST拟南芥同一叶位成熟叶片在自然条件下,风干1 h后,使用DAB(3,3’-diaminobenzidine-HCl)染色。然后抽真空2 min,去除染色液,加入适量的脱色液(无水乙醇)于60℃烘箱中进行脱色。
1.2.14 H2O2含量测定 参照过氧化氢含量测定试剂盒(Solarbio,Beijing,China)说明书测定WT和ST转基因拟南芥植株的过氧化氢含量,每个样品重复3次。
1.2.15 数据分析 试验数据采用Microsoft Excel 2010处理,用 SPSS17. 0(version 17.0; SPSS, Chicago, IL, USA)统计分析软件进行方差分析和Duncan显著性检验。
2 结果与分析
2.1 StSTOMAGEN基因的克隆及进化树分析
通过Joint Genome Institute Phytozome数据库(www.phytozome.com),利用基于同源性的BLAST搜索(DOE JGI,Walnut Creek,CA,USA)从马铃薯中分离出StSTOMAGEN基因的cDNA,其开放阅读框(ORF)长度为288 bp,编码含96个氨基酸的蛋白质。利用MEGA 6.0软件将StSTOMAGEN的氨基酸序列与其他15个物种的蛋白序列进行分析构建进化树(图1A),发现马铃薯StSTOMAGEN与番茄SlSTOMAGEN亲缘关系最近,同源性最高。通过比较StSTOMAGEN和AtSTOMAGEN的氨基酸序列发现,StSTOMAGEN在N端含有信号肽序列,在C端含有6个保守的半胱氨酸残基(图 1B),这表明StSTOMAGEN基因在功能上存在潜在的保守性。
2.2 StSTOMAGEN基因的表达模式
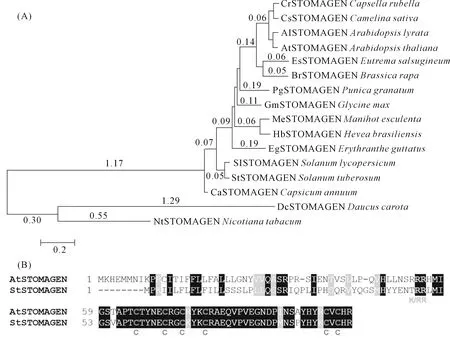
为了进一步验证StSTOMAGEN的组织表达模式,通过qRT-PCR方法检测StSTOMAGEN基因在马铃薯不同组织中的表达情况。结果显示,StSTOMAGEN基因主要在叶片中表达,在顶端未展开叶中的表达量最高,约是块茎的200倍(图 2A)。同时,StSTOMAGEN基因的表达量会随着叶位的下降而下降,在新叶中表达量较高,而在底部老叶中的表达量较低。
此外,为了研究StSTOMAGEN在细胞中的表达位置,将StSTOMAGEN-FP 融合表达载体注射到烟草叶片,用激光共聚焦显微镜观察融合蛋白的亚细胞定位。结果表明,StSTOMAGEN-GFP融合蛋白的荧光均匀分布于细胞间隙和细胞核,因此可以推测StSTOMAGEN基因编码的蛋白主要定位在植物的细胞间隙和细胞核(图 2B)。
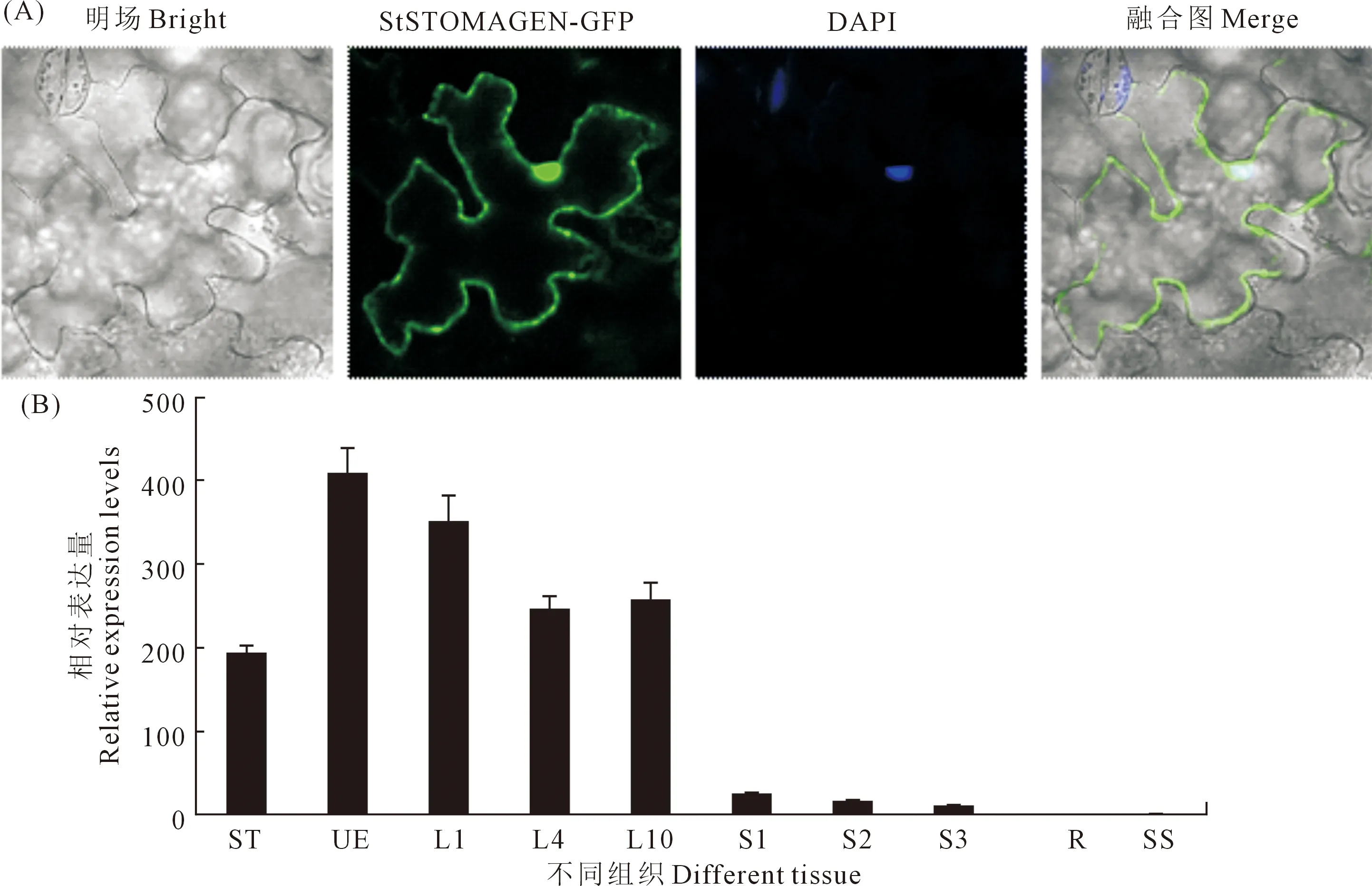
随后,对马铃薯植株进行不同的非生物胁迫处理,发现在正常条件下,该基因的表达量在一天中呈现周期性变化,长日照条件下(16 h/8 h,光/暗),在授时因子为 20 h 时表达量达到最高。PEG模拟干旱胁迫处理后,其表达量在4 h时达到峰值,ABA和NaCl胁迫处理后,其表达水平呈现出持续降低的趋势(图 3)。
2.3 过表达StSTOMAGEN基因拟南芥的分子鉴定
通过浸花法将含有StSTOMAGEN基因过表达载体的农杆菌EHA105对拟南芥进行遗传转化。经过潮霉素抗性筛选,获得8个T3代纯合株系,以野生型拟南芥为对照,对ST转基因拟南芥叶片进行PCR检测,结果如图4A所示,在8株转基因拟南芥的基因组内均检测到目的片段,而在WT拟南芥中没有检测到,说明StSTOMAGEN基因已经整合到拟南芥基因组。qRT-PCR结果如图4B,结果表明,8个ST株系的StSTOMAGEN表达水平都显著升高。选取表达量较高的ST 7-3和ST 26-6进行后续试验。通过观察气孔密度发现,这两个株系叶片的气孔密度显著增大(图4C和5B),相对于WT,分别增加了83.4%和57.2%(图4C),同时,地上部生物量也显著增大(图5A和C)。此外,WT与ST拟南芥的开花时间(图4D)和叶面积(图5D)没有显著差异,开花时莲座叶的数目都为10片左右。
注:(A)StSTOMAGEN蛋白与其他15个不同物种StSTOMAGEN蛋白的进化分析。(B)马铃薯StSTOMAGEN和AtSTOMAGEN氨基酸序列比较。黑色阴影表示相同的氨基酸残基,灰色阴影表示相似的氨基酸残基,C表示保守的半胱氨酸残基。Note:(A) Phylogenetic analysis of the StSTOMAGEN protein in 15 plant species. (B) Comparison of StSTOMAGEN and AtSTOMAGEN amino acid sequences. Identical and similar amino acid residues are shaded in black and gray, respectively. C is conservative cysteine residue.图1 StSTOMAGEN蛋白的进化分析Fig.1 Phylogenetic analysis of the deduced StSTOMAGEN amino acid sequence
注:(A)StEPF1-GFP融合蛋白亚细胞定位,比例尺为50μm;(B)StESTOMAGEN基因在不同组织的表达分析,包括:ST,茎尖;UE,顶端未展开叶;L1,第一叶;L4,第四叶;L10,第10叶;S1,第1~3茎段;S2,第4~6茎段;S3,第7~9茎段;R,根;SS,块茎;用Stef1α作为内参基因。Note: (A)Subcellular localization of the StSTOMAGEN-GFP fusion protein. Scale bars: 50 μm; (B) Expression analysis of the StSOMAGEN gene in various tissues of 2-month-old potato plants including stem tip (ST); apical unexpanded leaf (UE); 1st, 4th, and 10th leaf (L) from the top; 1st~3rd, 4th~6th, and 7th~9th stem internode (S); root (R); and storage tuber (SS), Stef1α was used as an internal control for data normalization.图2 马铃薯StSTOMAGEN基因及蛋白质的表达特征Fig.2 Molecular characterization of the StSTOMAGEN gene and the corresponding protein in potato
注:对照,正常生长条件;PEG,5%的聚乙二醇(PEG6000)溶液;NaCl,100 mMNaCl溶液;ABA,50 μm 脱落酸溶液,用Stef1α作为内参基因。Note: Control, normal growth condition; PEG, 5% polyethylene glycol (PEG6000); NaCl, 100 mM sodium chloride; ABA, 50 μM abscisic acid, Stef1α was used as an internal control for data normalization.图3 StSTOMAGEN基因在多种逆境下的表达情况Fig.3 Temporal expression analysis of the StSTOMAGEN genein mature leaves of potato plants under abiotic stress conditions
2.4 StSTOMAGEN转基因拟南芥光响应曲线测定
由图6A可知,当光照强度低于250 μmol·m-2·s-1时,3个株系拟南芥的净光合速率(Pn)随光强呈线性增加且转基因系显著高于WT;当光合有效辐射达到300 μmol·m-2·s-1及以上时,Pn保持平缓增加,当光照强度高于800 μmol·m-2·s-1时,转基因系和WT拟南芥的Pn都保持平缓,说明Pn已经达到最大值。此外,在不同光照条件下,转基因拟南芥的气孔导度(gs)都显著高于野生型。以上结果表明,气孔密度对光合作用的光响应产生显著影响,随着气孔密度增大,植物的光合能力随之增强。
2.5 过表达StSTOMAGEN基因提高拟南芥对干旱的敏感性
对获得的StSTOMAGEN转基因拟南芥进行干旱处理,7 d后,转基因拟南芥表现出大量萎蔫死亡,而WT生长状态较好(图7A)。干旱处理后,ST
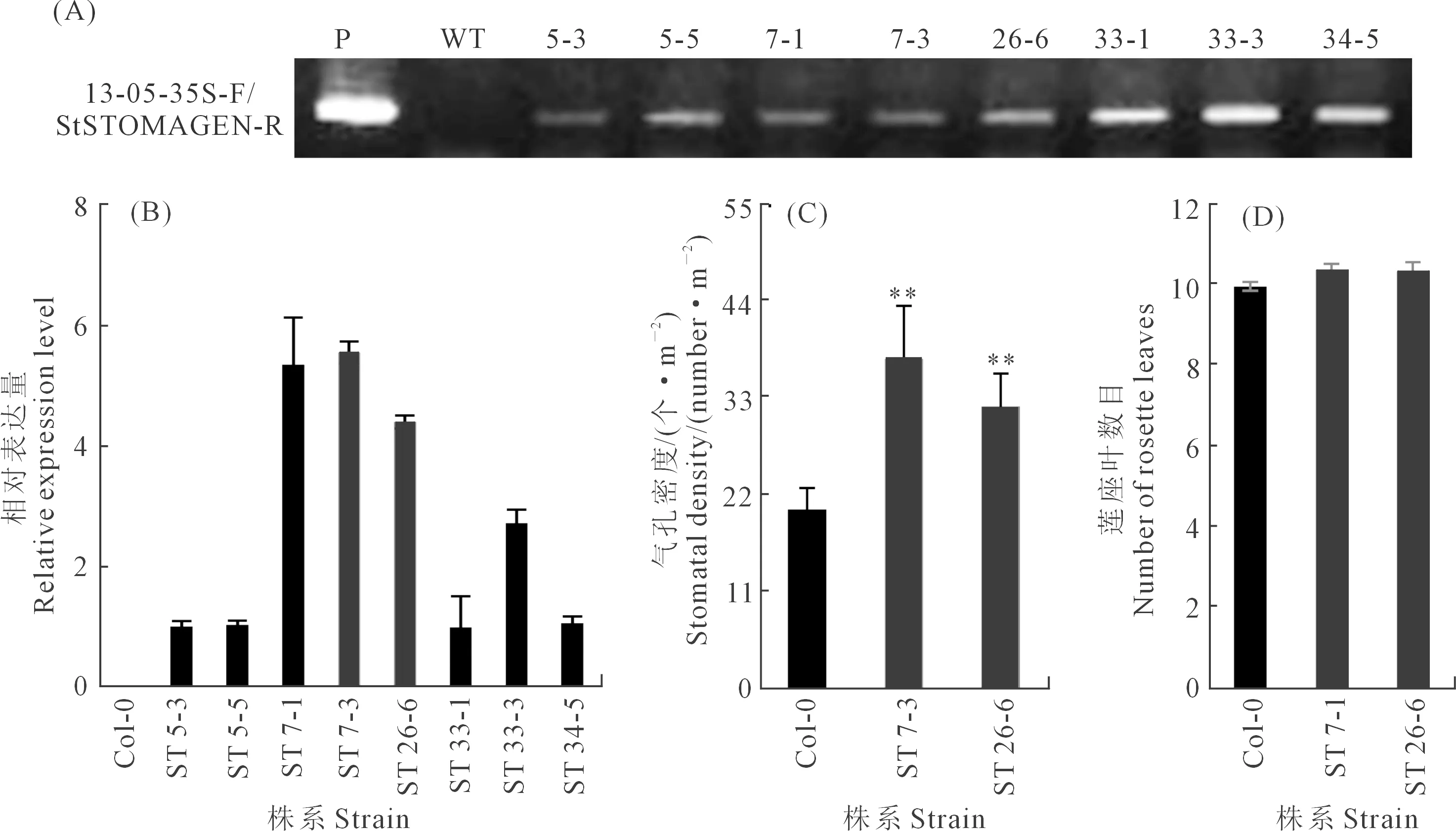
注:*,P<0.05; **, P<0.01; Duncan显著性检验。下同。Note: *,P<0.05; **, P<0.01; Duncan significance test. The same below.图4 转基因拟南芥的鉴定及气孔密度分析Fig.4 Identification and stomatal density analysis of transgenic Arabidopsis

注:(A)WT与ST转基因拟南芥株系的表型观察;(B)WT与ST转基因拟南芥株系的气孔密度观察。Note: (A) Phenotype of wild-type (WT; Col-0) and StSTOMAGEN overexpression (ST) lines after 1 month of growth in pots. (B) Photos of mature abaxial leaf epidermis of 30-day-old WT and ST plants. Scale bars: 40 μm.图5 过表达StSTOMAGEN基因拟南芥的表型分析Fig.5 Phenotypic analysis of transgenic Arabidopsis plants overexpressing StSTOMAGEN
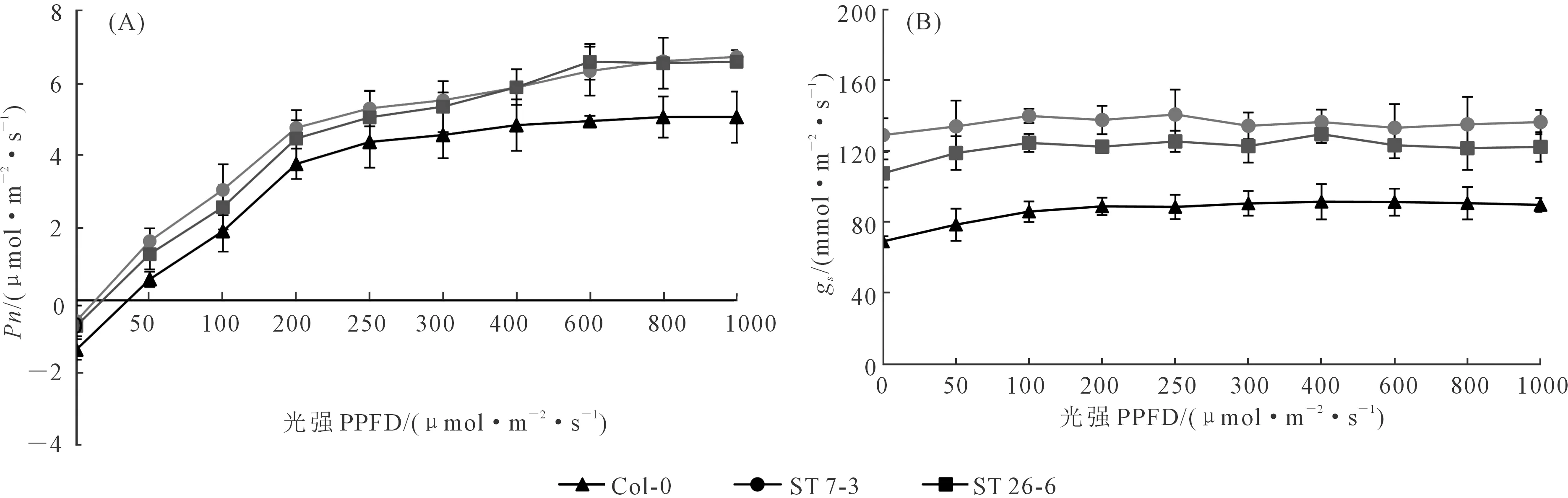
图6 不同光照强度下WT和ST拟南芥成熟叶片的光响应曲线(A)和气孔导度响应曲线(B)Fig.6 Photosynthetic response (A) and stomatal conductance (B) curres of mature leavesof WT and ST plants under different light intensities
植株的地上部生物量、RWC、Fv/Fm、Pn、gs和iWUE都显著降低(图7B-G)。复水处理2天后,WT植株的存活率显著高于ST(图7A)。此外,ST植株的水分散失速率也显著高于WT植株(图8A)。叶片经过1 h的水分散失后,通过DAB染色发现,ST株系叶片的H2O2含量也显著高于于WT(图8B和C)。以上结果表明,StSTOMAGEN在拟南芥中过量表达会降低拟南芥的抗旱性。
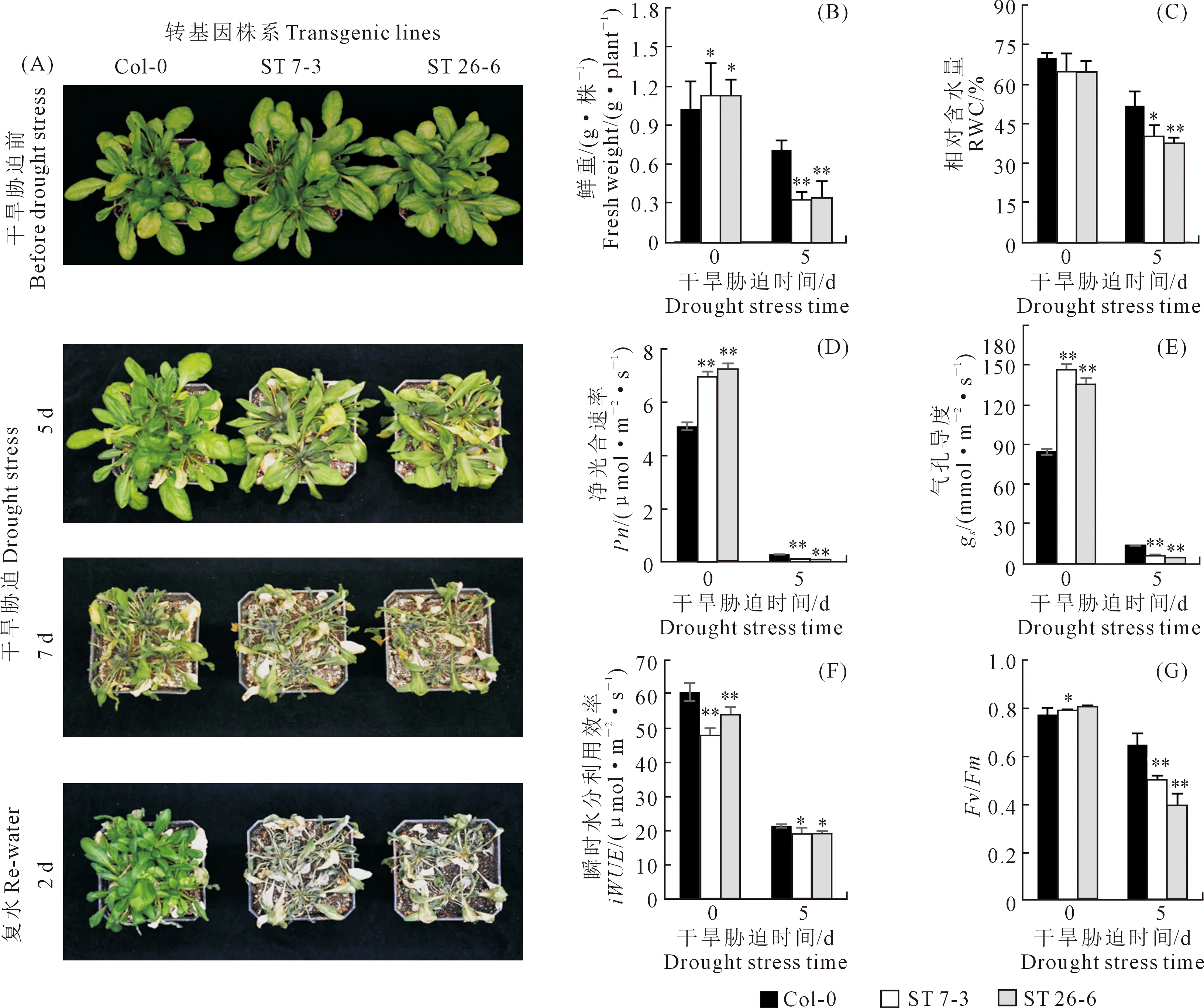
注:*:P<0.05,**:P<0.01,Duncan显著性检验。Note: *P< 0.05, **P< 0.01 by Duncan significance test.图7 干旱处理对WT和ST拟南芥生长的影响Fig.7 Influence of drought stress on WT and ST plants
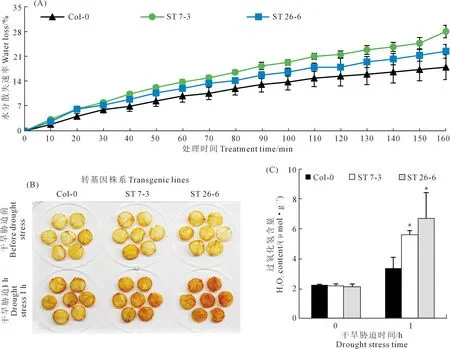
图8 WT与ST拟南芥植株的水分散失(A)和过氧化氢含量(B、C)Fig.8 Water loss (A) and hydrogen peroxide content (B,C) of WT and ST Arabidopsis plants
3 讨 论
全球气候的不断变化使植物的生长受到了严峻的威胁[16]。为了应对复杂多变的陆生环境,植物进化出了气孔,它是连接植物光合系统和大气环境的通道[17]。气孔的发育过程涉及信号转导、细胞命运转化、细胞不对称分裂等重要的发育调控事件[18]。前人研究表明,在拟南芥中过表达气孔密度表皮模式因子AtSTOMAGEN会增大拟南芥的气孔密度,同时植物的光合能力也显著提高[12,19]。本研究从马铃薯中克隆得到StSTOMAGEN基因,并对其在调控气孔发育和调节拟南芥抗旱性中的作用进行研究。
AtSTOMAGEN是拟南芥表皮模式因子(EPIDERMAL PATTERNING FACTOR,EPF)家族的成员,是目前发现的唯一一个正调控气孔密度的表皮模式因子[19]。前人研究表明,AtSTOMAGEN主要是通过竞争性代替表皮模式因子2(EPIDERMAL PATTERNING FACTOR 2,EPF2)与ER受体结合,抑制后者引起下游MAPK组分磷酸化,从而促进气孔发育[20]。在本研究中,我们发现StSTOMAGEN主要定位于细胞间隙和细胞核,其表达模式具有组织特异性,主要在嫩叶中表达,这与气孔主要分布在茎、叶等器官表皮的现象一致[21]。光合组织可能是通过其调节表皮气孔密度,优化CO2的吸收,提高光合效率[12]。此外,通过与AtSTOMAGEN的氨基酸序列比对发现,StSTOMAGEN在N端含有信号肽序列,C段含有相对保守的6个半胱氨酸残基。过表达StSTOMAGEN基因的拟南芥气孔密度显著增大,这与AtSTOMAGEN在调控拟南芥气孔密度中的作用一致[18],说明StSTOMAGEN在进化过程中功能保守。
光响应曲线是以光合产量或相对电子传递速率为一轴,而以PPFD或PAR为另一轴作图得到,可以测量叶片适应不同水平光照的能力以及叶片的最大净光合速率[22]。前人通过研究拟南芥syp121气孔开度突变体发现,尽管突变体的气孔开度降低,但是只有在高光条件下植株的CO2同化速率和气孔导度才会降低[23]。在本试验中,我们通过测定ST和WT拟南芥的光响应曲线发现,气孔密度对光合速率具有积极作用,3个株系的光合作用随着光强的增加呈上升趋势且ST拟南芥的光合速率显著高于WT,但是气孔导度随光照变化不明显。这与之前的报道是一致的,由干旱胁迫造成的气孔导度降低仅在高光强下影响植物的光合作用[24]。
干旱胁迫会使植物的生长受到抑制、光合速率降低,体内积累大量活性氧,甚至导致植物死亡[25]。为了研究StSTOMAGEN在植物响应干旱胁迫中的作用,我们对转基因拟南芥进行干旱处理并观察表型,结果显示,干旱处理7 d后,转基因拟南芥大量萎蔫甚至死亡,而野生型状态较好。进一步分析显示,干旱处理后,转基因拟南芥的地上部生物量、相对含水量、瞬时水分利用效率、二氧化碳同化速率、气孔导度、蒸腾速率都显著降低,说明在拟南芥中过表达StSTOMAGEN会降低植株对干旱胁迫的抗性。同时,利用拟南芥叶片测定水分散失速率,发现转基因拟南芥的水分散失速率显著高于野生型,表明转基因系通过提高叶片失水速率增强了对干旱胁迫的敏感性。综上,转基因植株在干旱条件下生长受到抑制可能与组织水分状况有关[26],因为ST株系叶片气孔密度增大,会造成更多水分散失,从而使植物在受到严重胁迫的情况下,叶片水势迅速降低,因此在干旱胁迫下,转基因株系无法保存叶片内的可用水分,从而表现出明显的枯黄萎蔫表型。
4 结 论
本研究对StSTOMAGEN进行干旱胁迫分析发现,该基因能被PEG诱导表达;将该基因转化拟南芥,转基因材料叶片中的气孔数量显著增多且光合速率显著增强;对转基因拟南芥和WT进行干旱胁迫处理,发现转基因材料的抗旱性降低。上述结果表明,StSTOMAGEN是气孔密度正调控因子,过表达StSTOMAGEN可提高拟南芥叶片的气孔密度而降低拟南芥对干旱胁迫的耐受性。本研究初步揭示了StSTOMAGEN基因与气孔密度和干旱应答的关系,为进一步深入探讨其分子机制提供理论依据。

