具有益生特性植物乳杆菌的筛选及其发酵特性的研究
郝露露,雷文平,刘成国,戴智勇,张岩春,汪家琦,汪镇南,周 辉,*
(1.湖南农业大学食品科学技术学院,湖南长沙 410128;2.澳优乳业(中国)有限公司,湖南长沙 410200;3.湖南沙博安科技有限公司,湖南长沙 410200)
益生菌是可以在体内生存,且生长到一定数量时可有助于宿主健康的一类微生物[1]。目前,研究较多的益生菌为乳杆菌属和双歧杆菌属,其中乳杆菌属是人体肠道以及口腔内部最常见的共生菌群,可以有效地抑制肠道内有害菌的生长,已被确定为具有应用价值的益生菌[2-3]。益生菌用于乳酸菌发酵饮料和食物已经有几千年的历史,说明了益生菌是安全的食品级微生物[4]。近年来,益生菌的研究越来越受关注,在筛选出具有应用前景的益生菌时需要考虑很多因素,例如菌株对胃肠道低酸环境的耐受性能力,如果益生菌不能够顺利地在人体小肠内进行定植,就无法发挥其益生作用[5]。研究益生菌的体内活性成本高且费时,所以人们一般采取体外实验研究其益生活性,并且,每一个菌株都必须进行相关特性的体外评价,因为不同的益生菌株之间存在着相当大的差异性[6]。
发酵乳是以生牛(羊)乳或乳粉为原料,经过杀菌,发酵后pH降低的一类产品。在众多乳制品中,发酵乳被认为是将益生菌传递到人体内的最理想载体,添加益生菌后可以将菌种本身的保健作用与发酵乳的健康功效完美结合起来[7],因此,目前关于功能性益生菌的研究受到了越来越多的关注[8]。本研究采用体外益生特性筛选的方法从4株植物乳杆菌中筛选得到1株益生特性较好的植物乳杆菌,并研究其作为辅助发酵剂的发酵特性,期望在功能性乳品中得到开发和应用。
1 材料与方法
1.1 材料与仪器
鼠李糖乳杆菌LGG、植物乳杆菌B14、C24、XC2、32E、大肠杆菌CGMCC9181、单增李斯特菌54002 均为湖南农业大学食品科技学院乳制品功能实验室保存;MRS肉汤培养基、生物胺试剂盒、血平板、革兰氏染色液试剂盒 广东环凯微生物科技有限公司;抗菌药物药敏纸片 杭州微生物试剂有限公司;胰蛋白酶(酶活力 50000 U/g) 国药集团化学试剂有限公司;胃蛋白酶(酶活力:3500 U/g) 北京索莱宝科技有限公司;其它试剂 国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 菌株的活化及菌悬液的制备 菌株活化:取-80 ℃保藏的菌种接种于MRS液体培养基中,37 ℃培养24 h,活化两代后在含1%碳酸钙的MRS培养基上划线,挑取有溶钙圈平板上的单菌落进行培养备用。菌悬液的制备:将培养24 h的发酵液10 mL于8000 r/min离心5 min,用0.85%生理盐水洗涤两次后,重悬,制成菌悬液备用[9]。
1.2.2 自聚集、共聚集试验 自聚集:参照赵维俊等[10]的方法,取1 mL菌悬液到1.5 mL的EP管中,旋涡10 s后静置5 h,取上清液测定600 nm处的吸光度值(LGG作为对照),每一株菌做3组平行实验,取平均值记录结果。计算公式如下:

式中:A1为5 h后菌种上清液在600 nm处的吸光度值;A0为静置前菌种上清液在600 nm处的吸光度值。
共聚集:取0.5 mL的菌株菌悬液加入1.5 mL的EP管内,加入0.5 mL的指示菌的菌悬液后,静置5 h,取上清液测定600 nm处的吸光度值(LGG作为对照),每一株菌做3组平行实验,取平均值记录结果。计算公式如下:

式中:A1为5 h后菌种上清液在600 nm处的吸光度值;A2为指示菌静置5 h后上清液在600 nm处的吸光度值;A1+2为指示菌和实验菌株混合静置5 h上清液在600 nm处的吸光度值。
目前秦淮河水质改善以引江换水为主体,在丰水期降水较多时,可利用降雨径流及上游来水对外秦淮河补水;在长江水位高于秦淮新河水位时,实施长江自流引水;在不满足以上条件下实施翻水,利用秦淮新河抽水站抽引长江水入秦淮河。枯水期和平水期,上游水量较小,长江水位也较低,不能实现自流,则继续采用秦淮新河站抽引江水入秦淮河。
1.2.3 疏水性试验 参照Burns等[11]的方法,分别取2 mL菌悬液于3支5 mL离心管中,依次加入2 mL二甲苯、十六烷和乙酸乙酯,涡旋振荡2 min,于通风厨静置30 min,测定水相吸光值A1,每组平行测定3次(LGG作为对照),计算公式如下:

式中:A0是菌悬液在波长600 nm的初始吸光度值,A1是静置30 min后的吸光度值。
1.2.4 模拟胃肠液试验 人工胃液和肠液参照娄利娇等[12]的方法配制,人工胃液:配制pH为3.0的溶液,量取1 mol/L HCl 20 mL,用氢氧化钠调节pH为3.0,加入胃蛋白酶并溶解,使其质量浓度为1 g/100 mL。采用0.22 μm微孔滤膜除菌,制得人工胃液备用。人工肠液:取磷酸二氢钾6.8 g,加水500 mL使溶解,用40%氢氧化钠溶液调整pH至6.8,另取胰蛋白酶10 g,加水适量使溶解,将两液混合后,加水稀释至1000 mL,用孔径0.22 μm的微孔滤膜过滤除菌,制得人工肠液备用。
参照杨静等[13]的方法,并稍作改动,取0.5 mL菌悬液加入到4.5 mL模拟胃液和肠液中,混合均匀,37 ℃培养3 h。分别于0 h和3 h取出培养液并做适当稀释涂布,37 ℃培养48 h,测定活菌数,计算存活率(%)(LGG作为对照)。

1.2.5 药敏试验 采用药敏纸片琼脂扩散法(K-B法)[14]进行药敏试验。
1.2.6 溶血性试验 将实验菌株培养24 h后点种于血琼脂培养基上,每株菌在同一个平板上点种3次,然后在37 ℃培养24 h后观察是否有溶血现象产生。以金黄色葡萄球菌作为阳性对照。
1.2.7 生物胺试验 取0.5 mL的菌悬液加入到赖氨酸脱羧酶和氨基酸脱酸酶对照的试剂瓶中,并加入0.5 mL的液体石蜡后放入培养箱中,48 h后观察实验结果。
1.2.8 黏附试验 细胞培养:取冻藏的Caco-2细胞复苏,转入培养瓶中,加入DMEM完全培养液,置于二氧化碳培养箱中37 ℃培养,每隔2 d换液一次,当细胞的融合度达到 70%~80%时,进行传代培养[15]。参照Nueno-Palop等[16]的方法进行菌株B14的黏附试验,计算公式如下:

1.2.9 发酵特性的研究
1.2.9.1 菌株的驯化 将B14培养液和脱脂乳培养基按照1∶1的比例混合培养,得到接种脱脂乳,37 ℃培养24 h,之后每次驯化逐步增加脱脂乳培养基的用量,减少MRS培养基的用量,直至MRS培养基添加量为零时驯化完成。
1.2.9.2 发酵乳的制备 称取质量分数为12%的脱脂乳溶于蒸馏水中,95 ℃灭菌5 min,冷却,商业发酵剂和菌株B14分别按照3%的添加量添加到发酵乳中,然后分装发酵。分别在发酵0、3、9、12、24 h时测定其发酵乳的黏度、pH和滴定酸。
1.2.9.3 黏度的测定 将发酵乳置于室温(25 ℃)一段时间后,采用数显黏度测定仪测定发酵乳的黏度,3号转子进行测定,测定时间30 s,每个样品平行测定3次。
1.2.9.4 发酵乳pH和滴定酸的测定 pH的测定:采用数显pH计测定发酵乳的pH。每个样品平行测定3次。滴定酸的测定:按照食品安全国家标准GB-5009.239-2016食品酸度的测定方法进行测定,每个样品平行测定3次。
1.3 数据处理
数据结果用均值±标准差表示,试验数据由Excel 2010、origin 2018和DPS数据统计软件计算处理,用T-检验进行分析,P<0.05认为是有显著差异。
2 结果与分析
2.1 自聚集、共聚集的试验结果
自动聚集能力是指菌体在培养过程中,大量并快速的繁殖从而导致其自行成团的现象[17]。4株乳酸菌的自聚集能力如图1所示,其中,菌株B14与其它菌株呈现出显著差异,菌株B14的自聚集能力达到85.582%±2.363%。4株菌株和LGG与致病菌共聚集能力如图2所示,所有待试菌株与致病性大肠杆菌、单增李斯特菌的共聚集能力均较强。其中,菌株B14与致病性大肠杆菌和单增李斯特的共聚集能力分别为74.681%±1.856%、76.248%±1.361%,均高于对照菌株LGG,且与其它菌株(除32E)具有显著性差异(P<0.05)。

图1 4株植物乳杆菌的自聚集能力

图2 4株植物乳杆菌的共聚集能力
2.2 菌株的疏水性结果
益生菌疏水性的大小可以初步反映其对肠道上皮细胞的黏附力的大小[18]。细菌的表面疏水性与粘附能力呈正相关性,通过对疏水性的研究可筛选出潜在的高黏附性菌株[19]。本实验中采用二甲苯、乙酸乙酯和十六烷检测表面疏水性,4株菌对这三种有机溶剂的疏水能力如图3所示,菌株间的疏水性存在着较大的差异,每株乳酸菌对不同的有机溶剂的表面疏水性也存在着差异,菌株B14对三种有机溶剂均表现出较高的疏水性,其中,对乙酸乙酯的疏水率达到62.146%±2.959%,对二甲苯的疏水率达到88.419%±5.319%,对十六烷的疏水率达到81.864%±4.426%,与其它菌株相比,具有显著性差异(P<0.05)。

图3 4株植物乳杆菌的疏水性
2.3 模拟胃肠液的试验结果
益生菌在进入肠道之前要先经过胃部,因此耐受胃液能力是益生菌筛选的重要指标[20]。研究表明,在pH1.5的环境中,多数乳酸菌在1 h后死亡;在pH2.5~4.0环境中,大多数乳酸菌在3 h内仍保持较高的存活力[21-22]。因此,本研究采用pH3.0的人工模拟胃液评价菌株的胃液耐受能力。由图4可知,除菌株XC2外,菌株32E、B14、C24具有很强的耐受胃液能力,3 h内存活率均达到80%以上。
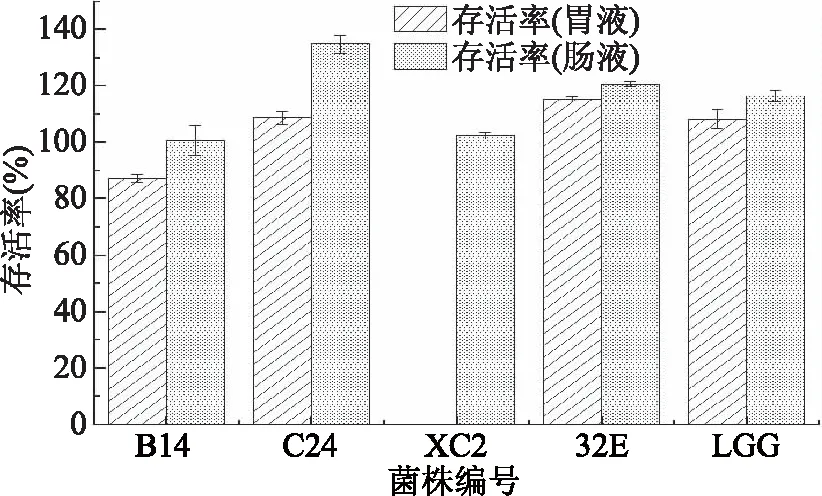
图4 4株植物乳杆菌的人工胃肠液存活率
乳酸菌经过胃部后,最后要在肠道定植后才能发挥其益生特性[23]。在人工模拟肠液试验中,4株菌均具有很强的耐受肠液能力,3 h内对照菌株LGG存活率达到116%,实验菌株均达到100%以上的存活率。徐致远[24]对植物乳杆菌ST-Ⅲ在模拟胃肠液的存活率进行研究,3 h存活率达到100%以上,可能因为人工胃肠液在此pH条件下对菌株生长影响不大,实验菌株是处于对数生长期的旺盛菌株。本试验所用的4株菌株均具有较强的胃肠液耐受能力,可以顺利通过胃液进入肠道发挥其益生作用。
2.4 菌株的药敏试验结果
采用K-B法测定4株菌株对20种不同的抗生素的敏感度,各试验菌株对不同抗生素的敏感性存在差异,结果如表1所示,一般对卡苄西林、四环素、红霉素、青霉素、头孢类等大多数抗生素敏感,但对庆大霉素、卡那霉素和新霉素的敏感性较弱。细菌耐药性一般分为固有耐药性和获得性耐药性,因此细菌对某些药物具有耐药性也是不可避免的[25]。

表1 4株植物乳杆菌对不同抗生素的敏感度
2.5 菌株的溶血性及生物胺试验结果
4株菌株对血平板未产生任何溶血现象,生物胺对照试验表明,4株菌均不产生物胺,试验结果如表2所示。

表2 4株植物乳杆菌的溶血性和产生物胺试验结果
通过自聚集、共聚集、疏水性和模拟胃肠液等一系列试验的筛选,在4株植物乳杆菌中,B14表现出良好的益生特性,与其它菌株相比具有显著性差异,因此选用菌株B14进行黏附试验和发酵特性的研究。
2.6 菌株B14的黏附试验结果
益生菌与肠道表面的黏附和人胃肠道的定殖是益生菌作用的重要前提[26]。Caco-2细胞是一种人克隆结肠腺癌细胞,结构和功能类似于分化的小肠上皮细胞,可以较好的模拟人体肠道中的环境[27]。占萌[28]研究发现,影响细胞黏附的因素有很多,包括菌株浓度、生长阶段、表层蛋白等。本试验中,植物乳杆菌B14的黏附率为30.756%,高于对照菌株LGG,这一结果可能与菌株浓度、菌株生长阶段、表层蛋白等多种因素有关,可以看出B14具有定植肠道的潜在能力。

图5 植物乳杆菌B14对Caco-2细胞的黏附能力
2.7 菌株B14的发酵特性结果
2.7.1 发酵乳黏度随时间变化曲线 菌株B14、发酵剂和混合发酵在24 h内黏度值的变化如图6所示,植物乳杆菌B14在脱脂乳发酵12 h时黏度才大幅增长,12 h之前产黏能力较差,而菌株B14和发酵剂共同发酵时,产黏能力比单独发酵剂发酵时的效果好,发酵24 h时,混合发酵黏度达到4556.333 mPa·s,由此可得出,菌株B14可辅助商业发酵剂提高脱脂乳发酵过程中的黏度。

图6 不同发酵乳在24 h内黏度的变化情况
2.7.2 发酵乳pH随时间变化曲线 菌株B14、发酵剂和混合发酵在24 h内pH的变化如图7所示,脱脂乳经植物乳杆菌B14发酵24 h后测得发酵pH为4.124,表明植物乳杆菌B14产酸能力较弱,不适合单独作为发酵剂制作发酵乳,但是B14和发酵剂的混合发酵pH比单独发酵剂的pH下降的快,9 h时混合发酵的pH达到3.619±0.009,所以B14可以考虑作为辅助发酵剂与商业发酵剂进行复配使用提高发酵乳的益生功能。

图7 不同发酵乳在24 h内pH的变化情况
2.7.3 发酵乳滴定酸随时间变化曲线 菌株B14、发酵剂和混合发酵在24 h内滴定酸的变化如图8所示,三种发酵液的酸度随着发酵时间的延长而逐渐升高,当发酵24 h时,植物乳杆菌B14的酸度达到80.682±5.255 °T,发酵剂的酸度值为110.704±4.164 °T,而B14和商业发酵剂混合发酵的酸度达到了114.858±2.665 °T,效果最佳。因此,可以考虑植物乳杆菌B14作为辅助发酵剂和商业发酵剂共同发酵脱脂乳。

图8 不同发酵乳在24 h内滴定酸的变化情况
3 结论
本研究从实验室4株植物乳杆菌中筛选出益生特性较好的菌株B14,该菌对二甲苯和十六烷的疏水性均达到80%以上,自聚集能力超过85%,共聚集能力超过75%,细胞黏附率达到30.756%,与其它菌株相比具有更好的益生特性。在进一步的发酵特性的研究中,植物乳杆菌B14作为辅助发酵剂添加到发酵乳中,在发酵24 h内,黏度、滴定酸均得到了相应的提高。研究结果为植物乳杆菌B14作为益生性发酵菌株的开发应用提供理论参考。

