短波紫外线处理对鲜切莲藕酶促褐变的影响
解新方,王晓萍,王志东,张 洁,*,郝 青
(1.农业农村部农产品质量安全收贮运管控重点实验室,中国农业科学院农产品加工研究所,北京 100193;2.青岛农业大学园林与林学院,山东青岛 266109)
莲藕(Nelumbonucifera,lotus)属睡莲科(Nymphaeaceae)莲属(Nelumbo)多年生水生草本植物[1],其营养丰富,组织脆嫩[2],具有清热生津等药用价值[3],是我国特色的水生蔬菜和出口创汇蔬菜。近年来,鲜切果蔬以其营养、新鲜、快速、便捷等特点受到消费者关注[4],鲜切莲藕也逐渐成为鲜切果蔬商品化中重要组成部分。然而,鲜切莲藕在鲜切加工引起机械损伤时极易发生酶促褐变,严重影响其外观质量和内在品质[5-6]。果蔬的酶促褐变是一个复杂的生理反应,目前较为认可的理论是酚-酶区域化分布学说[6-9]。酚类底物、多酚氧化酶(PPO)和氧气浓度是决定是否发生酶促褐变反应的三个重要条件[10-12],不同果蔬中PPO作用的底物不同[13-17]。
目前,鲜切莲藕的保鲜方式主要是利用植物提取物[18]等非亚硫酸盐类的新型保鲜剂进行生物保鲜或利用气调包装[19]和真空包装[20]进行物理保鲜。短波紫外线(Ultraviolet-C,UV-C)作为一种物理保鲜方式以其操作简便、绿色安全,正逐渐成为一种重要的保鲜方式。它可以有效地抑制病原菌的侵染,防止细胞质膜被破坏,减少果蔬采后的褐变,并且在多种鲜切即食果蔬以及果蔬加工制品中得到证实[21-25]。而关于UV-C抑制鲜切莲藕酶促褐变效果鲜有研究。
本文主要研究不同剂量UV-C照射(1.0、3.0和5.0 kJ/m2)对4 ℃下鲜切莲藕褐变的影响。以褐变度、失水率、硬度、褐变相关底物含量与酶活等作为评价指标,以期获得抑制鲜切莲藕褐变贮藏保存的最佳UV-C照射剂量,为UV-C在鲜切莲藕贮藏保鲜应用提供一定的依据。
1 材料与方法
1.1 材料与仪器
‘粉红藕’(挑选大小一致,颜色均一,无机械损伤作为试材) 天津市宝坻区;儿茶酚标准品(纯度99.3%) 德国Dr.Ehrenstorfer GmbH公司;没食子酸标准品(纯度99.8%) 德国Dr.Ehrenstorfer GmbH公司;多酚氧化酶(PPO)活性检测试剂盒 北京索莱宝科技有限公司;总超氧化物歧化酶(T-SOD)测试盒 南京建成生物工程研究所。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;BSA224S-CW分析天平(0.0001 g) 赛多利斯科学仪器(北京)有限公司;Digieye Digital Imaging System型电子眼 英国verivide company;DGP-3600SDN高效液相色谱仪(配有DAD-3000检测器) Thermo Scientific;TA.HD plus TA 型质构仪 英国Stable Micro System;短波紫外线装置 天津商业大学自制;Sigma 3K高速台式冷冻离心机 北京五洲东方有限公司。
1.2 实验方法
1.2.1 材料处理 莲藕经自来水清洗、晾干后,分节,去除两端,留粗细均匀的中段莲藕。将莲藕用削皮刀去皮,用陶瓷刀将其切割成0.5 cm厚度的薄片。照射剂量分别为1.0、3.0、5.0 kJ/m2的UV-C对鲜切莲藕进行正反面照射。对照组为未经UV-C处理组。照射后立即将各组鲜切莲藕装入聚丙烯保鲜盒内,用聚乙烯保鲜膜包好,置于4 ℃冷库中贮藏12 d,每隔2 d随机取样测定各指标。除另有说明外,每个处理组由6片莲藕组成,每组重复3次测定生理品质,取其平均值作为最终测定结果。
1.2.2 测定指标及方法
1.2.2.1 褐变度 采用电子眼进行测定,每个处理重复测定9次,根据下列公式[18]计算其褐变度。
褐变指数=100(x-0.31)/0.172
式中:x=(a*+1.75L*)/(5.645L*+a*-3.012b*)。
1.2.2.2 失水率 采用称量法。分别在贮藏的第0、3、6、9、12 d测定对照组和3个处理组中的鲜切莲藕的重量并记录,每组设6个平行。并按以下公式计算失水率。
失水率(%)=(贮藏前质量-贮藏后质量)/贮藏前质量×100
1.2.2.3 硬度 利用物性检测仪进行测定:使用HDP/BSK型号刀具,测试模式是compression,测试速度为1 mm/s,测试距离为25 mm,触发力为5.0 g,每个处理重复测定6次。
1.2.2.4 没食子酸、儿茶酚含量 参照郁志芳等[17]和孙雯等[26]的方法略作修改。精确称取5.0 g新鲜莲藕组织加入5 mL甲醇,于沸水浴上煮沸5 min,充分研磨后,用甲醇定容至10 mL,再离心10 min(9500 r/min)取上清液,上清液置于-80 ℃冰箱保存待测。
色谱柱:Syncronis C18液相色谱柱(4.6 mm×250 mm,5 μm)。流动相为10%(v/v)醋酸水溶液(A)、甲醇(B),按表1的梯度条件进行检测,流速为0.8 mL/min,进样体积20 μL,检测波长278 nm。
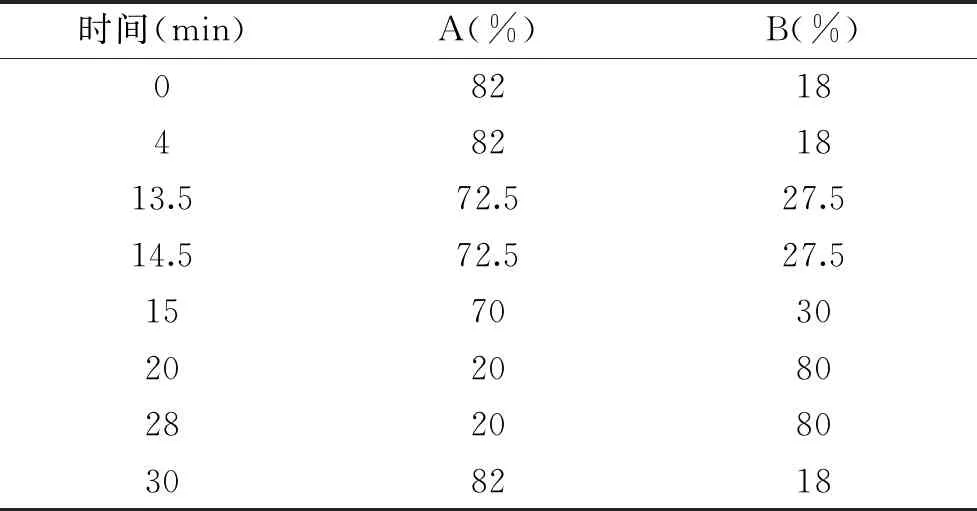
表1 流动相梯度洗脱条件
1.2.2.5 多酚氧化酶(PPO)活性 采用PPO活性检测试剂盒进行测定。取0.1 g样品,冰浴条件下加入1 mL提取液匀浆,4 ℃下9000 r/min离心10 min,取上清置于冰上待测。离心管中按照说明书依次加入试剂和样本,25 ℃水浴10 min后,迅速放入沸水中加热10 min。充分混匀后,放1000 r/min离心10 min,收集上清液,紫外分光光度计410 nm检测测定管和空白管的OD值,每个处理设3个重复。该试验条件下,每分钟每克组织在每毫升反应体系中使410 nm处吸光值变化0.005定义为一个酶活力单位。
PPO活性(U/g FW)=120ΔA/W(W:样品质量)
ΔA=A测定-A对照
1.2.2.6 超氧化物歧化酶(SOD)活性 采用T-SOD测试盒进行测定。取1.0 g样品溶于4 mL pH7.4磷酸缓冲液(0.1 mol/L)中制成20%的组织匀浆,4000 r/min离心10 min,取上清液。离心管中按照说明书依次加入试剂和样本,旋涡混匀器混匀,37 ℃恒温水浴40 min,最后加入显色剂,混匀,室温放置10 min,550 nm处测定OD值。该试验条件下,每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U),计算公式(参照试剂盒说明书)如下。
总SOD活力(U/g组织湿重)=(对照OD值-测定OD值)/对照OD值÷50%×反应液总体积(mL)/取样量(mL)÷匀浆液浓度(g/mL)
1.3 数据处理与分析
应用Excel 2010软件对数据进行统计分析,用统计分析软件SPSS 22对数据进行显著性分析,利用Origin 2017软件作图。实验结果为6次平行试验的平均值。
2 结果与分析
2.1 UV-C处理对鲜切莲藕贮藏过程中褐变度的影响
鲜切莲藕在贮藏过程中褐变指数越大即褐变越严重。如图1所示,各组鲜切莲藕在贮藏过程中褐变指数均呈现上升趋势。对照组的褐变指数从第3 d开始迅速增大,而UV-C处理组的褐变指数上升缓慢且显著低于对照组(P<0.05)。在不同剂量的UV-C处理组中,6 d前各处理组褐变指数变化无显著差异,而从第6 d开始,5.0 kJ/m2的处理组褐变指数变化趋于平稳,直到贮藏末期(第12 d),其褐变指数约为30,显著低于其他组别(P<0.05),此时对照组褐变指数达到56.7。结果表明,UV-C处理可以抑制鲜切莲藕的褐变,在贮藏期12 d内,5.0 kJ/m2的处理组抑制褐变效果最佳。

图1 UV-C处理对鲜切莲藕褐变度的影响
2.2 UV-C处理对鲜切莲藕贮藏过程中失水率的影响
莲藕中的水分含量较高,失水率是判断鲜切莲藕新鲜度的重要指标,水分充足的鲜切莲藕外观佳、品质高。由图2可知,对照组和不同剂量的UV-C处理组鲜切莲藕在贮藏过程中失水率均呈现上升趋势。鲜切莲藕整个贮藏过程中,对照组与UV-C照射的处理组以及同处理组之间失水率无显著差异,说明UV-C对鲜切莲藕的失水率影响不大。Penelope等[27]对蓝莓进行了UV-C处理,也未影响蓝莓果实质量损失率,与本研究结果一致。

图2 UV-C处理对鲜切莲藕贮藏过程中失水率的影响
2.3 UV-C处理对鲜切莲藕贮藏过程中硬度的影响
如图3所示,随着贮藏时间的增加,对照组和处理组鲜切莲藕的硬度均呈现逐渐下降趋势。在贮藏第12 d,UV-C处理组的硬度显著高于对照组(P<0.05),这可能是由于UV-C通过钝化纤维酶的活性抑制莲藕硬度下降。但不同剂量的处理组之间无显著差异,说明UV-C处理可以延缓鲜切莲藕硬度的下降,前人在研究UV-C对果蔬品质影响中也有相同结论[28-29]。
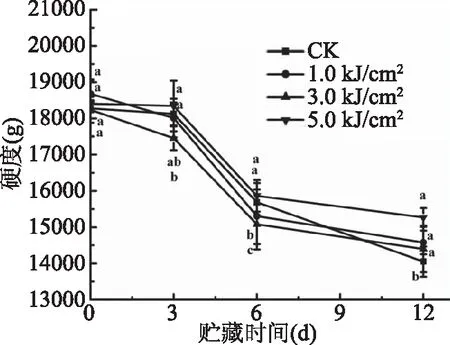
图3 UV-C处理对鲜切莲藕贮藏过程中硬度的影响
2.4 UV-C处理对鲜切莲藕贮藏过程中儿茶酚和没食子酸含量的影响
儿茶酚的含量影响鲜切莲藕的酶促褐变。郁志芳等[17]通过儿茶酚和PPO作用后产物的紫外吸收光谱与鲜切莲藕自然褐变产物对比,初步确定儿茶酚是鲜切莲藕酶促褐变的主要作用底物。如图4所示,贮藏期间对照组和1.0 kJ/m2的处理组儿茶酚的含量均呈现先下降后上升的趋势,3.0和5.0 kJ/m2的处理组儿茶酚浓度均呈现先上升后下降再上升的趋势。在贮藏的第0~3 d中,3.0和5.0 kJ/m2的处理组儿茶酚浓度明显上升,且显著高于对照组和1.0 kJ/m2的处理组(P<0.05),而3.0和5.0 kJ/m2UV-C处理组褐变指数显著低于对照组,推测较高剂量的UV-C照射可以通过抑制儿茶酚与PPO结合从而延缓鲜切莲藕的褐变。

图4 UV-C处理对鲜切莲藕贮藏过程中儿茶酚含量的影响
没食子酸是莲藕褐变过程中PPO酶作用的重要底物。如图5所示,对照组和处理组在贮藏期间,没食子酸的浓度均呈现先上升后下降的趋势,且在第6 d达到峰值,这与图1中对照组和UV-C照射处理组均在第6 d后褐变指数明显上升趋势相吻合。没食子酸的含量在第6 d出现峰值后开始下降,与褐变度在第6 d出现较快增长的变化趋势相吻合,表明没食子酸可能是鲜切莲藕酶促褐变的最适底物,与王清章等[16]研究结果一致。

图5 UV-C处理对鲜切莲藕贮藏过程中没食子酸含量的影响
2.5 UV-C处理对鲜切莲藕贮藏过程中PPO活性的影响
PPO是促进莲藕酶促褐变的关键酶。如图6所示,对照组和1.0 kJ/m2处理组的PPO活性呈现先下降后上升再下降的趋势,3.0和5.0 kJ/m2处理组的PPO酶活呈现先下降后上升的趋势。在本研究中,对照组PPO酶活在贮藏期第3 d上升,UV-C照射处理组PPO酶活的上升趋势出现时间较晚,在第6 d出现上升。在贮藏期第6 d,对照组PPO酶活显著上升且高于处理组(P<0.05),说明UV-C处理可以短期内抑制PPO酶活,从而延缓鲜切莲藕的酶促褐变。并且,贮藏期6 d内,UV-C剂量对PPO的调节作用没有显著差异,与陈奕兆等[29]研究结果一致。6 d到11 d内,3.0 kJ/m2处理效果显著优于5.0 kJ/m2,5.0 kJ/m2的处理效果显著优于1.0 kJ/m2,表明适当剂量UV-C照射体现出对酶活性有效调节作用。研究报道,UV-C对PPO的抑制效果可能与该处理调节酶生产相关遗传物质有关[30]。
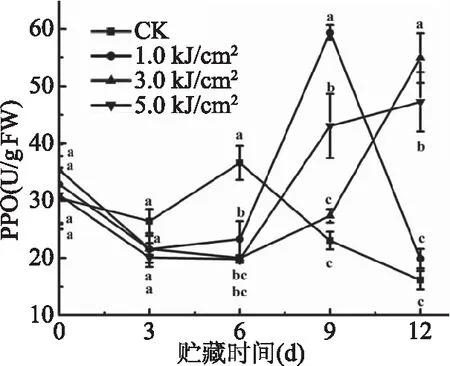
图6 UV-C处理对鲜切莲藕贮藏过程中PPO活性的影响
2.6 UV-C处理对鲜切莲藕贮藏过程中SOD活性的影响
SOD作为一类防御活性氧或其他过氧化物自由基对生物膜造成伤害的酶,广泛存在于植物体内,它可清除植物在代谢过程中产生的活性氧,降低酶促褐变所需的活性氧含量并抑制酶促褐变。如图7所示,对照组和处理组SOD活性均呈现先上升后下降的趋势,并在贮藏的第3 d出现酶活的峰值。且不同照射剂量的处理组间在贮藏期为3 d时出现差异,1.0 kJ/m2的处理组在贮藏3 d时SOD活性显著高于3.0和5.0 kJ/m2的处理组(P<0.05)。但3~12 d各处理组与对照组的SOD活力无显著差异(P>0.05)。结果表明,在鲜切莲藕贮藏过程中,低剂量的UV-C照射处理可在贮藏前期通过提高鲜切莲藕SOD的活性从而抑制莲藕的褐变,而在长期贮藏过程中,UV-C对SOD的促进作用不明显,这可能是由于低剂量的辐照激活了SOD酶相关的合成[31]。田竹希等[32]研究发现在大樱桃前期贮藏过程中,1.37 kJ/m2的UV-C可显著提高SOD的活力从而提高大樱桃的贮藏品质,而在贮藏后期作用不明显,与本研究结果基本一致。

图7 UV-C处理对鲜切莲藕贮藏过程中SOD活性的影响
3 结论
鲜切莲藕的酶促褐变问题是莲藕初加工环节亟待解决的问题。在4 ℃贮藏,利用UV-C处理可以在一定时间内显著抑制鲜切莲藕褐变发生(P<0.05)。较高剂量UV-C照射,可以通过抑制褐变底物儿茶酚、没食子酸与PPO反应,从而延缓鲜切莲藕酶促褐变。同时UV-C处理可显著延缓贮藏期鲜切莲藕硬度的下降(P<0.05),但不同剂量的处理组间无显著差异(P>0.05)。此外,UV-C处理对鲜切莲藕在贮藏过程中失重率影响不大。综合贮藏品质,在12 d的贮藏期内,5.0 kJ/m2的UV-C处理组抑制鲜切莲藕褐变的效果最佳。本研究为UV-C处理技术在鲜切莲藕贮藏保鲜领域的应用提供理论依据。

