藤茶总黄酮固体脂质纳米粒抗肝癌活性及其药动学研究
杨毛毛,罗花彩,徐 伟,林珠灿*,郭素华,沙 玫*
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学附属人民医院,福建 福州 350004)
肝癌为常见的恶性肿瘤之一,近年来其发病率呈上升趋势,严重威胁人类健康[1-2],但目前市场上的广谱抗肝癌药物往往会对人体免疫力、器官等造成不同程度的损害。前期报道,藤茶所含的黄酮在抗肿瘤方面效果明显,并有潜力开发为抗肝癌辅助药物[3-6],但其主要成分二氢杨梅素(占总黄酮含有量的82%以上[7])的结构中含3,5,7,3′,4′,5′-六酚羟基,易被氧化,而且体内消除快,口服吸收差,生物利用度低[8-9],严重影响体内药效和临床应用,故需通过新型给药系统来改善其稳定性和生物利用度。
固体脂质纳米粒是一种具有比表面积大、无生物毒性、可控释、靶向性良好、能降低不良反应等诸多优势的载药体系[10-11],课题组前期已对藤茶总黄酮固体脂质纳米粒制备工艺进行优化[12]。本实验在此基础上进一步考察该制剂的抗肝癌活性,并对主要成分二氢杨梅素的药动学进行研究,以期为藤茶总黄酮及其新制剂的后续开发及临床应用提供依据。
1 材料
电子天平[梅特勒-托利多仪器(上海)有限公司];Infinite200 PRO 多功能酶标仪(瑞士Tecan公司);TS100 倒置显微镜(日本尼康公司);Galaxy 170R 型CO2培养箱(瑞轩电子科技上海有限公司);LCMS-8045 岛津液质联用仪(日本岛津公司)。
藤茶总黄酮提取物及固体脂质纳米粒均为课题组自制(二氢杨梅素质量浓度为40.15 mg/mL)。环磷酰胺(批号113842,商品名安道生);顺铂(批号B1210L79601,铂质量分数65%);二氢杨梅素对照品(批号160422,纯度≥98.0%,上海源叶生物科技有限公司);二氢槲皮素对照品(批号BA09B006,纯度>98.0%,成都普思生物科技股份有限公司);
鼠源性肝癌细胞(H22)、人肝癌细胞(HepG2)细胞株均由福建中医药大学药学院陈莉课题组惠赠。清洁级ICR 雄性小鼠,体质量18~22 g;SD 雄性大鼠,体质量(220±20)g,均购自上海斯莱克实验动物有限责任公司,动物生产许可证号分别为SCXK(沪)2017-0005、SCXK(沪)2017-0002。
2 方法
2.1 HepG2 细胞增殖抑制率测定 采用MTT法[6,13]。将对数生长期的HepG2 细胞用0.25% 胰蛋白酶消化,完全培养液(DMEM 高糖+10%胎牛血清+1%双抗)配成单细胞悬液(5×104/mL)后接种于96 孔培养板(100 μL/孔)上,置于CO2培养箱中,在37 ℃、5% CO2条件下进行培养。待各孔中细胞完全贴壁后给药,设置对照组、阳性药(顺铂)组(0.5、1.0、2.5、5.0、25.0、50.0 μg/mL)、藤茶总黄酮组、藤茶总黄酮固体脂质纳米粒组、空白纳米粒组(5、10、25、50、100、200 μg/mL),每个质量浓度设5 个复孔(150 μL/孔),继续在37 ℃、5% CO2条件下培养24、48、72 h 后,每孔加入5 mg/mL MTT 溶液10 μL,置于CO2培养箱中培养4 h 后终止,DMSO(100 μL/孔)溶解紫色结晶。酶标仪检测每孔在490 nm 波长处的光密度(OD490),重复3 次,取平均值,计算增殖抑制率,公式为抑制率=(1-给药组OD490/对照组OD490)×100%。
2.2 体内抗肝癌活性研究
2.2.1 模型建立 参考文献[14]报道。H22细胞复苏后在小鼠腹腔中培养,传2~3 代后在无菌条件下抽取腹水,生理盐水洗涤后离心,重复3 次,PBS 缓冲液稀释,0.2% 台盼蓝染色后当活细胞数大于95% 时,调整细胞浓度为5×106/mL,吸取浓度均匀的细胞悬液,以0.2 mL/只剂量皮下注射于小鼠右腋下。
2.2.2 分组与给药 称取藤茶总黄酮适量,加适量蒸馏水加热溶解,分别制成低剂量(30 mg/mL)、高剂量(120 mg/mL)混悬液;藤茶总黄酮固体脂质纳米粒冷冻干燥后,加适量蒸馏水均匀分散,分别制成低剂量(30 mg/mL)、高剂量(120 mg/mL)混悬液。
70 只小鼠适应性饲养5 d 后,随机分为空白组,模型组,阳性药组,藤茶总黄酮固体脂质纳米粒高、低剂量组,藤茶总黄酮高、低剂量组,每组10 只,除空白组外各组小鼠均于右腋下接种H22细胞造模。根据预实验结果,阳性药组小鼠腹腔注射3 mg/kg 环磷酰胺(0.2 mL/10 g),空白组、模型组小鼠灌胃给予生理盐水,藤茶总黄酮高、低剂量组,藤茶总黄酮固体脂质纳米粒高、低剂量组均分别按2.4、0.6 g/kg 剂量灌胃给予相应含药混悬液,各组小鼠每天给药1 次,连续10 d。每天称定小鼠体质量,观察其活动、毛发色泽、死亡等情况。最后1 次给药结束,小鼠禁食不禁水24 h 后处死,完整剥离腋窝皮下实体瘤,称定质量,计算抑瘤率,同时剖取胸腺、脾脏后称定质量,计算脏器指数,公式分别为抑瘤率=(1-给药组肿瘤质量/模型组肿瘤质量)×100%、胸腺(或脾脏)指数=胸腺(或脾脏)质量/小鼠体质量。
2.3 药动学研究
2.3.1 LC-MS/MS 条 件参考文献[15-16]报道。
2.3.1.1 色谱 Shim-pack XR-ODS Ⅲ色谱柱(75 mm×2.0 mm,1.6 μm);流动相0.1%甲酸-乙腈(85∶15);体积流量0.3 mL/min;柱温40 ℃;进样量1 μL。
2.3.1.2 质谱 负离子多级反应(MRM)模式;电喷雾离子源(ESI);定量离子对,二氢杨梅素m/z319.15~193.20,二氢槲皮素m/z303.20~125.10;雾化气体积流量3.0 L/min;干燥气、加热气体积流量10.0 L/min;接口电压3.0 kV;接口温度 400 ℃;检测器电压 1.76 kV;CID 气230 kPa。
2.3.2 分组及给药 按“2.2.2”项下方法制备含药混悬液,藤茶总黄酮质量浓度为7.5 mg/mL。大鼠适应性饲养5 d 后,随机分为藤茶总黄酮组、藤茶总黄酮固体脂质纳米粒组,每组6 只,于实验前12 h 禁食,自由饮水,按150 mg/kg 剂量灌胃给药,于0.167、0.33、0.5、0.667、1、2、3、4、6、8、12、24 h 眼眶静脉丛釆血各0.5 mL,置于肝素钠处理的EP 管中,静置30 min,4 ℃下6 000 r/min离心15 min 分离血浆,-20 ℃下冷冻保存。
2.3.3 血浆样品处理 精密吸取“2.3.2”项下血浆100 μL 于离心管中,加入内标(二氢槲皮素)溶液10 μL,涡旋30 s,加入1% 甲酸乙腈(蛋白沉淀剂)190 μL,涡旋5 min,4 ℃下17 000 r/min离心15 min,取上清液,0.22 μm 微孔滤膜过滤,在“2.3.1”项条件下进样测定。
2.3.4 方法学考察
2.3.4.1 对照品、内标溶液制备 精密称取二氢杨梅素对照品、内标(二氢槲皮素)适量,置于100 mL 量瓶中,乙腈溶解定容,即得(两者质量浓度分别为50、30 μg/mL)。
2.3.4.2 专属性考察 取“2.3.4.1”项下对照品、内标溶液,以及按“2.3.3”项下方法处理的空白血浆、含药血浆样品溶液,在“2.3.1”项条件下进样测定,结果见图1。
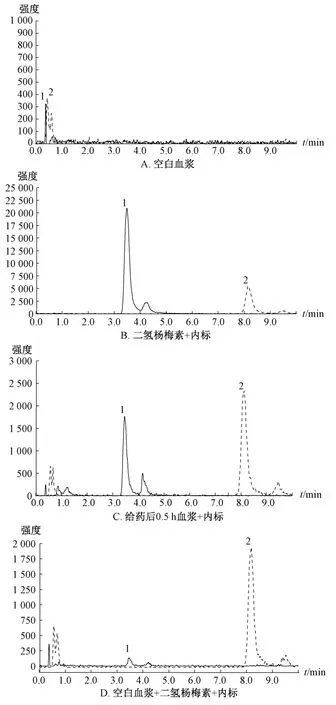
图1 二氢杨梅素MRM 色谱图Fig.1 MRM chromatograms of dihydromyricetin
2.3.4.3 线性关系考察 精密吸取空白血浆90 μL,加入10 μL 对照品溶液,制成含二氢杨梅素1、5、10、20、50、100、200、500 ng/mL 的血浆样品溶液,按 “2.3.3”项下方法处理,在“2.3.1”项条件下进样测定。以溶液质量浓度为横坐标(X),二氢杨梅素、内标峰面积比值为纵坐标(Y)进行回归,得方程为Y=0.004 3X-0.022 6(r=0.999 6),在1~500 ng/mL 范围内线性关系良好,定量限(S/N=10)为1 ng/mL。
2.3.4.4 精密度、准确度试验 制备含5、20、200 ng/mL 二氢杨梅素的血浆样品溶液,各平行3份,按“2.3.3”项下方法处理,在“2.3.1”项条件下进样测定,连续3 d,测得二氢杨梅素日内、日间精密度RSD 分别为0.25%~1.16%、0.67%~1.13%,准确度为95%~106%,均符合2015 年版《中国药典》规定的生物样品分析要求。
2.3.4.5 提取回收率、基质效应试验 制备含5、20、200 ng/mL 二氢杨梅素的血浆样品溶液,各平行3 份,按“2.3.3”项下方法处理,在“2.3.1”项条件下进样测定,记录峰面积A1;按“2.3.3”项下方法处理空白血浆后离心,上清液中加入相应质量浓度的对照品、内标溶液,在“2.3.1”项条件下进样测定,记录峰面积A2;用1%甲酸乙腈制成相同质量浓度的对照品、内标溶液,在“2.3.1”项条件下进样测定,记录峰面积A3,计算提取回收率、基质效应,公式分别为提取回收率=A1/A2×100%、基质效应=A2/A3×100%,测得两者分别为 81.86%~90.99%、86.63%~101.40%,均符合生物样品质量控制要求,表明二氢杨梅素受基质的影响较小。
2.3.4.6 稳定性试验 制备含5、20、200 ng/mL二氢杨梅素的血浆样品溶液,各平行3 份,按“2.3.3”项下方法处理后,分别在-80 ℃下反复冻融3 次、-20 ℃下冷冻保存15 d、室温(25 ℃)下放置12 h,在“2.3.1”项条件下进样测定。结果,二氢杨梅素峰面积RSD 为1.27%~6.49%,表明在上述保存条件下血浆样品稳定性均良好。
2.3.5 数据分析 绘制血药浓度-时间曲线,采用DAS 2.0 软件中的二房室模型计算主要药动学参数。
3 结果
3.1 对HepG2 细胞的抑制作用 图2 显示,藤茶总黄酮及其固体脂质纳米粒作用24、48、72 h 后,均对细胞增殖有较强的抑制作用,并呈浓度依赖性,其中 200 μg/mL 前者作用 72 h,50~200 μg/mL后者作用48、72 h 后的体外抑制率均达到80% 以上。另外,藤茶总黄酮IC50分别为163.63 μg/mL(24 h)、89.58 μg/mL(48 h)、49.44 μg/mL(72 h),而其固体脂质纳米粒分别为68.63 μg/mL(24 h)、39.99 μg/mL(48 h)、32.91 μg/mL(72 h),表明后者活性更显著。
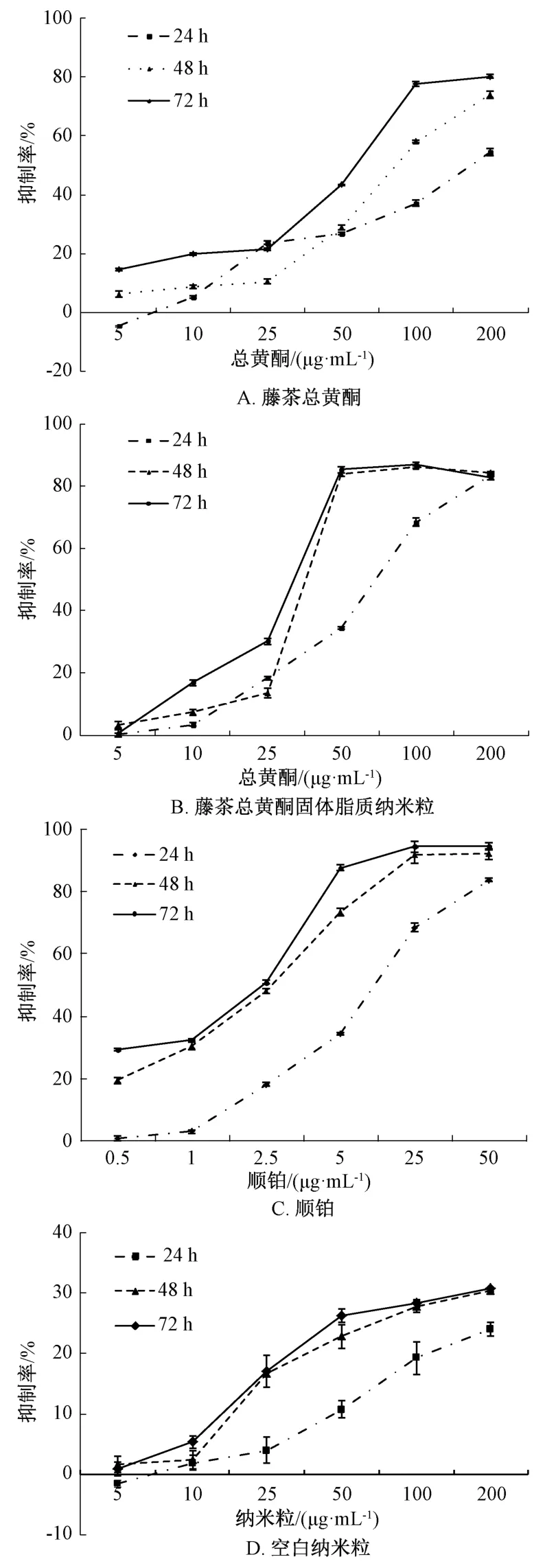
图2 各样品对HepG2 细胞抑制率的影响Fig.2 Effects of various samples on the inhibitory rate of HepG2 cells
3.2 抗肝癌活性研究 表1~3 显示,与模型组比较,除藤茶总黄酮低剂量组外,各组对小鼠肿瘤的抑制作用比较,差异均有统计学意义(P<0.01),而且纳米粒活性强于原料药;与空白组比较,模型组、阳性药组小鼠体质量均降低(P<0.01),而藤茶总黄酮组、藤茶总黄酮固体脂质纳米粒组无明显变化(P>0.05);与空白组比较,阳性药组小鼠胸腺、脾脏指数降低(P<0.05,P<0.01),可能与环磷酰胺具有较强的免疫损失有关,而其他组无明显变化(P>0.05)。
表1 各样品对小鼠肿瘤的影响(,n=10)Tab.1 Effects of various samples on tumors in mice(,n=10)
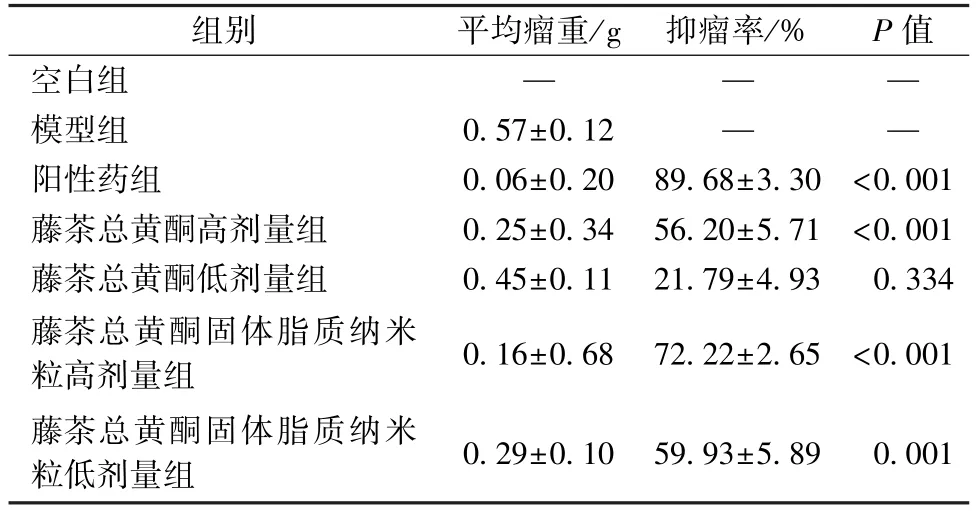
表1 各样品对小鼠肿瘤的影响(,n=10)Tab.1 Effects of various samples on tumors in mice(,n=10)
表2 各样品对小鼠体质量的影响(,n=10)Tab.2 Effects of various samples on the body weight of mice(,n=10)
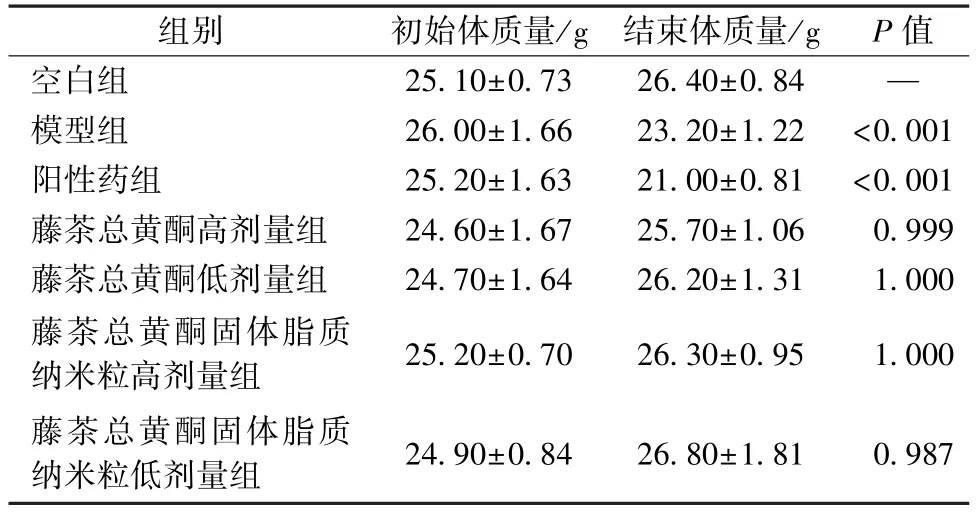
表2 各样品对小鼠体质量的影响(,n=10)Tab.2 Effects of various samples on the body weight of mice(,n=10)
表3 各样品对小鼠免疫器官的影响(,n=10)Tab.3 Effects of various samples on immue organs in mice(,n=10)
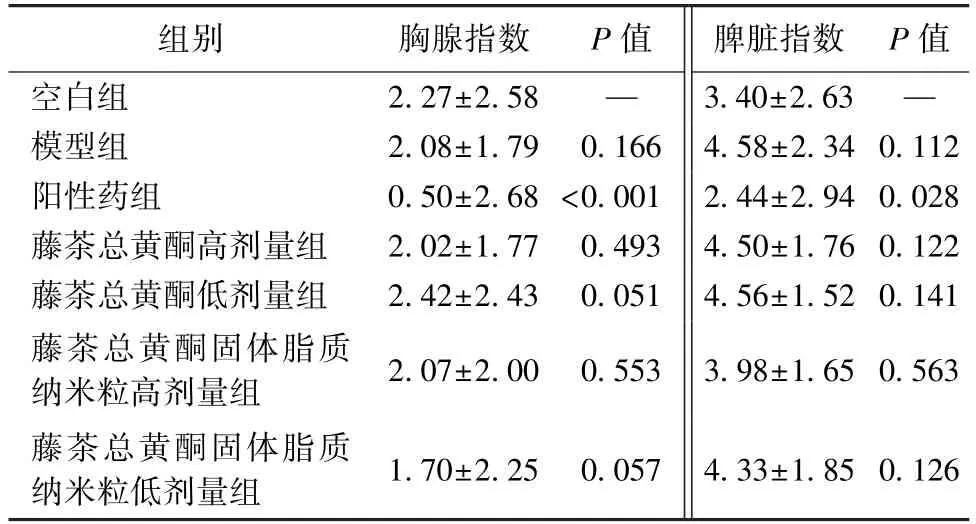
表3 各样品对小鼠免疫器官的影响(,n=10)Tab.3 Effects of various samples on immue organs in mice(,n=10)
3.3 药动学研究 血药浓度-时间曲线见图3,相关数据经DAS 2.0 软件进行拟合后发现,藤茶总黄酮及其固体脂质纳米粒的体内药动学均符合二室模型。表4 显示,藤茶总黄酮固体脂质纳米粒组Cmax、Tmax、t1/2、AUC0~24h、AUC0~∞高于藤茶总黄酮组(P<0.01),分别是后者的1.76、1.94、2.03、2.80、2.49 倍。
4 讨论
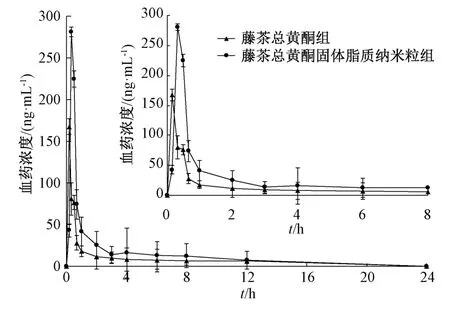
图3 各样品血药浓度-时间曲线Fig.3 Plasma concentration-time curves for various samples
表4 各样品主要药动学参数(,n=6)Tab.4 Main pharmacokinetic parameters for various samples(,n=6)
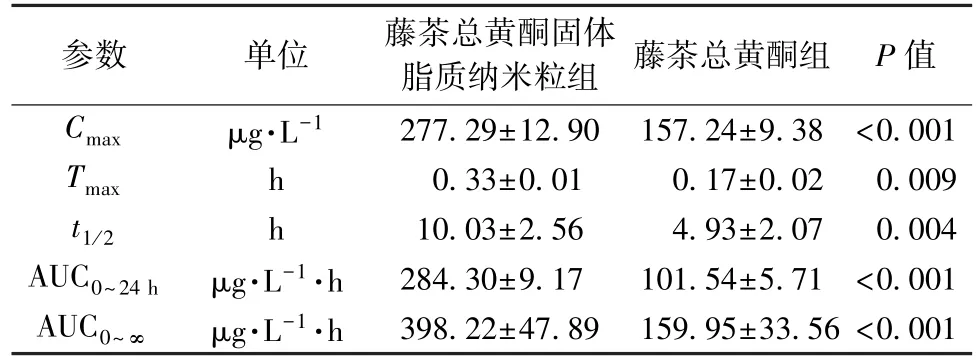
表4 各样品主要药动学参数(,n=6)Tab.4 Main pharmacokinetic parameters for various samples(,n=6)
本实验结果表明,藤茶总黄酮制成固体脂质纳米粒后可明显提高其抗肝癌作用,推测可能与该剂型可改善原料药与肿瘤细胞的亲和力[17]、具有良好的肿瘤靶向递送能力等优势有关。采用LC-MS/MS 法检测总黄酮主要成分二氢杨梅素的血药浓度,发现藤茶总黄酮制成纳米粒后该成分口服生物利用度显著提高,可能是由于纳米粒粒径小,比表面积大,可增加其与胃肠道黏膜的接触面积,从而促进药物有效吸收[18]。另外,该纳米粒能有效减缓二氢杨梅素体内消除,延长其t1/2,可能是药物被嵌入固体脂质基质骨架中而避免外界因素破坏,增加其稳定性,并可使其在体内缓慢释放,延长作用时间。
同时,藤茶总黄酮及其纳米粒口服给药后二氢杨梅素血药浓度很低,但其体内抗肝癌活性较好,产生这种低生物利用度、高药理活性现象的原因可能有(1)研究表明单次或长期大剂量连续口服二氢杨梅素时,其吸收量随剂量及给药时间增加而显著升高[19],本实验给药剂量大(600、2 400 mg/kg),周期长(10 d),使其血药浓度同时具有剂量、时间上的叠加作用,从而发挥持久抑瘤活性[20];(2)与健康大鼠比较,糖尿病模型大鼠中二氢杨梅素Cmax、AUC0~t、AUC0~∞等药动学参数均显著升高[21],而本实验目前只考察了总黄酮及其纳米粒在正常大鼠体内的药动学,而二氢杨梅素在病理状态下的生物利用度可能会明显增加;(3)二氢杨梅素经胃肠道代谢后产生8 种代谢产物,经肠道吸收进入血液循环,或作用于肠道菌群,或直接刺激肠道免疫应答系统,从而发挥相应药效[22];(4)二氢杨梅素口服后其血药浓度降低,可能在组织分布中较高[23],尤其是制成固体脂质纳米粒后,纳米载体可使其具有明显的肝脏靶向性[24]。另外,本实验只测定了血浆中二氢杨梅素含有量,但其在肝、脾、肺中的含有量可能会明显升高,从而增强疗效,具体将在今后作进一步研究。

