快速多黏菌素NP法在肠杆菌科和鲍曼不动杆菌多黏菌素耐药性检测中的应用评价
方人驰 田学斌 陈栎江 赵雅洁 郑相阔 王冲 董郭枫 刘海洋 曹建明 周铁丽
细菌耐药性的产生,尤其是多重耐药(multi-drug resistance,MDR)革兰阴性杆菌的出现和广泛流行,严重影响了抗菌药物对重症感染患者的有效治疗。WHO在2017年发布的《全球抗菌药物耐药细菌优先名单》中,将碳青霉烯类耐药鲍曼不动杆菌、铜绿假单胞菌及肠杆菌科细菌置于第一优先级[1]。有限的药物选择使得“老药”多黏菌素成为了治疗MDR革兰阴性杆菌引起感染的防线药物之一[2]。随着多黏菌素在临床上使用逐渐增多,关于多黏菌素耐药革兰阴性菌的报道也在不断增加[3-5],因此对临床分离菌株的多黏菌素敏感性检测受到医务工作者的高度重视。但由于多黏菌素在琼脂中的扩散能力不佳,使得E-test、纸片扩散法等传统抗菌药敏试验表现出过高的假敏感率(高达32%)[6-7]。美国临床和实验室标准协会(CLSI)推荐的参考方法微量肉汤稀释法,因对操作要求较高而难以在临床实验室中广泛开展。近年Nordmann等[8]研发了一种快速多黏菌素NP法(rapid polymyxin NP test),该方法通过pH指示剂颜色变化检测在多黏菌素存在下的细菌糖代谢,可在4 h内检测出肠杆菌科细菌是否对多黏菌素耐药。但由于该方法的原理是基于检测可视化的葡萄糖代谢,他们未考虑其在非发酵菌如鲍曼不动杆菌或铜绿假单胞菌中的应用,因此本研究在评价快速多黏菌素NP法检测肠杆菌科多黏菌素耐药性的基础上,进一步探索改良该方法使其适用于多黏菌素耐药鲍曼不动杆菌的检测。
1 材料和方法
1.1 菌株来源 收集2010年11月至2019年6月温州医科大学附属第一医院临床分离的多黏菌素E耐药株共42株,其中肠杆菌科细菌34株(包含大肠埃希菌14株、肺炎克雷伯菌20株)、鲍曼不动杆菌8株;随机选取同期多黏菌素E敏感株120株,其中肠杆菌科细菌100株(大肠埃希菌与肺炎克雷伯菌各50株)、鲍曼不动杆菌20株。排除分离自同一患者同一部位的重复菌株,所有菌株均经基质辅助激光解析/电离飞行时间质谱(MALDI-TOF-MS)鉴定系统鉴定,采用微量肉汤稀释法测定多黏菌素E的最低抑菌浓度(minimum inhibitory concentration,MIC)值。临床分离菌株接种于含30%甘油(规格500 ml/瓶,批号:190105,西陇科学股份有限公司)的Luria Bertani(LB)肉汤保菌管中,并置于-80℃冰箱(超低温保存箱DW-86L828,青岛海尔股份有限公司)中保存备用。质控菌株大肠埃希菌ATCC 25922与铜绿假单胞菌ATCC 27853购自卫生部临床检验中心。
1.2 仪器和试剂 MALDI-TOF-MS(VITEK MS)购自法国生物梅里埃公司;微量移液器购自德国Eppendorf公司;Mueller-Hinton(MH)肉汤(规格 500 g/瓶,批号1737584)购自英国 OXOID 公司;D-(+)-葡萄糖(规格500 g,批号:E914BA0014)购自上海生工有限公司;酚红(规格 5 g/瓶,批号:MKCC3312)购自美国 Sigma-alorich公司;多黏菌素 E(规格 200 mg/管,A-20180326-1833)购自温州康泰生物技术有限公司。
1.3 药物敏感性试验 多黏菌素E对共162株试验菌株的MIC值测定采用微量肉汤稀释法,具体操作参照CLSI指南[9]执行,取临床分离菌株与质控菌株接种于哥伦比亚血平板,37℃培养18~24 h,挑取平板表面单菌落在0.85%氯化钠溶液中调至0.5麦氏浊度,使用阳离子校正的MH肉汤(CAMHB)菌悬液稀释100倍待用。在96孔板相应孔中加入100 μl CAMHB,配制多黏菌素 E 母液,选择合适的浓度梯度(0.06~64 μg/ml)在 96孔板中进行倍比稀释,随后在相应孔中加入100 μl菌悬液,同时进行阴性对照,37℃培养16~18 h后读取MIC值。根据 CLSI指南推荐的标准[10],当 MIC≤2 μg/ml时即为敏感,MIC≥4 μg/ml时即为耐药。大肠埃希菌与肺炎克雷伯菌药敏试验所使用的质控菌株为ATCC 25922,鲍曼不动杆菌药敏试验所使用的质控菌株为ATCC 27853,实验独立重复操作3次,取至少两次实验中数值相同的MIC值作为结果,以保证结果准确。
1.4 快速多黏菌素NP法 基于Nordmann等[8]提供的规程,首先配制快速多黏菌素NP法试剂,以配制250 ml为例,称取6.25 g阳离子校正的MH粉末、0.012 5 g酚红,溶于225 ml蒸馏水,然后使用1 mol/L HCL将溶液pH调至6.7,并在121℃下高压灭菌15 min。待冷却至室温后,加入25 ml过滤灭菌的10%D-(+)-葡萄糖,使溶液中葡萄糖浓度为1%,该试剂可在4℃下储存1周或在-20℃下储存1年。在实验操作之前,应将快速多黏菌素NP试剂在37℃中预热,配制0.2 mg/ml多黏菌素E母液,取适量试剂加入多黏菌素E母液使之达到5 μg/ml的浓度(每1 ml试剂中加入25 μl多黏菌素E母液)。试验在96孔板中进行,使用微量加样枪将不含多黏菌素E的快速多黏菌素试剂与含5 μg/ml多黏菌素E的快速多黏菌素试剂转入两排平行孔中,每孔加入150 μl。将临床分离菌株接种于哥伦比亚血平板上,37℃培养18~24 h,挑取平板表面单菌落在0.85%氯化钠溶液中调至 3.0~3.5 麦氏浊度(约 1×109CFU/ml),将菌悬液加入到含有及不含多黏菌素E的平行孔中,每孔加入50 μl,取等量无菌0.85%氯化钠溶液加入一组孔中作为空白对照。最终每孔中菌悬液浓度达到2.5×108CFU/ml左右,多黏菌素E浓度为3.75 μg/ml。本试验阴性质控选择大肠埃希菌ATCC 25922,阳性质控选择临床分离的摩根摩根菌(对多黏菌素天然耐药)。
为探索快速多黏菌素NP法在鲍曼不动杆菌中的应用,在配制含1%D-(+)-葡萄糖的快速多黏菌素NP试剂基础上,另行配制含2%、4%D-(+)-葡萄糖的快速多黏菌素NP试剂,进行平行试验。
1.5 快速多黏菌素NP法结果判读 将加样完成后的96孔板置于37℃,无震荡,培养4 h(在检测鲍曼不动杆菌多黏菌素E耐药性时延长培养时间至24 h)。根据Nordmann等[8]所描述的判定方法,在培养时间内,每小时观察并记录一次结果,当pH指示剂(酚红)由初始的橙色完全变为黄色时,可证实肠杆菌科细菌在孔中发生了葡萄糖代谢并产生弱酸,从而导致pH的下降引起酚红的变色。在观察过程内,临床分离菌株所在的含多黏菌素E与不含多黏菌素E的孔中均发生由橙色到黄色的变色反应,则判定为多黏菌素E耐药(阳性结果),若仅在不含多黏菌素E的孔中发生变色,含多黏菌素E的孔未变色或不完全变色,则判定为多黏菌素E敏感(阴性结果)(图1,插页)。为排除其他因素导致试剂pH改变而引发结果误读,在培育10 min后观察96孔板中所有孔的颜色是否变化,保持橙色为正常。当空白对照孔保持橙色且阳性对照与阴性对照显示正确结果时,认为本次试验结果在控。所有快速多黏菌素NP法结果均由两名技术人员独立判断,仅在判断一致情况下,可认为读取结果可靠。

图1 快速多黏菌素NP法结果示例[第1列孔为空白对照结果(使用质量分数为0.85%的氯化钠替代菌悬液);第2列孔为多黏菌素E耐药株结果;第3列孔为多黏菌素E敏感株的结果。每株分离株的细菌悬液加入到无多黏菌素E(上排)以及含多黏菌素E(下排)的两个平行孔中]
1.6 统计学处理 为评估快速多黏菌素NP法的性能,以微量肉汤稀释法结果为参考,计算快速多黏菌素NP法的灵敏度、特异度和准确率。其中准确率定义为两种诊断方法结果一致的测试数与被测总数的比率。
2 结果
2.1 临床分离菌株的多黏菌素E药敏试验结果 结果发现14株多黏菌素E耐药大肠埃希菌的MIC值在4~16 μg/ml,20株多黏菌素E耐药肺炎克雷伯菌的MIC值≥8 μg/ml,8株多黏菌素E耐药鲍曼不动杆菌的MIC值在4~16 μg/ml,120株多黏菌素E敏感临床分离菌株的 MIC 值≤2 μg/ml。
2.2 肠杆菌科细菌的快速多黏菌素NP法结果 根据每小时记录的结果显示,所有多黏菌素E耐药的大肠埃希菌与肺炎克雷伯菌均显示快速多黏菌素NP法阳性,绝大多数多黏菌素E敏感菌株显示快速多黏菌素NP法阴性,仅1株多黏菌素E敏感大肠埃希菌显示阳性结果,该菌株MIC值为2 μg/ml(表1)。以微量肉汤稀释法结果为标准,快速多黏菌素NP法检测肠杆菌科多黏菌素E耐药性的灵敏度、特异度和准确率分别为100%(34/34)、99%(99/100)和 99.3%(133/134)。所有菌株的变色反应均在2 h内完成,且实验过程中未发现变色不完全现象。
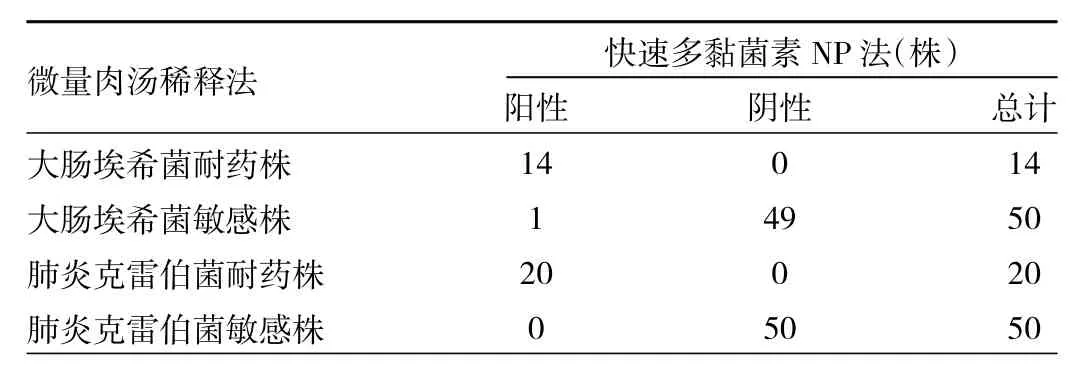
表1 大肠埃希菌与肺炎克雷伯菌快速多黏菌素NP法结果与微量肉汤稀释法结果比较
2.3 鲍曼不动杆菌的快速多黏菌素NP法结果 根据每小时记录的结果显示,在含1%、2%、4%葡萄糖的平行组中,加入鲍曼不动杆菌的孔在4 h内均未发生变色或发生不完全变色,但延长培养时间后,逐渐出现由橙色转为黄色的完全变色反应。当快速多黏菌素NP法结果与MIC值相对应认为是正确检测结果,出现其他情况如不完全变色、非正常变色反应等认为结果不正确,计算每小时快速多黏菌素NP法检测鲍曼不动杆菌多黏菌素E耐药性的准确率,结果显示:不同葡萄糖浓度的3组平行试验的准确率均随时间不断提高,直至15 h左右。随着培养时间进一步延长,1%葡萄糖组中的一些孔出现非正常变色(由黄色转为红色),导致准确率发生下降,2%葡萄糖组与4%葡萄糖组在16~24 h内保持较高且稳定的准确率,尤其是4%葡萄糖组(图2)。在培养时间达到16 h后,4%葡萄糖组所有多黏菌素E耐药鲍曼不动杆菌均显示阳性,除2株多黏菌素E敏感鲍曼不动杆菌出现假阳性结果外,其余敏感菌株结果均为阴性(表2)。以微量肉汤稀释法结果为标准,4%葡萄糖组快速多黏菌素NP法检测鲍曼不动杆菌多黏菌素E耐药性的灵敏度、特异度和准确率为100%(8/8)、90%(18/20)和 92.9%(26/28)。
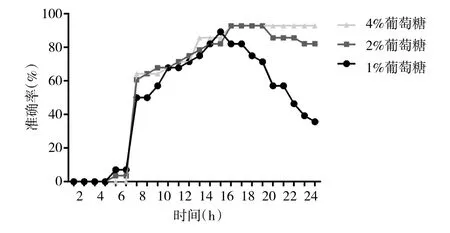
图2 随时间的变化应用于鲍曼不动杆菌的快速多黏菌素NP法的准确率
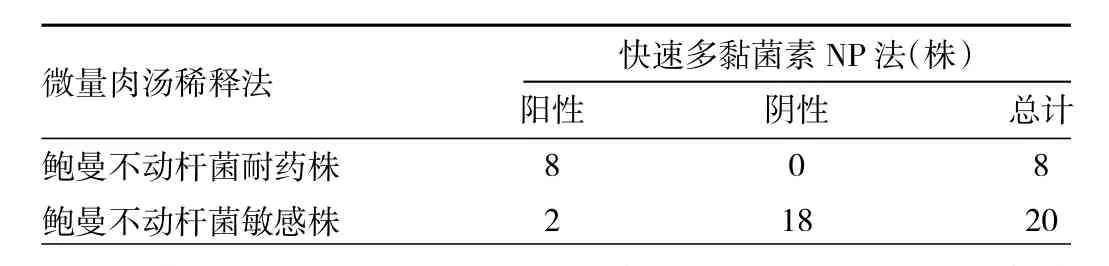
表2 鲍曼不动杆菌快速多黏菌素NP法结果与微量肉汤稀释法结果比较
3 讨论
快速多黏菌素NP法是一种用于检测肠杆菌科细菌多黏菌素耐药性的快速筛查试验。该试验可通过pH指示剂颜色变化来检测在多黏菌素如多黏菌素B或多黏菌素E存在下细菌是否生长并代谢葡萄糖产酸。如Nordmann等[8]所描述的,该方法检测肠杆菌科多黏菌素耐药性的灵敏度和特异度达到了99.3%和95.4%,为快速、准确、高效地检测肠杆菌科多黏菌素耐药性提供了可能性。此外,来自印度和泰国的研究者在使用当地的多黏菌素耐药肠杆菌科细菌对快速多黏菌素NP法进行评估后,表达了对该方法检测性能的认同[11-12]。在本研究中,快速多黏菌素NP法在肠杆菌科临床分离菌株中灵敏度和特异度分别高达100%与99%,可满足临床对快速检测多黏菌素耐药性的需求。
由于鲍曼不动杆菌具备多种逃避抗菌药物的机制,同时MDR鲍曼不动杆菌的流行趋势也十分严峻[13],临床实验室亟需对鲍曼不动杆菌的多黏菌素耐药性进行有效的监测。因此,本研究初步探索了快速多黏菌素NP法应用于鲍曼不动杆菌的可行性,结果显示在提高快速多黏菌素NP试剂中的葡萄糖浓度并延长培养时间后,可获得较高的准确率(92.9%)。经分析,鲍曼不动杆菌变色反应时间延长可能主要归因于代谢途径,与肠杆菌科细菌相比,非发酵菌利用葡萄糖形成酸性代谢物的能力较弱,且分解氮源产生的碱性物质可与酸性物质发生中和反应[14]。此外,1%葡萄糖组在15 h后出现非正常变色(黄色转为红色)导致结果准确率下降可能是由于葡萄糖被耗尽,氮源持续分解产碱使pH值上升而由黄色转为红色(pH>8.4)。当葡萄糖充足时,如葡萄糖浓度达到4%,即可保持结果稳定至24 h以上。尽管快速多黏菌素NP法应用于鲍曼不动杆菌时需要在16 h后才可获得稳定可靠的结果,但其灵敏度与特异度达到了100%与90%,可以满足临床检测鲍曼不动杆菌多黏菌素耐药性的需求。
进一步的耐药机制研究结果显示,在实验菌株中14株大肠埃希菌对多黏菌素E的耐药性与携带mcr-1基因相关(部分耐药机制已发表[15]),14株肺炎克雷伯菌对多黏菌素E的耐药性与染色体基因mgrB和phoQ突变相关(6株未研究),8株鲍曼不动杆菌对多黏菌素E的耐药性主要与lpxA、lpxC、lpxD和pmrB等染色体基因突变或AdeABC/AdeIJK外排泵表达量上升相关。这表明,快速多黏菌素NP法除了具备快速、灵敏、特异、成本低廉和操作简便的优势以外,还具有检测性能不受多黏菌素耐药机制影响的特点。因此,该方法可以作为多黏菌素耐药肠杆菌科细菌及鲍曼不动杆菌的初步筛查手段。然而,该方法还存在一定的局限性。Nordmann等[8]指出由于该方法通过对从橙色到黄色的颜色改变判读结果,所以在解释低水平耐药菌株的结果时应当更加谨慎。在本研究中有一株多黏菌素E敏感(MIC为2 μg/ml)大肠埃希菌的快速多黏菌素NP法结果为阳性,表明快速多黏菌素NP法在检测临近耐药折点(MIC为4 μg/ml)的菌株时准确率可能会降低。此外,Simar等[16]的研究发现快速多黏菌素NP法检测阴沟肠杆菌与产气肠杆菌多黏菌素耐药性的灵敏度仅为25%,因此笔者认为该方法在检测肠杆菌属细菌的多黏菌素E耐药性时可能存在局限,需要更大规模的评估,但在其他多个关于快速多黏菌素NP法的研究中也对肠杆菌属细菌同时进行了评估,且结果的准确率均表现良好[11-12,17-19]。因此仍需要更多的实验菌株以验证不同种类临床分离菌株的快速多黏菌素NP法准确率之间是否存在差异。
综上所述,快速多黏菌素NP法具有快速、方便、灵敏、特异等优势,在检测多黏菌素耐药肠杆菌科细菌方面具有较高的临床应用价值,且经改良后在鲍曼不动杆菌多黏菌素耐药性检测中也具有一定的应用价值,可帮助临床筛查多黏菌素耐药肠杆菌科细菌及鲍曼不动杆菌,为给予患者正确的药物治疗提供参考。

