雷公藤甲素致L5178Y细胞及小鼠Pig-a基因突变风险评价△
王亚楠,闫明,2,汪祺*,文海若*
1.中国食品药品检定研究院,北京 100050;2.中国药科大学,江苏 南京 210009
雷公藤甲素(triptolide,TPL)来源于雷公藤的根,是其主要活性成分之一,研究表明雷公藤具有抗炎、抗风湿、抗癌等广泛的生物活性[1-4]。随着雷公藤甲素应用的增多,大量研究报道表明,雷公藤甲素具有生殖功能毒性、肾毒性、肝毒性等[5-7],另外,其对人体潜在的遗传毒性也成为研究关注的重点。本课题组采用欧盟开发的基于决策树的毒性预测平台Toxtree软件(Version 3.1.01851,Istituto Superiore di Sanita,Italy)预测显示其存在遗传毒性致癌性、鼠伤寒沙门氏菌结构预警及啮齿类动物体内微核结构预警。然而,其遗传毒性产生的具体影响尚缺乏相关研究,仅有部分研究提出,TPL可能导致染色体损伤,如曹易懿[8]研究指出TPL(0.5~75 nmol·L-1)可以诱导人成淋巴TK6细胞微核率升高,杨建一等[9]发现雷公藤多苷10~30 mg·kg-1能够引起小鼠骨髓细胞微核率和染色体畸变率升高。基因突变是癌症发生与发展的重要原因,也是遗传毒性评价的重要检测终点之一,当前TPL致基因突变风险评价方面的研究较少。
Pig-a基因位于X染色体,编码形成糖磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定生物合成所需的N-乙酰葡糖胺基转移酶的催化亚基,其片段中单一突变即可影响GPI锚的合成,并导致细胞表面GPI锚链蛋白的缺失(如CD59、CD24、CD90等),从而可通过检测细胞膜表面锚链蛋白表达水平评价受试物的潜在致基因突变风险。近年来基于Pig-a基因的体外研究也获得一定进展,有相关研究使用小鼠淋巴瘤L5178Y细胞建立体外Pig-a基因突变模型并已对该方法进行了验证研究[10-12]。本实验室首次在国内成功建立并验证基于L5178Y细胞的体外Pig-a基因突变模型[13]。本研究使用L5178Y细胞和昆明种(KM)小鼠分别开展体外和体内Pig-a基因突变研究,评价TPL的潜在致基因突变风险。
1 材料
1.1 细胞
L5178Y TK+/-(3.7.2C)细胞来自日本国立医药品食品卫生研究所,经支原体检查后于液氮长期保存。研究所用细胞为复苏传代后10代以内。
1.2 实验动物
SPF级雄性KM小鼠25只,5~6周龄,体质量25~30 g,购自中国食品药品检定研究院,实验动物许可证号:SCXK(京)2017-0005);在恒温(20~26 ℃)、恒湿(40%~70%)、各12 h明暗周期的条件下饲养。饲养密度为每笼2~3只;提供经钴60放射灭菌的鼠全价颗粒饲料,自由摄食及饮水,取材前不禁食禁水。
1.3 试药
TPL(中国食品药品检定研究院,批号:111567-201404,纯度:99.8%);二甲基亚砜(DMSO,批号:#BCBW5664)、6-磷酸葡萄糖(批号:WXBC7942V)、烟酰胺腺嘌呤二核苷酸磷酸二钠(批号:18E2156560)、青链霉素混合液(批号:2019313)、N-乙基-N-亚硝基脲 (N-nitroso-N-ethylure,ENU,批号:MKCD2123,纯度:98%)、甲基磺酸乙酯(ethylmethylsulfone,EMS,批号:126K0758,纯度:98%)、苯并芘[benzoapyrene,B(a)P,批号:SLBF45532,纯度:96%)均购于Sigma-Aldrich公司;马血清(批号:AC10235369)、磷酸盐缓冲液(PBS,批号:AD19942268),Hyclone公司;APC标记CD45抗体(批号:7166674)、PE标记CD90.2抗体(批号:7110569)、PE标记CD24抗体(批号:553262)、PE标记CD61抗体(批号:553347)均购自BD Biosciences公司;抗-PE磁珠(批号:51810917330)、LS柱(批号:5180614049)均购自Miltenyi公司;哺乳动物淋巴细胞分离液(批号:55-182,Cedarlane公司)、SYTO®13 绿色荧光核酸染料(批号:1987320)、RPMI 1640培养基(批号:2025394)、胎牛血清(FBS,批号:1908121)、绝对计数磁珠(批号:C3695)均购自Thermo Fisher公司;肝匀浆S9(批号:20181105,北京安保迪科技有限公司)。
1.4 仪器
FACSCalibur流式细胞仪(BD bioscience公司);Centrifuge 5810R型高速冷冻离心机(Eppendorf公司);HERA cell VIOS 160i型二氧化碳培养箱(Thermo Fisher公司);NU-543-400S型生物安全柜(Nuair公司);CKX31型倒置显微镜(Nikon公司);QuadroMACSTMSeparator免疫磁性分离架(Miltenyi公司)。
2 方法
2.1 基于L5178Y细胞的体外Pig-a基因突变实验
2.1.1细胞培养 将L5178Y细胞解冻复苏后置于完全培养基R10(含10%马血清、1%青-链霉素混合液、丙酮酸钠0.2 mg·mL-1的RPMI 1640培养基),在37 ℃、5% CO2的培养箱内培养,培养基隔天更换,待细胞增殖至适宜密度后进行实验。
2.1.2TPL对L5178Y细胞的毒性检测 非S9(-S9)代谢条件:细胞达对数生长期后,更换R0培养基(含1%青-链霉素混合液和丙酮酸钠0.2 mg·mL-1的RPMI 1640培养基),分为对照组(DMSO)、阳性对照组(EMS 500 μg·mL-1)和TPL不同质量浓度(6.3、12.5、25、50、100 ng·mL-1)组,各组加入不同药物后,调整细胞密度为50×104个/mL于10 mL培养基中,于37 ℃、5% CO2条件下与受试物作用24 h。收集细胞并计数,室温离心(340×g,5 min),PBS洗涤2次。将细胞重悬于10 mL完全培养基R10并维持密度为1.0×106~2.0×106个/mL,培养8 d。
S9(+S9)代谢条件:细胞达对数生长期后,更换R0培养基,分为对照组(DMSO)、阳性对照组[B(a)P 5.0 μg·mL-1]和TPL不同质量浓度(12.5、25、50、100、200 ng·mL-1)组,各组加入不同药物和2% S9后,调整细胞密度为50×104个/mL于50 mL离心管中,置于气浴摇床中37 ℃、20 r·min-1振摇4 h。细胞经室温离心(340×g,5 min)后,PBS洗涤2次。将细胞重悬于10 mL完全培养基R10。给药后24 h细胞计数,将细胞密度维持为1.0×106~2.0×106个/mL,培养8 d。
细胞毒性通过细胞倍增速率(PD)和相对细胞倍增速率(RPD)进行评价,见公式(1)~(2)。
PD=lg(受试物处理后细胞数/初始细胞数)/lg2
(1)
RPD=(PD药物/PD对照)×100%
(2)
2.1.3TPL对L5178Y细胞Pig-a基因突变率的影响 细胞分组及处理同2.1.2项下。取2×106个细胞进行离心(340×g,4 ℃,5 min),弃上清,每组加5 mL工作液(含有2%FBS的PBS),混匀离心(340×g,4 ℃,5 min)。吸弃上清液,每孔加入CD45、CD90.2抗体混合工作液200 μL,终质量浓度为1 μg·mL-1,重悬细胞并混合均匀。将细胞置于2~8 ℃避光孵育30 min,后置于室温继续孵育10 min。孵育结束后,重悬细胞后转移至5 mL工作液中离心(340×g,4 ℃,3 min)。吸弃上清液,加入300 μL工作液,混合均匀后转入流式管中上机检测。突变型细胞表面无CD90.2蛋白,CD45蛋白正常表达,故在流式图中显示无藻红蛋白(PE)荧光,别藻蓝蛋白(APC)荧光正常,根据公式(3)计算细胞相对突变数。
细胞相对突变数=突变细胞数/总细胞数×106
(3)
2.2 KM小鼠体内Pig-a基因突变实验
2.2.1分组与给药 KM小鼠在给药前检疫适应6 d。根据文献及课题组前期研究确定最终实验用TPL剂量为50、100、200 μg·kg-1[14-15]。检疫期第6天按体质量随机分组法分为5组(对照组、雷公藤甲素各剂量组、阳性对照ENU组),每组5只,分组时个体体质量差异小于平均体质量的±20%。ENU给药方式为腹腔注射,仅于首次给药日给药1次,其余给药方式为经口灌胃,连续给药28 d,给药体积为10 mL·kg-1。
2.2.2小鼠体质量检测 研究期间每天观察小鼠症状,给药及给药结束后每周各测定2次体质量,直至解剖结束试验。
2.2.3TPL对小鼠Pig-a基因突变率的影响 第0、14、28、42、56天使用毛细管经眼内眦采血收集80~100 μL新鲜血液于K2EDTA采血管,混匀防止凝血。转移60 μL血液置于含有100 μL 1%肝素钠的EP管中稀释抗凝,全部转移至淋巴细胞分离液,离心,洗涤红细胞(RBC)。将RBC与抗体进行2~8 ℃、避光孵育20 min,取1管溶媒对照组细胞悬液不经抗体标记,2~8 ℃保存,作为模板调试组分A,孵育结束后离心(340×g,4 ℃,5 min),洗脱转移。所有细胞组均加入Anti-PE磁珠悬液置于2~8 ℃、避光孵育20 min,孵育完成后离心(340×g,4 ℃,5 min),洗脱。柱前样品和模板调试组分A核酸染色:向流式管中加入990 μL核酸染料-计数微球混合工作液,取10 μL细胞悬液转移至流式管中,室温避光孵育10 min,后置于4 ℃避光孵育5 min,此为柱前样品。取同一溶媒对照组样品作为模板调试组分B。搭建免疫磁性分离架,洗涤工作液润洗,后加入上述剩余细胞悬液,上柱分离,待全部组分流出后加入洗涤工作液洗涤分选柱,用同一离心管收集洗出液,离心(800×g,4 ℃,5 min),弃上清,向离心管中加入300 μL核酸染料-计数微球混合工作液全部转移至流式管中,室温避光孵育15 min。孵育完成后于2~8 ℃、避光保存至少5 min,在3 h内上流式分析,此为柱后样品。取相等体积(各200 μL)模板调试组分A、B充分混合,吹打均匀,即得含50%突变细胞和50%野生细胞的模板调试样品,高速上样,调节电压和荧光补偿,建立分析模板。建立模板后,进行柱前/后样品检测,高速上样,每份柱前样品分析1000个计数微球时停止,每份柱后样品尽可能分析全部细胞悬液。随后根据柱前和柱后样本分析突变细胞数目。
因RBC无细胞核,通过核酸染料可对RBC和网织红细胞(RTC)进行区分,突变型细胞表面无CD24蛋白,通过PE荧光对突变型细胞进行区分,测定网织红细胞数(RET)。按照公式(3)~(4)分别计算RBC、RTC的相对突变数及RTC占比。
RTC占比=RET/RBC×100%
(4)
2.3 统计学方法
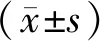
3 结果
3.1 L5178Y细胞Pig-a基因突变实验
3.1.1TPL的细胞毒性 TP给药后24 h(-S9)及4 h(+S9)的RPD结果见图1。结果表明,-S9代谢和+S9代谢状态下TPL各质量浓度组RPD均大于50%[12],提示TP在给药质量浓度范围内均未见明显的细胞毒性作用。

图1 TPL对L5178Y细胞RPD的影响
3.1.2TPL对L5178Y细胞Pig-a基因突变的影响 -S9和+S9代谢状态下TPL给药组24 h后培养8 d 时Pig-a基因突变频率结果显示,与对照组比较,TPL各剂量组细胞相对突变数差异无统计学意义,且无剂量依赖性(见图2~3)。

注:A.-S9代谢条件;B.+S9代谢条件。图2 -S9和+S9代谢条件下TPL对L5178Y细胞Pig-a基因突变的影响
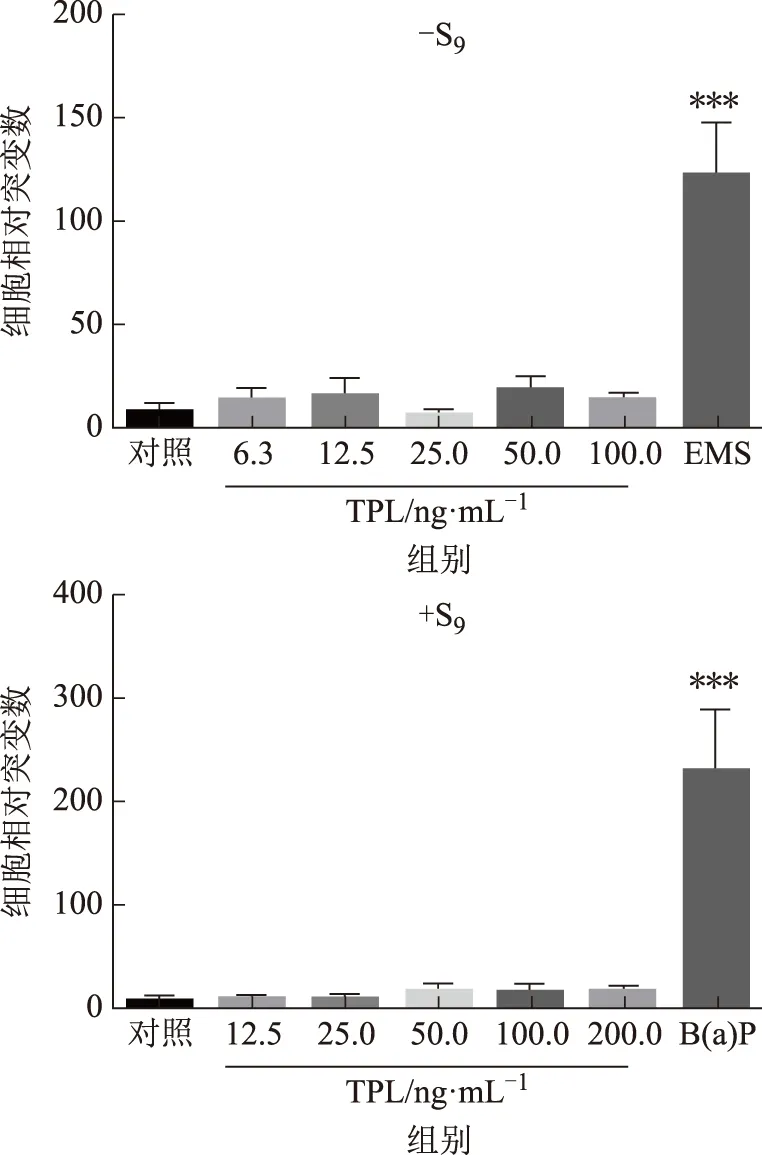
注:与对照组比较,***P<0.001。图3 TPL对L5178Y细胞Pig-a基因突变的影响
3.2 小鼠Pig-a基因突变实验
3.2.1TPL对小鼠体质量的影响 KM小鼠连续灌胃给予TPL 28 d后继续观察28 d,期间未见死亡。但TPL给药组多只小鼠出现相互撕咬,发现后立即分笼饲养,另有尾尖坏死、毛发稀疏、精神不佳等表现,其中TPL 100、200 μg·kg-1组分别有3、2只,发生率为30%。实验期间所有组小鼠平均体质量稳步增长,给药组与对照组比较差异无统计学意义(见图4),提示连续28 d给予KM小鼠200 μg·kg-1及以下剂量TPL未产生明显整体毒性。

图4 TPL对小鼠体质量的影响
3.2.2TPL对小鼠Pig-a基因突变率的影响 给药第28天对照组、TPL各剂量组和ENU组柱前和柱后样品流式结果显示(见图5~6),所有组小鼠RTC占比随实验时间延长呈降低趋势,在给药28 d结束后略有升高,该现象可能与RBC生成减少后的代偿性RTC增加有关。与对照组比较,TPL各剂量组小鼠RTC占比差异无统计学意义。阳性对照ENU组小鼠RBC和RTC的细胞相对突变数自给药14 d后与相同时间点对照组比较,差异有统计学意义(P<0.001),提示实验体系成立。而TPL各剂量组小鼠在首次给药后56 d内RBC和RTC的细胞相对突变数与对照组比较差异无统计学意义,表明在实验条件下,TPL 200 μg·kg-1及以下剂量对KM小鼠无碱基突变风险。

图5 TPL对小鼠Pig-a基因突变率的影响
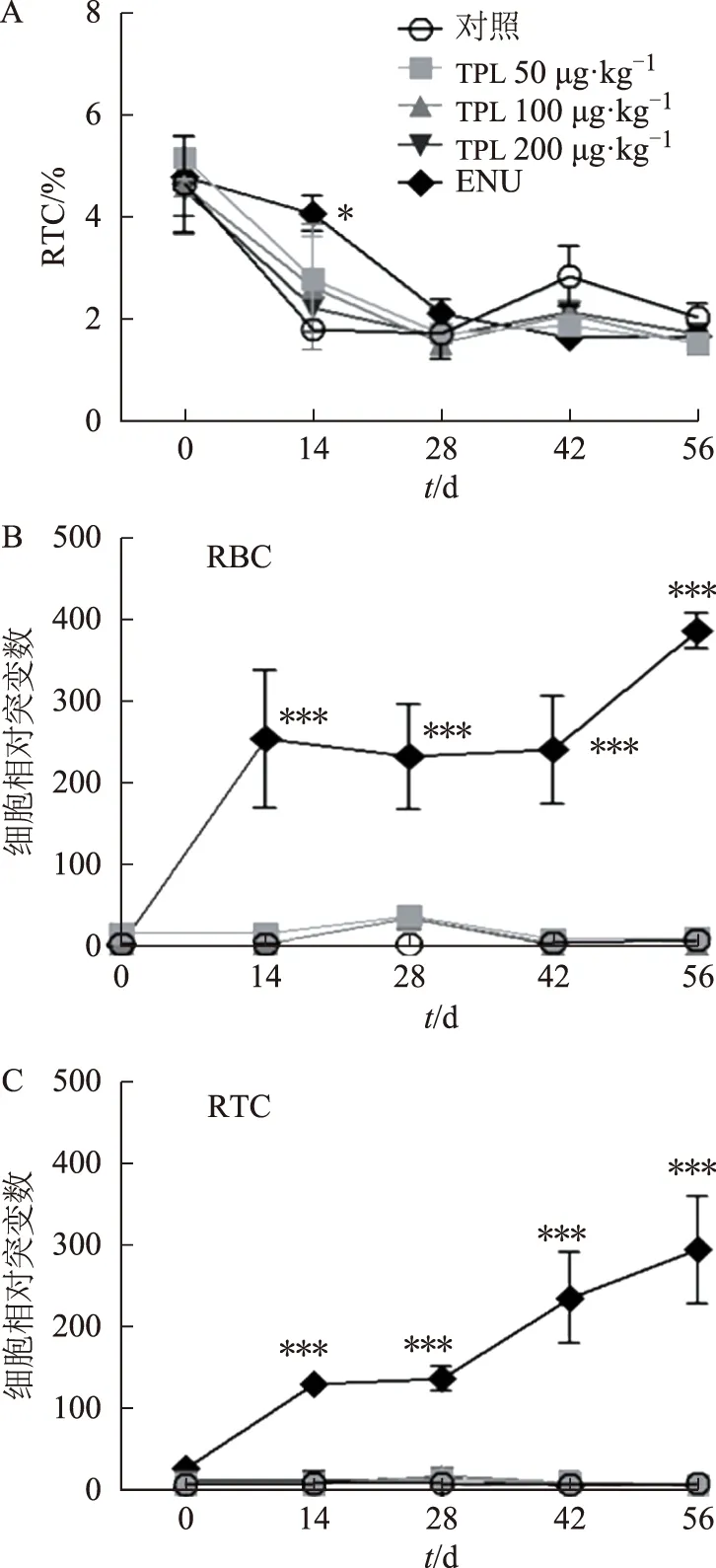
注:A.RTC占比;B.RBC细胞相对突变数;C.RTC细胞相对突变数;与对照组比较,*P<0.05,***P<0.001。图6 TPL对KM小鼠Pig-a基因突变的影响
4 讨论
TPL是一种环氧二萜内酯化合物,内酯是一种活性化学物质,广泛应用于化学合成、溶剂、脱漆剂和抗菌药物的中间体。含有TPL的药物制剂如雷公藤多苷片、雷公藤片等在临床上应用极为广泛,故对TPL的遗传毒性进行研究尤为重要。内酯环结构作为预警结构在Toxtree的决策树下显示在-S9代谢条件下存在致突变风险[14,16-17]。TPL自身毒性较大,给药剂量选择是研究的难点之一。本课题组前期研究结果[15]显示连续3 d给予SD大鼠TPL 450 μg·kg-1未见动物死亡。李新秀等[18]研究显示,连续给予TPL 14 d后200 μg·kg-1组见1只KM小鼠死亡(1/6),其解剖结果显示脏器等无异常;连续给予TPL 28 d后,200 μg·kg-1组KM小鼠死亡率达33%(3/9),分析其原因是动物数目较少可存在较大个体差异或因人为因素造成。综合以上结果,本研究确定TPL最大给药剂量为200 μg·kg-1。研究结果显示,连续28 d给予KM小鼠TPL 200 μg·kg-1及以下剂量,未见小鼠死亡,但动物整体状态不佳,提示200 μg·kg-1作为最大给药剂量研究其潜在遗传毒性致突变较合理。
本课题组在国内首次使用L5178Y细胞建立和验证体外Pig-a基因突变模型,L5178Y细胞自发背景突变率低,无需进行前期预清除,保证实验灵敏度与准确性。结果显示,在本研究条件下,TPL给药组L5178Y细胞基因突变频率与对照组比较差异无统计学意义,提示无遗传毒性致突变作用。在体内Pig-a基因突变研究中,课题组前期连续3 d重复给予SD大鼠TPL 450 μg·kg-1,在首次给药前和末次给药后7、14、28、35、56 d所有时间点尾静脉采血进行流式检测,与对照组比较均未见Pig-a基因突变率上升[15]。本研究采用KM小鼠连续给药28 d,并于给药前和首次给药后14、28、42、56 d眼内眦采血进行流式检测,TPL各剂量组均未见Pig-a基因突变率上升,再次验证TPL无体内致Pig-a基因突变作用。TPL自身结构较大,在DNA复制过程无法模拟碱基插入DNA序列引起碱基对的改变,造成基因突变,这也与相关研究报道TPL存在遗传毒性主要是导致染色体损伤等相一致[19-20]。本研究结果表明,TPL不具有遗传毒性致Pig-a基因突变作用,验证软件预测结果,为后续研究提供参考。

