响应面法优化高产多聚谷氨酸菌株冻干保护剂的研究
陈 斐,黄天悦,张旭松,曾 鑫,郭佳强,陈孝平
武汉工程大学环境生态与生物工程学院,湖北 武汉430205
菌种作为生产的源头,直接关系到最终产品的产量和质量,其重要性不言而喻[1]。为了保证菌种的质量,保持菌种的活力,不管是在基础的科研工作,还是在微生物的应用研究中,都需要使用正确的菌种保藏方法和技术[2]。而菌种在保藏过程中往往会因为光照、温度、湿度、营养条件等原因导致菌种的退化,从而影响其经济效益[3]。目前人们采用的各种菌种保藏方法都是根据不同菌种的生理生化特点,为其提供低温、干燥的生活条件,使微生物处于休眠或生长停滞状态,从而使其性状及遗传物质保持稳定,达到维系种系的目的[4~6]。真空冷冻干燥是通过将菌体预冻后,使其处在真空环境中进行干燥的方法,属于低温升华干燥;此法尤其适用于热敏性和易挥发物质,而且活菌菌剂经真空冷冻干燥后稳定性强,并且容易保存,是目前制备活菌干燥制剂的主要方法[7]。但是微生物在真空冷冻干燥之后其细胞存活率很低,这是因为处在低温干燥的环境中微生物细胞及其中某些酶及蛋白质分子会遭到破坏,而导致微生物的死亡。研究表明,为了在低温干燥过程中不损伤微生物细胞的生物活性,会加入不同的冻干保护剂,使其改变微生物所处的物理或化学环境,从而减少低温环境对微生物的伤害[8]。
基于每种保护剂不同的保护机制,并且单一的保护剂的添加往往达不到保护菌种的需求,因此通常组合使用几种不同种类的保护剂来提高真空冻干菌剂中活菌存活率[9]。当不同的保护剂同时存在时,可协同强化保护效果,从而最大化保护菌体细胞。
本试验通过对枯草芽孢杆菌进行真空冷冻干燥,对复合冻干保护剂配方进行响应面优化,并筛选出其工艺参数,以期制备出高活性T1B菌剂。
1 实验部分
1.1 材料与设备
菌种:T1B菌株由实验室分离保存。
试剂:胰蛋白胨、酵母浸粉、明胶、L-谷氨酸钠、NaCl、C6H5Na3O7·2H2O、蔗糖、葡萄糖、麦芽糖、NH4Cl、KH2PO4、MgSO4·7H2O、MnSO4·H2O、CaCl2、FeCl3·6H2O、丙三醇(甘油)、可溶性淀粉、甘露醇、海藻酸钠、L-半胱氨酸、谷氨酸钠,以上试剂均为分析纯。脱脂奶粉购于雀巢公司。
1.2 培养基
枯草芽孢杆菌活化培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L、蔗糖1 g/L,pH调至7.0~7.2。
枯草芽孢杆菌增殖培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、L-谷氨酸钠30 g/L、NaCl 10 g/L、C6H5Na3O7·2H2O 16.8 g/L、蔗糖20 g/L、NH4Cl 7 g/L、KH2PO40.5 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·H2O 0.1 g/L、CaCl20.15 g/L、FeCl3·6H2O 0.04 g/L,pH调至7.0~7.2。
LB固体培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L、明胶7.5 g/L,pH调至7.0~7.2,用于枯草芽孢杆菌的计数。
1.3 实验方法
1.3.1 工艺流程菌种活化→菌种富集培养→冷冻离心收集菌体→添加冻干保护剂→活菌计数→预冻→真空冷冻干燥→冻干菌剂→活菌计数[7]。
1.3.2 冻干剂的优化在单因素试验确定对细胞冻干存活率影响显著的保护剂因素的基础上根据Box-Behnken Design试验设计原理采用三因素三水平的响应面分析方法进行试验。
1.3.3 菌体离心收集工艺的优化按照表1设定的参数将T1B菌液进行离心,分别测定其离心损失率和离心存活率。计算不同参数下T1B菌种的存活率,确定最佳离心工艺。
离心存活率、离心损失率、离心收得率计算公式如下:

1.3.4 菌种存活率计算

1.3.5 复合冻干保护剂与菌体沉淀的配比优化将筛选出的复合保护剂与菌体沉淀分别按照体积与质量比为1∶1、1.5∶1、2∶1、2.5∶1、3∶1均匀混合制成菌悬液,将pH调至7.0~7.2,进行真空冷冻干燥。比较不同配比下的T1B菌剂冻干存活率,确定最佳配比。
1.3.6 复合冻干保护剂pH对T1B菌剂冻干存活率的影响将实验1.3.2中筛选出的最佳复合冻干保护剂的pH值调整为5.5、6.0、6.5、7.0、7.5。并与菌体沉淀混合制成菌悬液,进行真空冷冻干燥。比较不同pH值下的T1B菌剂的冻干存活率,每组实验重复3次以确定最适值。
2 结果与讨论
2.1 菌体离心收集工艺的研究
在制备T1B活菌制剂时,浓缩收集菌体细胞是其中的重要环节,而在工业生产中一般通过离心来收集。低温离心可促使菌体与其分泌的毒性代谢产物分离,从而提高菌体的存活率。但是在高转速以及长离心时间的环境中,微生物细胞易受到剪切力的影响,致使细胞破碎,从而降低细胞存活率[10]。按照表2设定参数进行离心,通过检测离心前初始活菌数、离心后上清液活菌数和沉降细胞活菌数,计算离心损失率、存活率及收得率。结果见表2。
由表2可知,离心损失率和离心存活率随着离心转速和时间的不断增加,两者都呈现下降的趋势。其中在4 000 r/min离心10 min条件下离心损失率和离心存活率最高,且离心损失率相互之间差异显著,而离心存活率相互之间差异不显著。
在4 000 r/min离心10 min,以及7 000 r/min离心5 min条件下,离心收得率最大,离心效果最好,但最佳离心条件的选择还需要考虑经济成本,尽量选取低转速或较短的离心时间。由表2可知,选择7 000 r/min离心5 min,所得离心收得率最高,离心效果最好,可达92%以上。
2.2 冻干保护剂单因素的筛选结果
在真空冷冻干燥过程中加入冻干保护剂可降低冷冻干燥对菌体的损害,保持菌体的生物活性及其生理生化特性,提高冻干后菌剂中目的菌种的存活率[11]。参考相关文献报道[12-13],选取葡萄糖、蔗糖、麦芽糖、甘油、可溶性淀粉、甘露醇、谷氨酸钠、L-半胱氨酸、海藻酸钠、脱脂奶粉作为菌种冻干保护剂进行冷冻干燥,筛选保护效果较好的保护剂。结果见表3。
根据试验结果,并根据保护剂分子大小的不同将其复配使用,选择脱脂奶粉质量分数10%、蔗糖质量分数10%、麦芽糖质量分数10%为最优单因素,进行下一步T1B复合冻干保护剂的优化。
2.3 Box-Behnken响应面优化复合冻干保护剂
(1)多元二次回归模型的建立和方差分析
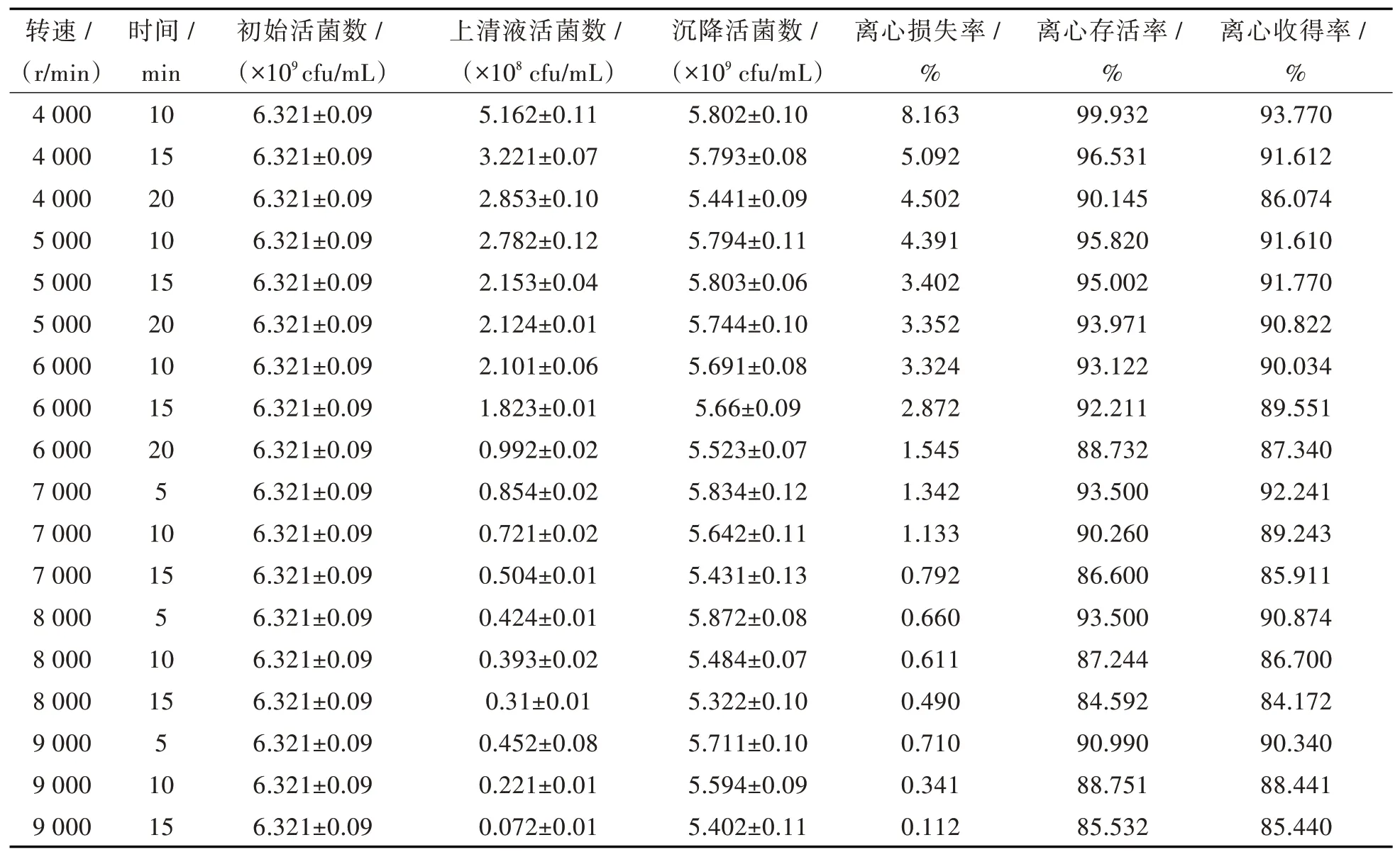
表2离心转速和离心时间对T1B的影响Tab.2 Effect of centrifugal speed and time on T1B
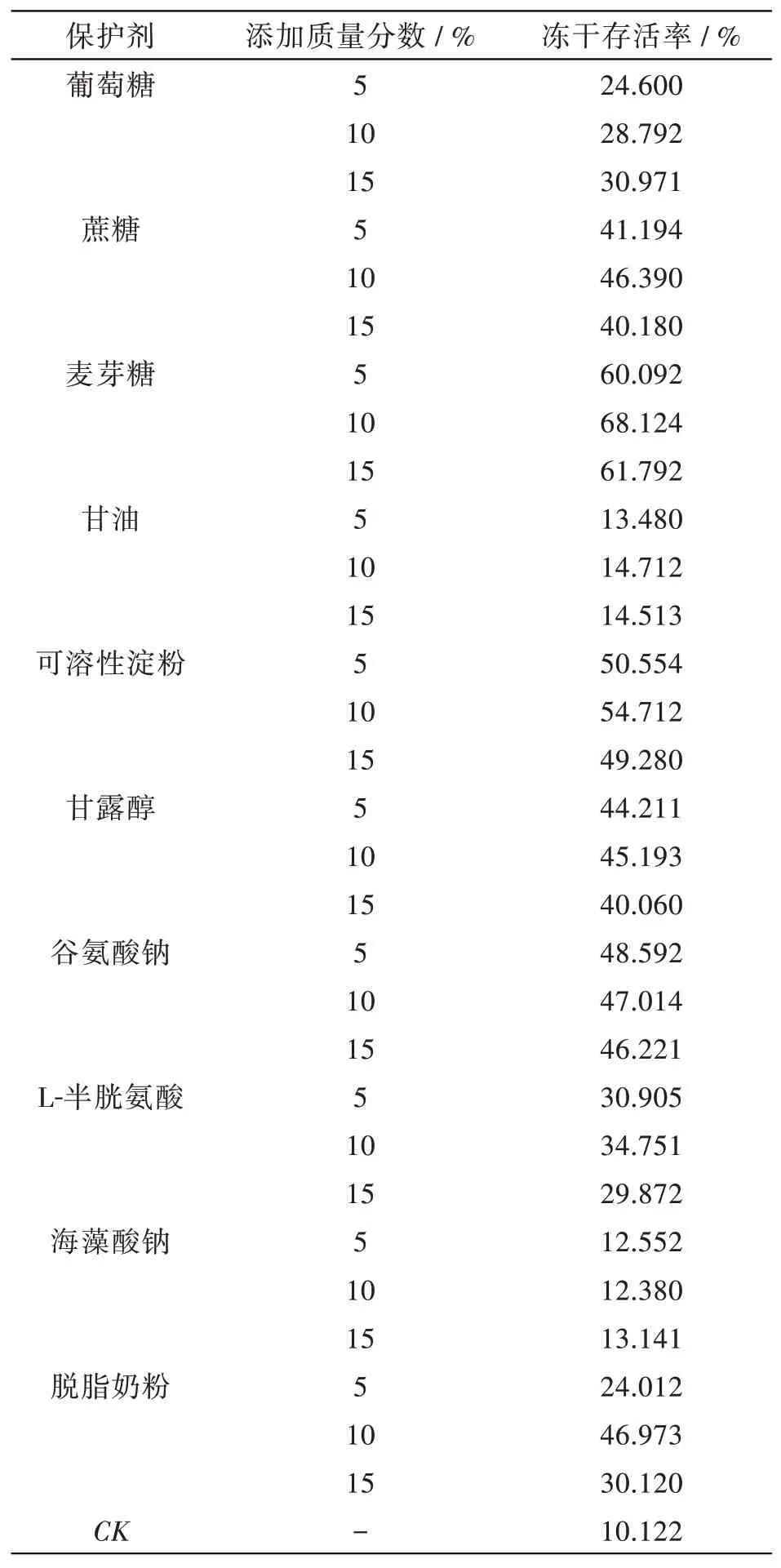
表3冻干保护剂单因素试验结果Tab.3 Results of single factor test of lyophilized protective agent
根据单因素试验的结果,以脱脂奶粉、蔗糖、麦芽糖3种物质的质量分数3个因素为自变量,T1B冻干存活率为响应值,设计三因素三水平Box-Behnken试验。试验设计及结果见表4。
利用Design-Expert 6软件对表的实验数据进行二次多项回合拟合,获得回归方程:

方程式中,Y为T1B冻干存活率的预测响应值,A,B,C,分别为脱脂奶粉、蔗糖、麦芽糖的编码值。回归模型的方差分析见表5。
由表5可知,该模型P值为0.008 5,小于0.01,差异极显著,即对T1B冻干存活率的影响极显著;失拟项P值为0.720 6,大于0.05,失拟项差异不显著,说明模型的拟合度很好,接近实际情况,模型可靠。模型的决定系数R2=97.43%,矫正系数AdjR2=90.12%,说明预测值与实际值之间具有一致性,故此模型可对菌体数量进行分析和预测。

表4 Box-Behnken试验设计及其结果Tab.4 Box-Behnken design and experimental results
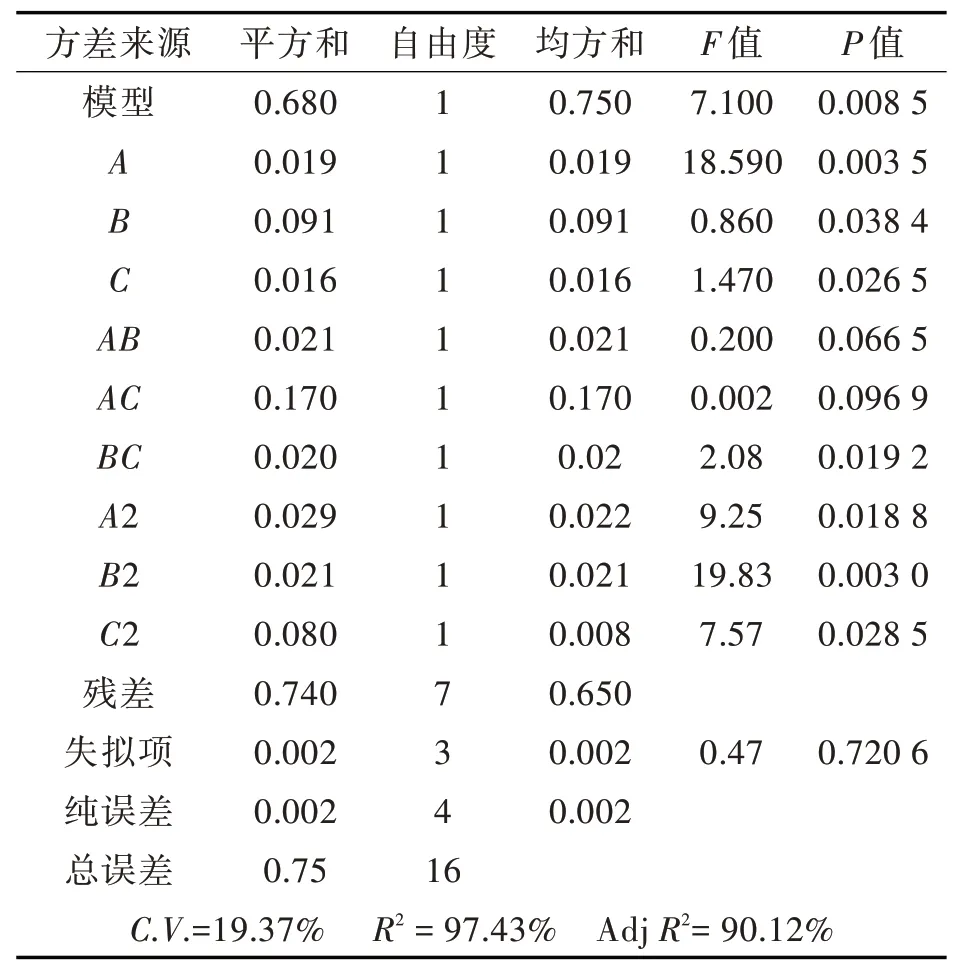
表5响应面二次项模型方差分析Tab.5 ANOVA for response surface quadratic model
由表5可知,回归方程中各因素影响为显著和极显著,说明对T1B冻干存活率的影响较大。
(2)响应面交互作用分析及最优点的寻求
为进一步探究A、B、C的交互作用对响应值的影响,采用Design-Expert 6.0软件绘制等高线图及对应的三维响应面图。具体结果见图1。
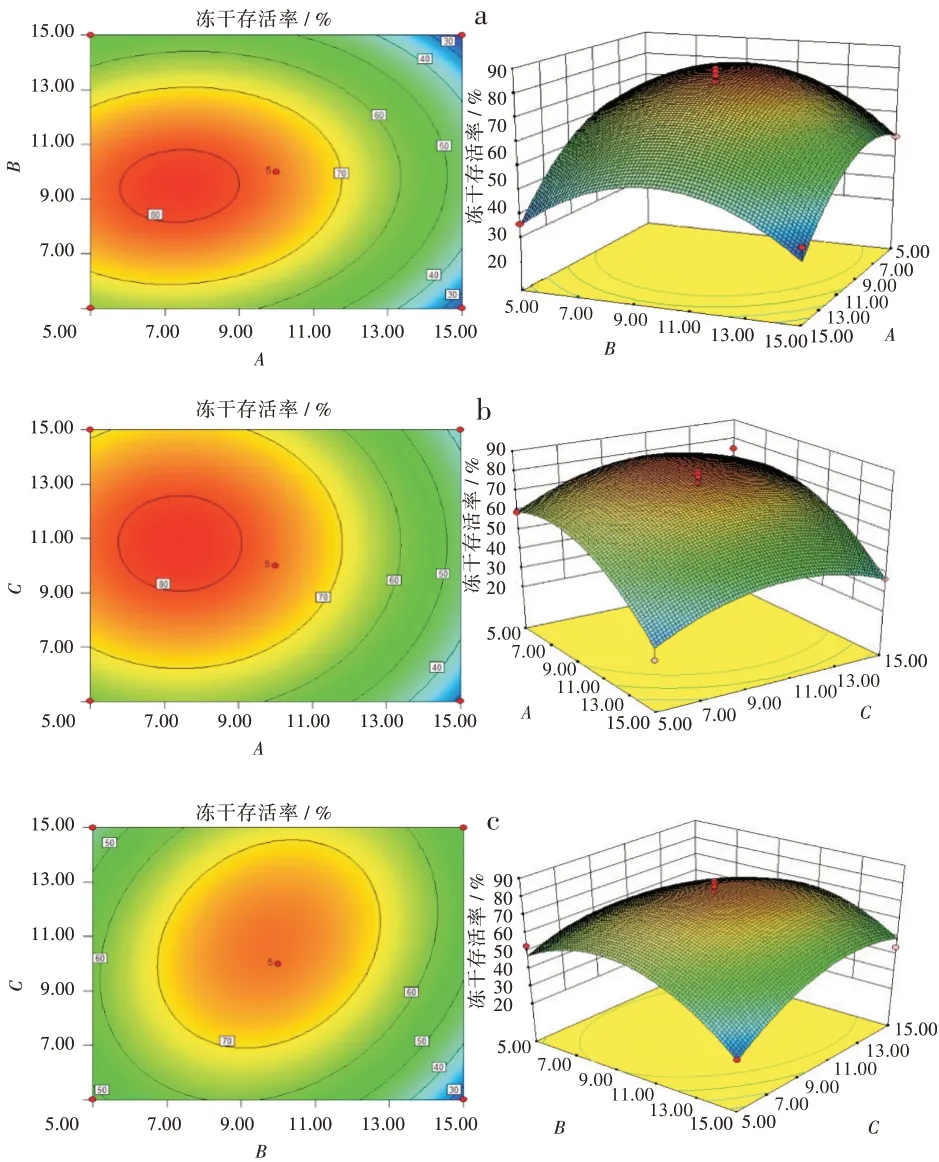
图1脱脂奶粉A、蔗糖B以及麦芽糖C交互作用等高线图及相应响应面图:(a)A:脱脂奶粉与B:蔗糖,(b)A:脱脂奶粉与C:麦芽糖,(c)B:蔗糖与C:麦芽糖Fig.1 Contour maps and corresponding response surface maps of interaction of skimmed milk powder A,sucrose B,and maltose C:(a)skimmed milk powder A and sucrose B,(b)skimmed milk powder A and maltose C,(c)sucrose B and Maltose C
根据图1的结果,表明脱脂奶粉与蔗糖、脱脂奶粉与麦芽糖以及蔗糖与麦芽糖两两之间的交互作用较显著。冻干存活率都是随着浓度增加呈现先增大后减小的趋势。从响应面分析结果可知,当A=7.39,B=9.60,C=10.71时,Y值取得最大值。即当脱脂奶粉浓度为7.39%,蔗糖浓度为9.60%,麦芽糖浓度为10.71%时,T1B菌体的存活率的理论值最大为83.8%。
2.4 复合冻干保护剂与菌体沉淀的配比及最适pH的确定
很多研究学者认为,冻干保护剂的羟基通过氢键与蛋白质结合,使蛋白质分子表面形成一层水化膜,稳定蛋白质分子结构,可在低温干燥环境下维持其完整的结构和功能,因此冻干保护剂的浓度对菌种的冻干存活率也有很大的影响[14-15]。此外复合冻干保护剂的pH值对T1B的存活率也有一定的影响。为确定复合冻干保护剂与菌体沉淀的最佳配比以及复合冻干保护剂的最适pH值,分别测定了保护剂与菌体沉淀的体积质量之比为1∶1、1.5∶1、2∶1、2.5∶1、3∶1时T1B的冻干存活率;以及复合保护剂的pH值为5.5、6.0、6.5、7.0、7.5时T1B的冻干存活率。其结果如图2所示。
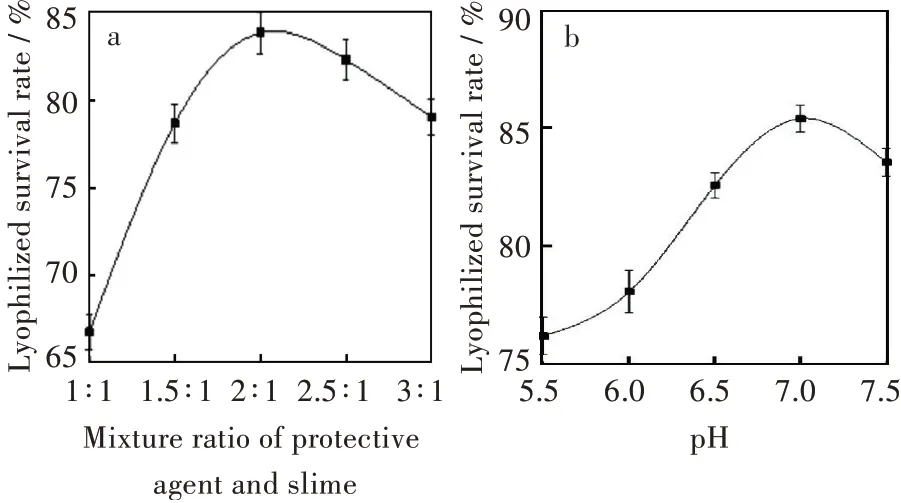
图2影响T1B的冻干存活率的因素:(a)保护剂与菌泥混合配比,(b)保护剂pHFig.2 Factors of effect on freeze-dried survival rate of T1B:(a)mixing ratio of the protective agent to bacterial mud,(b)protective agent pH
由图2可知,T1B的冻干存活率随着保护剂与菌体沉淀之比的逐渐增大有明显提升,表明在T1B菌体内部和表面上分布足够多的保护剂,可在最大限度上发挥对菌体的保护作用。当保护剂与菌体沉淀之比继续增大后,T1B的冻干存活率有少量下降,说明冻干保护剂过量反而会降低菌体的存活率,可能是由于保护剂过多导致细胞的通透性降低,也可能是由于单位体积内的菌体数量较少。当保护剂与菌体沉淀之比为2∶1时,T1B冻干存活率达到最高为83.9%。
在酸性条件下,T1B的冻干存活率随着保护剂pH的增大而增大。但随着pH的继续增大,T1B的冻干存活率呈下降趋势,表明过大的pH会对T1B的生长产生抑制。当保护剂的pH值升高到7.0时,T1B的冻干存活率达到最大值为84.9%,可能是因为此时的pH最适宜枯草芽孢杆菌生长,能够在一定程度上提高菌体的存活率。
2.6 复合冻干保护剂效果验证
将配制好的复合冻干保护剂与T1B菌体沉淀以2∶1的体积与质量比均匀混合制成菌悬液,pH值调整为7.0,进行真空冷冻干燥。其冻干存活率达到85.3%,其冻干菌剂活菌数为1.26×1011cfu/g,最后将冻干菌剂装入灭菌的冻存管内密封保存。
3 结论
本研究利用响应面法对实验室分离的一株T1B菌株的冻干保护剂配方进行了优化,确定T1B菌株复合冻干保护剂配方为:脱脂奶粉浓度为7.39%,蔗糖浓度为9.60%,麦芽糖浓度为10.71%,优化后的冻干保护剂在冻干过程中对于T1B菌体保护效果显著,此时的菌体存活率理论值最大为82.7%,并确定菌体最佳离心条件为7 000 r/min 5 min,复合冻干保护剂适宜pH为7.0,与菌体沉淀的最佳配比为2∶1。经验证,优化后的冻干存活率达到85.3%。此项研究为枯草芽孢杆菌的复合发酵剂菌剂的实际生产提供了理论参考。

