赤霉素处理后层积对鲜黄连种子萌发的影响1)
宋金雨 张寒冰 张彦妮 岳桦
(东北林业大学,哈尔滨,150040)
鲜黄连(PlagiorhegmadubiaMaxim.)是小檗科鲜黄连属多年生草本植物,植株高10~30 cm,单叶,叶片轮廓近圆形,花期4—5月,果期5—6月。鲜黄连属仅有2种植物,一种是产于东亚的鲜黄连,另一种是产于北美的二叶鲜黄连(Jeffersoniadiphylla)。鲜黄连多生于山坡灌丛中或林下较阴湿的环境,自然分布于我国东北吉林省、辽宁省,俄罗斯、朝鲜等地[1]。鲜黄连因其独特的景观和药用价值[2-5],导致根茎被大量采挖,野生资源遭到严重破坏[1]。而有关鲜黄连的繁育方法,主要有种子繁殖为主的有性繁殖和以植物组织培养、分株繁殖为主的无性繁殖,虽然在2014年王晓炜等对鲜黄连的组培进行了一定的研究[1],但是组培方法存在一定的技术难度,分株繁殖存在增殖系数较低、后代退化的问题,所以,种子繁殖是鲜黄连人工育苗工作中最可靠、繁殖效率最高的繁殖方式。然而,鲜黄连种子存在休眠现象,在自然环境中种子从结实落地到破土长出第一片真叶,一般需要10~11个月的时间,同时有大量种子在休眠期间丧失了生命力,限制了鲜黄连的人工种植,致使鲜黄连的市场供应不足,加剧了资源的匮乏。种子休眠期长、发芽率低导致鲜黄连资源再生困难,所以,为解决市场对鲜黄连的景观与药用的资源需求问题,对于鲜黄连种子快速破眠的研究十分有实际意义。
在鲜黄连属的种子快速破眠的方面研究较少,仅有2篇文献报道。1989年Jerry et al.[6]对鲜黄连属的二叶鲜黄连种子快速破眠进行了研究,用质量浓度为1 000 mg·L-1的赤霉素溶液浸种后在20 ℃中层积处理,14周后仅有1%~9%种子萌发。2015年Rhie et al.在韩国对鲜黄连种子进行了快速破眠研究[7]。用质量浓度为1 000 mg·L-1的赤霉素溶液浸种后在变温条件下层积3个月,可以使种子萌发率达到74.2%,但是在预实验中尝试用此方法处理鲜黄连种子,层积5个月仍不能使鲜黄连种子萌发,与其研究结果存在较大差距。由于采用上述方法未能获得种苗,为解决鲜黄连资源需求问题,为了研究探讨鲜黄连种子休眠与萌发特性,因此,对鲜黄连种子进行解剖形态观察、萌发抑制物质提取、赤霉素浸种沙藏等试验,探索研究鲜黄连种子休眠的原因、类型、种子是否含有萌发抑制物质,种子快速破眠方法等,以期为鲜黄连种子休眠与萌发研究提供一定理论参考,并为种子栽培繁殖育苗提供理论依据与实践指导。
1 材料与方法
试验种子采摘于黑龙江省森林植物园鲜黄连种植区,2019年6月5日采收后种子全部放置于4 ℃中储存。
干种子基本信息测定:利用电子游标卡尺,对干种子的长度、粒径进行测量。随机选取100粒种子在电子天平上称质量测量其百粒质量,重复5次。在体式显微镜下观察吸水前、吸水后与沙藏过程中鲜黄连种子的形态特征。
种子含水量测定[8]:按照国际种子检验规程,将已称量种子放入带盖样品盒,置于烘箱内(103±2)℃烘18 h后,放入干燥器内冷却,再次称量样品,3次重复,计算处理前后质量差值。种子相对含水量=[(烘前试样质量一烘后试样质量)/烘前试样质量]×100%。
种子吸水率测定[8]:取供试鲜黄连种样100粒,3次重复,置于蒸馏水中,在恒温25 ℃下使其吸水,每12 h将种子取出,用滤纸吸干外表后称质量,直至其重量恒质量,记录数据,依据公式:吸水率=[(湿质量-干质量)/干质量]×100%,计算吸水率,制作吸水曲线。
该试验采用TTC染色法[8]测定鲜黄连种子的生活力。随机取30粒种子(每组30粒,共3组),水浸泡24 h,纵向切开种子,再以体积分数0.1% TTC溶液在恒温箱中30 ℃于黑暗条件下染色24 h后,放在显微镜下观察胚及胚乳着色情况。
种子萌发抑制物质生物学测定:参考常晖[9]等人的方法,以台湾456白菜种子作为生物测定种子,蒸馏水和80%乙醇为浸提液。称取磨碎种子1 g共6份,分别置于100 mL的三角瓶中,3瓶加入10 mL蒸馏水,3瓶加入10 mL的体积分数80%乙醇,分别在水浴中25、35、45 ℃浸提2 d。浸提液收集到离心管内5 000 r/min离心10 min,过滤,56 ℃条件下浓缩至一定体积后(醇提液蒸干溶剂),用蒸馏水定容至10 mL,得浸提液质量浓度为0.10 g/mL,4 ℃条件下保存。以蒸馏水为对照。在直径90 mm的培养皿内放入2层滤纸,分别加入各浸提液4 mL,白菜种子每皿60粒,3次重复,在光照与黑暗各12 h的25 ℃光照培养箱中,24 h统计发芽率,48 h测胚根长度。
种子的快速破眠研究。通过预实验观察发现,鲜黄连种子萌发一共存在3个阶段:1、吸水膨胀阶段;2、内部物质与能量转化阶段;3、萌发生根阶段。其中种子在第2阶段时的外部形态以种皮开裂露出内种皮为表现特征,在第3阶段时的外部形态以胚根突破内种皮为表现特征。
本试验将种子在无菌水中浸泡24 h,种子吸胀后,用酒精棉去掉种毛与颗粒物,之后将种子分别置于100、300、500、700、900 mg·L-1的赤霉素溶液中浸泡48 h,再用质量分数1%次氯酸钠溶液消毒,处理15 min后用无菌水反复冲洗种子,以在清水中浸泡72 h的种子为对照,将所有种子进行湿沙层积处理,沙藏处理A组先在20 ℃环境1个月后转进10 ℃环境,沙藏处理B组一直在恒温10 ℃环境,每个处理30个种子,3次重复。120 d后统计鲜黄连种子的萌发率、外种皮开裂率、霉烂率,拍照记录种子的动态变化。
萌发率=(萌发种子数/供试种子总数)×100%;
外种皮开裂率=(外种皮开裂种子数/供试种子总数)×100%;
发霉率=(发霉种子数/供试种子总数)×100%。
式中:种子萌发以胚根生长为种子长度的1/2为标准;外种皮开裂以外种皮开裂露出内种皮为标准。
试验数据采用EXCEL2018和SPSS20.0进行分析。
2 结果与分析
2.1 种子形态与百粒质量
鲜黄连种子长约(4.392 0±0.094 8)mm,种子粒径约为(1.536 0±0.043 6)mm,百粒质量平均为(0.550 2±0.007 0)g。
种子吸水前为深褐色,呈月牙型,有黄白色种毛。纵切后,种胚为白色线形,胚乳近似透明。种子吸水膨胀后,外种皮颜色变为浅褐色。纵切种子有明显的外种皮、内种皮、胚根鞘等结构,胚乳变为白色。
2.2 种子含水量与吸水曲线测定分析
经测定,鲜黄连干种子的含水量为5.05%。
鲜黄连成熟干种子在前2 h的吸水率呈直线上升的趋势,在2 h时吸水率为87.84%,在2 h后仍在继续吸水,但在24、36、48、60、72 h吸水率均为111.79%,吸水24 h时,种子已达到吸水饱和。鲜黄连种子去种皮困难,但在吸水24 h时吸水率已经达到饱和吸水率时的78.57%,说明种皮并未对种子吸水造成较大影响。按照卡恩理论,种子吸水率达到40%就满足种子萌发的生理需求[10],鲜黄连种子吸水2 h后就达到种子萌发的生理需求,种子透水性好,种子吸胀后种皮变软,表明种子活力较大,有充分吸收水分萌发的可能性,所以种皮的透水性并不是导致萌发困难的主要原因(见图1、2)。

1为干种子形态;2~3为干种子在体视显微镜下形态(3a为种胚,3b为胚乳,3c为种毛);4~6为吸胀种子在体视显微镜下形态(6a为外种皮,6b为内种皮尖部,6c为胚根鞘,6d为内种皮)。
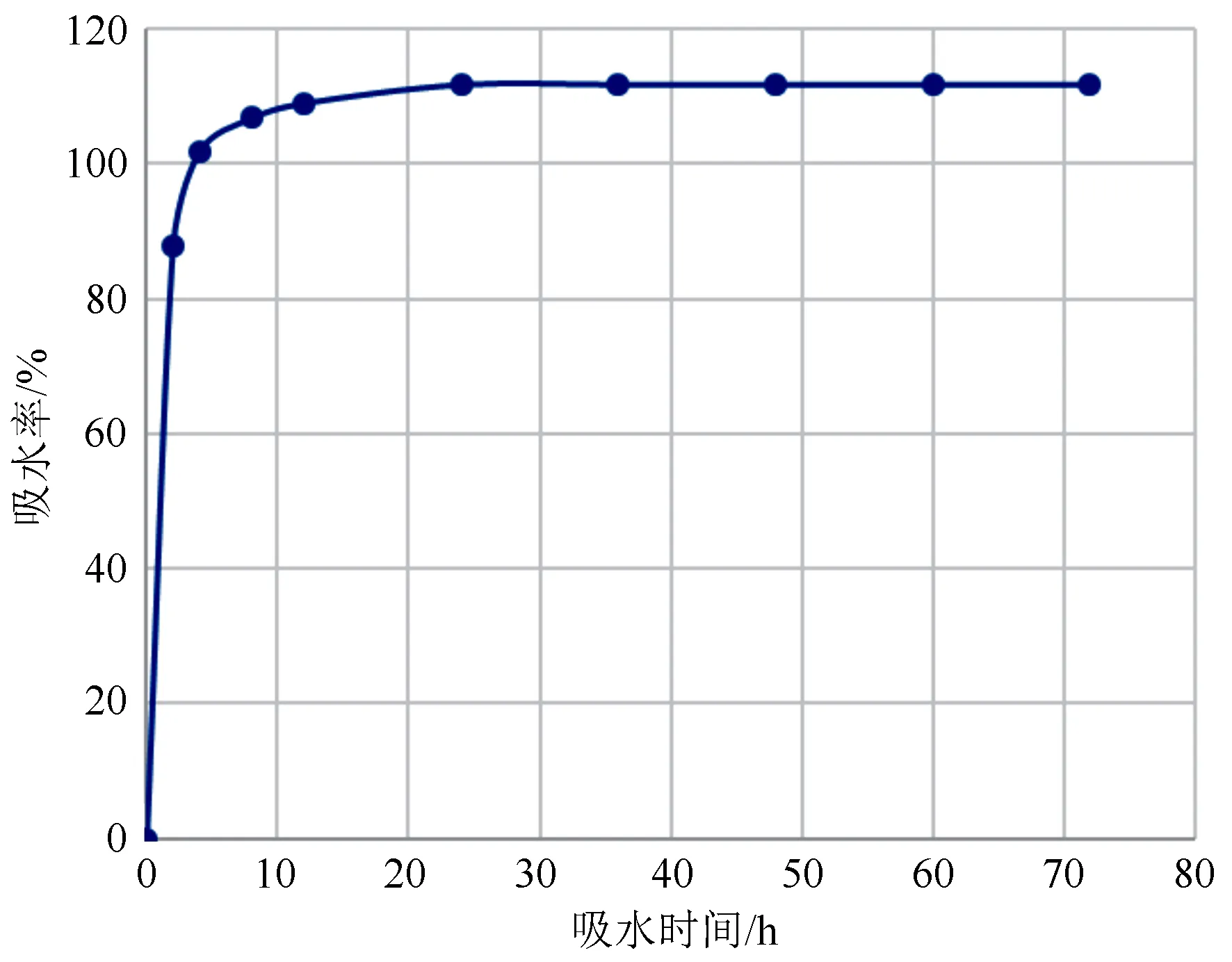
图2 鲜黄连种子吸水曲线图
2.3 种子生活力测定
经测定,鲜黄连种子生活力为95%,但染色深浅程度有差异,说明鲜黄连种子生活力有强弱差异(图3)。

1为TTC染色处理;2为染色成功种子在体视显微镜下形态;3为染色未成功种子在体视显微镜下形态。
2.4 种子萌发抑制物质生物学测定分析
根据白菜种子的发芽率和幼根长度判断鲜黄连种子的浸出液对白菜籽萌发的影响,试验结果如表1所示,所有处理的萌发率与胚根长度均与对照有显著差异,说明各浸提液均对白菜籽萌发造成显著的抑制作用,25和35 ℃的乙醇浸提液与对照组差异最显著,萌发率为0。萌发率除25、35 ℃醇提液之间不存在显著差异外,其余各处理之间存在显著差异,在根长方面各处理之间不存在显著差异。

表1 不同溶液对白菜种子萌发的影响
2.5 不同质量浓度赤霉素溶液浸种后层积对鲜黄连种子的影响
由试验结果表2可知,在沙藏总天数达到120 d时,处理A或B组中,种子萌发率随着赤霉素质量浓度的增加呈先升高后降低的特点。在处理A组中,除了900 mg·L-1赤霉素浸种外,其余处理均与对照有显著性差异;在处理B组中,除了300与500 mg·L-1赤霉素浸种外,其余处理均与对照无显著性差异。对照组中没有种子达到萌发的第3阶段,说明在120 d内无赤霉素浸种直接沙藏处理不能起到使种子萌发生根的作用。种子在赤霉素质量浓度100~700 mg·L-1下可以萌发长出胚根,在500 mg·L-1萌发率达到最高,与对照相比差异最显著,在A、B两组中的萌发率分别是31.11%、18.89%,虽然两处理的萌发率较为接近,但是萌发种子的胚根长度存在着明显差异(图4)。

1为处理A组赤霉素500 mg·L-1沙藏120 d效果;2为处理B组赤霉素500 mg·L-1沙藏120 d效果;3为外种皮开裂,露出内种皮尖部;4为胚根突破内种皮;5为沙藏脱壳种子,5a为子叶,5b为真叶叶芽,5c为胚轴,5d为胚根;6为5b真叶叶芽在体视显微镜下放大形态。
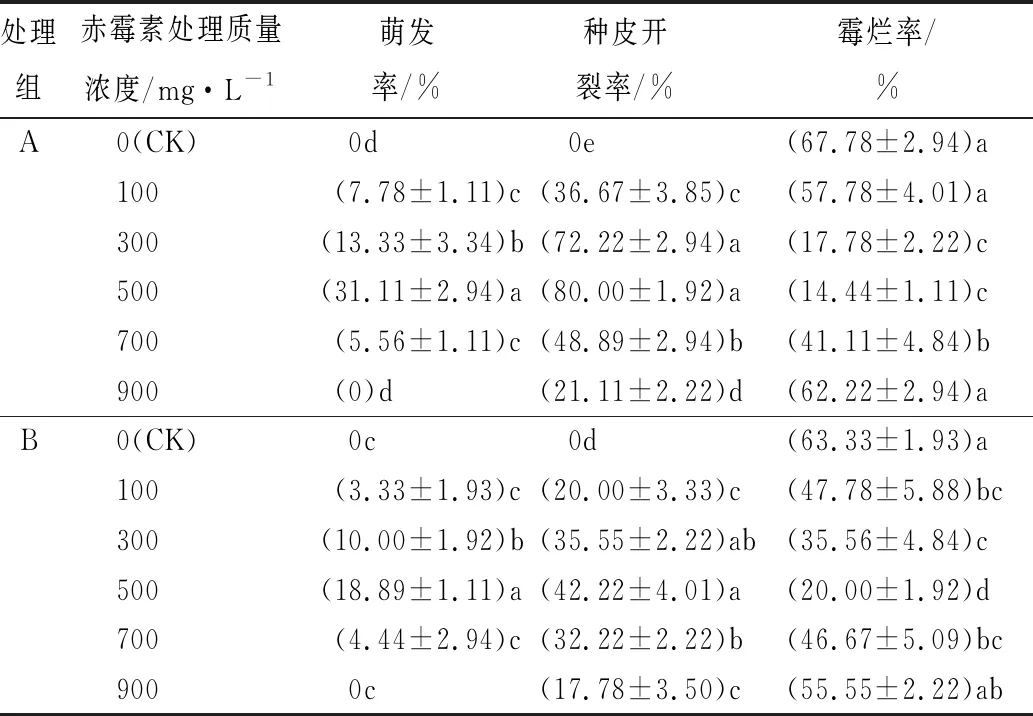
表2 处理A、B组对鲜黄连种子的影响
外种皮开裂率随着赤霉素质量浓度的增加呈先升高后降低的特点,在处理A、B两组中,所有处理组均与对照组有显著性差异,对照组中没有种子外种皮开裂,说明在120 d内,无赤霉素浸种直接沙藏处理不能使种子达到萌发的第2阶段。在赤霉素质量浓度100~900 mg·L-1下,均有种皮开裂,在500 mg·L-1种皮开裂率达到最高,A与B组的萌发率分别是80.00%、42.22%,说明鲜黄连种子在两组处理中最合适的赤霉素质量浓度均为500 mg·L-1。
鲜黄连种子发霉率呈现先降低再升高的趋势。处理A组中,只有300、500、700 mg·L-1赤霉素浸种处理与对照组有显著性差异;处理B组中,除了900 mg·L-1赤霉素浸种外,其余处理均与对照无显著性差异。A与B组的对照霉烂率均为其组内最高。低质量浓度赤霉素对种子萌发有正向作用,增加了种子活力,一定程度上减少了霉烂率,在赤霉素溶液为500 mg·L-1时达到霉烂率最低,高质量浓度的赤霉素可能对种子产生了毒害作用,对种子活力产生了一定的负面抑制作用,导致霉烂。
对比A与B组处理,可以发现,A组的种子在萌发率、外种皮开裂率、霉烂率方面,效果优于B组。所以,对于鲜黄连种子萌发效果最好的方法为:赤霉素质量浓度为500 mg·L-1浸种后进行湿沙层积,先放入20 ℃环境(30 d)后10 ℃环境(90 d),萌发率31.11%,外种皮开裂率80.00%,霉烂率14.44%。
鲜黄连种子萌发一共有3个阶段:1、吸水萌动阶段2、内部物质与能量转化阶段3、胚根突破种皮阶段。种子萌发是从吸水膨胀开始的,由弱到强的进行一系列生理活动[11],以赤霉素质量浓度500 mg·L-1沙藏处理为例,在干种子吸水后,种子有明显的膨胀,此阶段为鲜黄连种子萌发的第一阶段。之后种子进入内部物质与能量转化阶段,在赤霉素沙藏过程中,种子发生的一系列生理生化变化,可概括为大分子贮藏物质进行降解转化为可溶性的各种可为胚的代谢、生长过程所利用的物质。在层积处理初期,伴随水解过程各种水解酶、过氧化氢酶、过氧化物酶的活性显著增强,还原糖及其他可溶性糖和氨基酸等大量增加,为种子呼吸代谢提供底物和能量,种子的呼吸与代谢作用增强[12]。在种子外部的形态变化是种孔处先伸出黑色的内种皮尖部结构,然后外种皮从种孔部位逐渐开裂,内种皮结构露出更加明显,即从沙藏开始到明显出现第二阶段外部特征,至少需要沙藏处理60 d。在沙藏时间达到120 d时,部分种子的胚根已突破内种皮,内种皮开裂后胚根向外生长,胚根突破内种皮向外生长为鲜黄连种子萌发第三阶段特征。胚根生长到达一定长度后,外种皮容易脱落,露出子叶,两个子叶的基部处可以在体式显微镜下观察到有鲜黄连真叶形状的叶芽存在(图4)。
3 结论与讨论
种子的休眠与萌发特性是植物在长期适应过程中所形成的重要特征之一,了解其休眠类型与萌发特性,对于鲜黄连的资源保护与栽培引种极为重要[13]。根据国际通用的种子休眠分类系统,种子常见的休眠类型一共有5种:物理休眠、生理休眠、形态休眠、复合休眠和形态生理休眠[14],其中形态生理休眠类型的种子由于未分化或发育不完全,具有生理休眠与形态休眠的双重性,其种胚一般为线型、匙形或球形[15]。在体视显微镜下,观察到鲜黄连种子有线形胚,符合形态生理休眠种子的形态特征,所以从解剖形态上判断得出,鲜黄连种子属于形态生理休眠类型,种子需要适宜的高温环境或赤霉素浸种处理中完成胚胎发育,具有完全发育的胚胎种子在低温层积处理才可以萌发,这与Rhie et al.[7]研究得出了一致结论。
本实验通过对研究鲜黄连种子在25、35、45 ℃温度下的水提液和醇提液对白菜籽萌发的影响发现,各处理均对白菜籽萌发有显著抑制作用。以蒸馏水为提取媒介,35 ℃水提液的抑制效果最强,以80%乙醇为提取媒介,25和35 ℃的醇提液的抑制效果最强,对应的白菜籽萌发率0,与35 ℃水提液效果存在显著差异。各处理的浸提液对白菜种子胚根长度均造成了抑制作用,与对照差异显著,这表明其种子内部存在萌发抑制物质,也是造成鲜黄连种子休眠的原因之一。但由于鲜黄连种皮和胚较难剥离,所以无法判断种皮和种胚是否均含有萌发抑制物质,以及种类和数量的差异。
种子休眠主要由种皮障碍、胚发育状况和内源性发芽抑制物质3方面原因引起[16],鲜黄连种皮虽较难去除,但吸水后种皮变软,质地并不坚硬难以突破,综上分析认为,鲜黄连种子休眠主要是种胚发育不完全和种子含有萌发抑制物质而引起的形态生理休眠,这与紫斑牡丹种子[17]、双核冬青种子[18]、顶冰花种子[19]休眠原因类似。
赤霉素是一种应用及研究上常用的植物激素,它能促进细胞延长和分裂,因此对具有休眠特性的种子,生产实践中通常选用赤霉素作为打破休眠的激素,促进种子萌发[20]。在预实验中重复Rhie et al.[7]的最佳实验处理方法,用质量浓度为1 000 mg·L-1的赤霉素溶液浸种后在15和6 ℃各12 h的变温条件层积,5个月仍不能使鲜黄连种子萌发,没有获得与其实验结果相近的结果,存在较大差距,造成这种现象的原因可能与实验时的光照、温湿度、沙藏所用沙子、层积控温仪器、取材地点、采种植株年龄、种子成熟度、种子贮藏方式、消毒方法不同等都有关系,具体是由于哪一个条件的差异导致,还有待进一步研究。
Rhie et al.[7]的研究认为鲜黄连种子属于深度简单形态生理休眠,其休眠的打破在自然环境中需要先经过夏、秋季温度暖层积和冬季冷层积,而赤霉素可以代替暖层积促进鲜黄连种胚的生长,但不能代替冷层积促使胚根突破种皮[7]。根据B组实验结果,适宜质量浓度的赤霉素溶液浸种后,鲜黄连种子可以萌发,无赤霉素浸种处理的种子不能萌发,说明种子在10 ℃低温沙藏前赤霉素处理的必要性,适宜赤霉素溶液浸种,可以促进种子完成生理后熟,代替自然条件中的夏季高温和秋季高温,这与Rhie et al.[7]的研究结论相同。但是在实验A组中,除900 mg·L-1之外,各赤霉素质量浓度下的萌发效果优于实验B组,说明在恒温层积时,赤霉素浸种并不能完全代替自然条件夏秋季高温的作用,赤霉素浸种后再进行暖、冷层积,可以使种子在人工恒温环境下的萌发效果更佳。
赤霉素质量浓度不够或超过适宜质量浓度,即种子感受性低或遭受逆境,都不足以使种子发芽[21],随着赤霉素浸种时的质量浓度变化,鲜黄连种子萌发效果呈现出低质量浓度促进高质量浓度抑制的趋势,这种与多叶棘豆种子[22]、铜钱树种子[23]、顶果木种子[24]的相关研究得出一致结论。根据实地观察发现,鲜黄连种子在第一年5月末至6月初成熟,第2年4月地上部分才长出种苗,至少需要10个月的时间,本试验中,用赤霉素质量浓度为500 mg·L-1浸种,先暖层积30 d后冷层积90 d共120 d后,鲜黄连种子的萌发率最高可以达到31.11%,加上后期入盆栽20 d,整体上相较于自然环境下种子出苗缩短了近5个月的时间。该结果可为鲜黄连的人工化种植奠定理论基础,也为同属二叶鲜黄连种子萌发研究提供一定的指导与借鉴。但该方法下种子萌发率仍然较低,搭配其他激素与赤霉素一起浸种或改变温度条件,是否会进一步提高鲜黄连种子萌发率,还有待深入研究。
鲜黄连外种皮较难去除,但从鲜黄连种子吸水曲线可以看出,即使是在不去除其外种皮的情况下,种子有较高的吸水速率,说明外种皮并不会影响水分渗透进而影响种子活力。经过TTC染色,供试鲜黄连种子生活力为95%,但是染色的颜色深浅程度存在差异,说明各种子之间的生活力强弱存在差异。层积实验中的对照组、赤霉素100 mg·L-1与900 mg·L-1浸种处理组霉烂率均较高,最高达66.7%,这说明种子霉烂可能也与种子自身活力不足有关。Rhie的快速破眠方法霉烂率较低,可能其方法为变温沙藏,更有利于提高种子活性,从而降低了霉烂率。另外,长时间不发芽也会导致种子霉烂[23],鲜黄连种子萌发的确需要较长时间的层积处理,这也可能是导致鲜黄连种子霉烂率增高的原因之一。
对不同发芽程度的供试种子进行移栽实验,观察发现,萌发但未脱壳种子均未能长出叶,不能成活,与铜钱树种子出现相似状况[23],所以建议待种子完全脱壳后再进行移栽。萌发脱壳种子入土栽培20~30 d可以长出叶,但可能环境不适宜种子生长,种苗出现叶柄细长徒长现象,最终死亡。所以,萌发种子的栽培方法与环境条件,还有待于进一步的实验与探索。

