仁扇舟蛾幼虫肠道细菌多样性1)
于晓航 朱晗 陈宏健 魏原芝 周杨 郝德君
(南京林业大学,南京,210037)
昆虫作为动物界最为繁盛的类群,种类繁多,形态各异[1]。其中鳞翅目作为昆虫纲第二大目,数量约占昆虫总数的16%,包括多种危害严重的农、林业害虫[2]。近年来,随着现代分子生物学技术在肠道微生态学上的应用,国内外对鳞翅目昆虫肠道菌群的研究也日益增加[3-4]。研究表明,鳞翅目昆虫肠道菌群可以协助代谢,吸收利用营养物质以增强宿主的环境适应性。在以甘蔗为食的小蔗杆草螟(Diatraeasaccharalis)的肠道中可以分离出能够水解纤维素类化合物的细菌[5]。肠道菌还能降解杀虫剂、植物有毒次生代谢物,如小菜蛾(Plutellaxylostella)肠道中的蜡状芽孢杆菌(Bacilluscereus)能够降解杀虫剂茚虫威[6],舞毒蛾(Lymantriadispar)肠道中的不动杆菌属(Acinetobacter)细菌能够降解杨树中的酚苷类化合物[7]。此外,肠道菌还能抵御外来病原的入侵和定殖,提高宿主免疫反应[8],如海灰翅夜蛾(Spodopteralittoralis)肠道中定殖的蒙氏肠球菌能够分泌细菌素,抑制肠球菌属几种潜在病原菌的定殖[9]。
由于昆虫肠道的结构和理化环境独特,导致肠道细菌群落复杂、功能多样[10]。因此,研究昆虫肠道细菌群落结构及其功能,为探究昆虫与共生细菌相互适应、协同进化、物种分化,以及在宿主免疫及代谢机制等方面具有重要理论价值,同时也对阐明农林重要害虫的致病机理,探索应用肠道细菌的害虫防治新技术有重要的指导意义[11-12]。
仁扇舟蛾(Closterarestitura)属鳞翅目(Lepidoptera)舟蛾科(Notodontidae)扇舟蛾属(Clostera),为柳属(Salix)、杨属(Populus)植物的主要食叶害虫。主要分布于我国长江流域以南地区,国外分布于印度、越南、马来西亚、印度尼西亚等国家[13-14]。仁扇舟蛾具有取食量大、繁殖力强、幼虫孵化率高、世代周期短等特点,危害严重时可迅速将整株叶片取食干净,影响寄主植物的光合作用,进而导致树木生长缓慢,甚至死亡[15]。仁扇舟蛾与寄主杨树互作关系的研究表明,外源施用茉莉酸甲酯(MeJA)可以诱导寄主杨树营养物质及次生代谢物质的变化,降低仁扇舟蛾生长速率,延长幼虫和蛹的发育历期。幼虫取食MeJA处理的叶片后,诱导谷胱甘肽S-转移酶(GST)、羧酸酯酶(CarE)等解毒酶的产生[16]。在其他舟蛾科食叶害虫与寄主植物互作研究中发现,昆虫的取食危害能够诱导寄主植物的防御反应[17-18]。然而,肠道细菌在取食杨树的舟蛾类食叶害虫与寄主植物相互关系中的调控作用尚未见研究报道。因此,本研究以仁扇舟蛾作为研究对象,通过高通量测序技术分析仁扇舟蛾幼虫前、中、后肠细菌群落结构的多样性,为后续研究共生细菌在调控仁扇舟蛾与寄主植物互作关系中的作用奠定基础。
1 材料与方法
1.1 供试虫源
仁扇舟蛾2~3龄幼虫采自南京市浦口区乌江镇(118°52′E,31°89′N)杨树行道树,带回实验室后置于昼夜光周期比为14∶10,温度(25±2)℃,相对湿度为(65±5)%的条件下饲养,喂食新鲜的杨树叶片,每日更换1次。以实验室饲养的第2代5龄幼虫作为供试昆虫。
1.2 肠道解剖及细菌总DNA提取
选取50头健康的5龄幼虫,饥饿处理12 h后,用PBS缓冲液冲洗虫体表面多次,置于体积分数为75%酒精中体表消毒3 min,并用无菌水漂洗3次。无菌条件下解剖肠道,将分离的前、中、后肠分别置于2 mL离心管中,5个重复。用细菌基因组DNA提取试剂盒(艾科瑞生物工程有限公司)分别提取前、中、后肠细菌总DNA,采用超微分光光度计(Nanodrop 2000C)测定DNA质量浓度,然后用2%琼脂糖凝胶电泳检测提取质量。
1.3 肠道细菌16S rDNA高通量测序
以提取的细菌总DNA为模板,采用16S rDNA基因V4区引物(515F:5’-GTGCCAGCMGCCGCGGTAA-3’,806R:5’-GGACTACHVGGGTWTCTAAT-3’)扩增仁扇舟蛾肠道细菌序列。用Phusion®High-Fidelity PCR Master Mix with GC Buffer进行PCR扩增。PCR反应体系为30 μL:Phusion Master Mix(2×)15.0 μL,gDNA(1 ng·μL-1)10.0 μL,Primer 515F(2 μM)和Primer 806R(2 μM)各1.5 μL,ddH2O 2 μL。PCR反应条件为98 ℃预变性1 min;98 ℃变性10 s;50 ℃退火30 s;72 ℃复性30 s,30个循环;72 ℃延伸5 min,4 ℃保存。用2%的琼脂糖凝胶电泳检测PCR产物,选择主条带大小在400~450 bp的序列进行切胶回收。利用GeneJET胶回收试剂盒对PCR产物进行纯化。用NEB Next®UltraTMDNA Library Prep Kit for Illumina建库试剂盒构建文库,同时进行Qubit定量分析及文库检测,样品检测合格后,利用HiSeq测序平台进行测序。
1.4 序列数据获取
使用FLASH软件对样品的读长片段进行拼接,即获得原始标签数据,过滤处理得到高质量的标签数据。参照Qiime的标签质控操作,过滤尾部质量值20以下的碱基,进一步过滤长度小于75%的标签数据,利用UCHIME算法及Gold数据库进行比对,检测标签序列中的嵌合体序列,去除嵌合体序列,即可得到试验所需的有效数据。利用Uparse软件(Version 7.0.1090)对仁扇舟蛾幼虫样品的有效序列进行聚类分析,以97%的一致性将序列聚类成为OTUs,同时选出OTUs的代表性序列。
根据RDP Classifier(Version 2.11)及Green Gene数据库对OTUs代表序列进行物种注释(设定阈值为0.8~1.0),并分别在门,纲,目,科,属分类水平上统计各肠段的群落组成。
1.5 肠道细菌群落多样性计算方法
α多样性反映细菌群落的丰度、多样性,通过Qiime软件(Version 1.9.1)计算群落丰富度指数(Chao1指数、Ace指数)、群落多样性指数(Shannon指数)、群落覆盖度指数(Coverage指数)。使用R软件(Version 2.15.3)绘制稀释曲线。β多样性分析样本间群落结构的相似性及差异性。根据样品的物种注释结果和OTUs丰度信息,将相同分类的OTUs信息合并处理得到物种丰度信息表,然后依据OTUs之间的系统发生关系,利用Qiime软件计算Weighted Unifrac距离,构建UPGMA样品聚类树。使用R软件进行PCoA分析及作图。使用LEfSe找出不同样本间具有显著性差异的群落、物种,根据线性判别分析(LDA=4)估算每个物种丰度对差异效果影响的大小。
2 结果与分析
2.1 仁扇舟蛾肠道细菌16S rDNA序列拼接与组装
从仁扇舟蛾5龄幼虫前、中、后肠15个样品中共获得125494条高质量的细菌16S rDNA序列,按97%的相似度进行OTU聚类(表1),根据OTUs的注释,结果显示,共注释到26个门,78个纲,142个目,267个科,392个属。
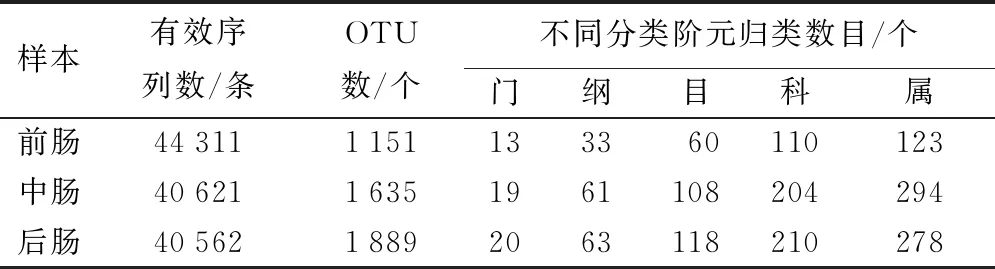
表1 仁扇舟蛾肠道细菌16S rDNA序列分析
2.2 仁扇舟蛾幼虫前、中、后肠细菌种类
仁扇舟蛾幼虫肠道主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、蓝细菌门(Cyanobacteria)细菌构成。其中,前肠细菌的优势门为变形菌门、蓝细菌门;中肠细菌的优势门为变形菌门、厚壁菌门、拟杆菌门、放线菌门;后肠细菌的优势门为变形菌门、拟杆菌门、厚壁菌门。
前、中、后肠细菌菌群在目水平的种类及丰度见图1。可以看出前肠丰度较高的目为肠杆菌目(Enterobacteriales)、链形植物目(Streptophyta)、立克次氏体目(Rickettsiales);中肠为芽孢杆菌目(Bacillales)、交替单胞菌目(Alteromonadales)、酸微菌目(Acidimicrobiales)、伯克氏菌目(Burkholderiales)、拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、红杆菌目(Rhodobacterales)、螺菌目(Oceanospirillales)、Solirubrobacterales、乳酸杆菌目(Lactobacillales)、疣微菌目(Verrucomicrobiales)、放线菌目(Actinomycetales)、脱硫弧菌目(Desulfovibrionales)、盖勒氏菌目(Gaiellales);后肠丰度较高的目为黄杆菌目(Flavobacteriales)、根瘤菌目(Rhizobiales)、假单胞菌目(Pseudomonadales)、红螺菌目(Rhodospirillales)、黏球菌目(Myxococcales)、黄单胞菌目(Xanthomonadales)、噬纤维菌目(Cytophagales)、硫发菌目(Thiotrichales)、脱硫杆菌目(Desulfobacterales)、硝化螺旋菌目(Nitrospirales)、嗜氢菌目(Hydrogenophilales)、着色菌目(Chromatiales)、除硫单胞菌目(Desulfuromonadales)。

图中左侧为物种聚类树;上方为样品组间聚类树;下方为样品信息;右侧为物种注释信息;右侧图例为门水平注释信息,图中颜色变化代表物种在不同样本中的丰度变化情况,红色表示高丰度;蓝色表示低丰度。
由图2可知,在属水平上,前肠细菌的菌群主要有链形植物(Streptophyta,52.78%)、Mitochoncdria(9.98%)、肠杆菌属(Enterobacter,9.88%)、盐单胞菌属(Halomonas,6.22%)、毛螺旋菌属(Lachnospira,1.84%)、希瓦氏菌属(Shewanella,1.52%)、拟杆菌属(Bacteroides,1.20%);中肠细菌的菌群主要有盐单胞菌属(18.34%)、Streptophyta(8.42%)、肠杆菌属(6.44%)、希瓦氏菌属(5.00%)、拟杆菌属(4.80%)、毛螺旋菌属(4.26%)、不动杆菌属(Acinetobacter,4.00%)、芽孢杆菌属(Bacillus,2.70%)、节杆菌属(Arthrobacter,2.02%)、S24-7(1.82%)、罗斯氏菌属(Roseburia,1.10%)、颤螺旋菌属(Oscillospira,1.06%)、假单胞菌属(pseudomonas,1.02%);后肠细菌的主要的菌群为假单孢菌属(10.88%)、Streptophyta(10.08%)、盐单胞菌属(5.72%)、肠杆菌属(4.26%)、希瓦氏菌属(1.96%)、芽孢杆菌属(1.40%)、毛螺旋菌属(1.26%)、Sphingopyxis(1.32%)。

圆圈中不同颜色表示不同的肠段,对应左侧图例;扇形大小表示在此分类水平该细菌在不同肠段的相对丰度大小;分类名称下方的数字表示在该分类水平的平均相对丰度百分率,前者表示占所有物种的百分率,后者表示占所选取物种的百分率。
2.3 仁扇舟蛾幼虫肠道细菌α多样性
仁扇舟蛾前、中、后肠样本的Shannon指数随着测序深度的增加,数值皆趋于平缓(表2),且各样品的覆盖度都在97%以上(表3),表明测序数据足够,可以反映群落多样性。
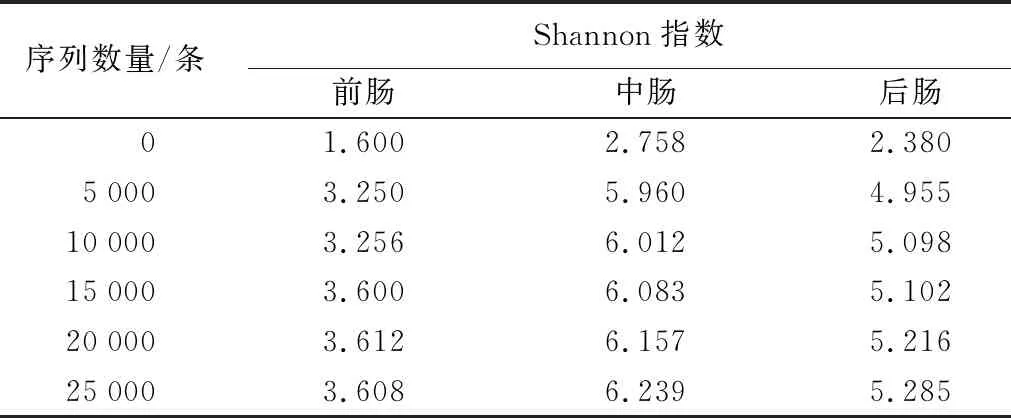
表2 仁扇舟蛾肠道细菌Shannon指数
α多样性反映样本中细菌群落的物种多样性及丰富度。Shannon指数反映群落的多样性,Shannon指数数值越大,说明群落多样性越高;Chao1指数、Ace指数反映样品中群落的丰富度,两者数值越大,表明群落丰富度越高。由表3可知,中肠的Shannon指数最高,后肠次之,前肠最低,表明中肠细菌的物种多样性最高,前肠最低。对于Chao1指数、Ace指数,后肠最高,中肠次之,前肠最低,表明后肠的丰富度最高,中肠次之,前肠最低。

表3 仁扇舟蛾肠道细菌α多样性指数
2.4 仁扇舟蛾肠道细菌β多样性
β多样性反映不同样本间群落结构的相似性及差异性。通过样本层级聚类分析研究不同样本间细菌群落组成的相似性。运用Weighted Unifrac距离矩阵,对仁扇舟蛾幼虫前、中、后肠样本进行聚类分析,构建聚类树。从图3可以看出,仁扇舟蛾幼虫不同肠段细菌群落结构物种组成相似,但丰度不同,其中中肠、后肠的细菌群落结构差异较小。

图3 仁扇舟蛾肠道细菌Weighted Unifrac UPGMA聚类树
通过PCoA主坐标分析样品间群落结构的差异。根据Weighted Unifrac距离算法进行PCoA主坐标分析。由图4可知,主坐标轴PC1、PC2的解释度分别为57.3%、20.21%。从图中各样本的分布可以看出,仁扇舟蛾幼虫前、中、后肠不同肠段间细菌群落结构存在差异,不同肠段样本点聚在一起。后肠H1与其他4个样品相似度偏低,前肠F4、F5与其他3个样品相似度也偏低。

图4 仁扇舟蛾肠道细菌Weighted Unifrac PCoA图
2.5 仁扇舟蛾肠道细菌不同分类水平的差异菌群比较
为确定仁扇舟蛾前、中、后肠不同样本中的特定细菌群落,使用LEfSe差异分析检测具有显著丰度差异的类群,采用线性判别分析(LDA=4)估算每个物种丰度对差异效果影响的大小。结果如图5所示,中肠的差异菌群最多,有放线菌门、放线菌纲、放线菌目、微球菌科(Micrococcaceae);拟杆菌纲(Bacteroidia)、拟杆菌目、拟杆菌科(Bacteroidaceae);厚壁菌门、芽孢杆菌纲(Bacilli)、芽孢杆菌目、芽孢杆菌科(Bacillaceae);梭菌纲(Clostridia)、梭菌目、毛螺菌科(Lachnospiraceae)、疣微菌科(Ruminococcaceae);交替单胞菌目、希瓦氏菌科(Shewanellaceae);螺菌目、盐单胞菌科(Halomonadaceae);莫拉氏菌科(Moraxellaceae)。前肠差异菌群有蓝细菌门、叶绿体、链形植物目(Streptophyta);立克次氏体目。后肠差异菌群为δ-变形菌纲(Deltaproteobacteria);假单胞菌目、假单胞菌科(Pseudomonadaceae)。
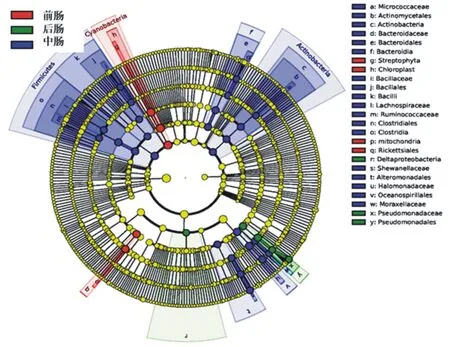
图中由内至外的圆圈代表由门至种的分类级别,在不同分类级别的每一个小圆圈代表该水平下的1个分类;小圆圈直径大小与相对丰度大小呈正比,黄色表示无显著差异的物种,红色、蓝色、绿色节点分别表示在前肠、中肠、后肠样本中具有显著差异的物种。
3 结论与讨论
随着分子生物学技术的发展,基因序列分析技术等方法被广泛引入到肠道微生物学的研究中[19-20],其中16S rDNA序列以及宏基因组测序技术的发展极大地促进共生微生物群落结构及其组成的测定、功能基因的筛选及共生微生物与宿主相互关系等方面的研究[21-22]。
本研究根据Illumina HiSeq技术对仁扇舟蛾5龄幼虫前、中、后肠细菌进行高通量测序,发现其优势菌门有变形菌门、厚壁菌门、拟杆菌门、放线菌门。在鳞翅目昆虫肠道菌群的相关研究中,大多数细菌都属于变形菌门、厚壁菌门、放线菌门[4]。夜蛾科肠道菌群以变形菌门、厚壁菌门、放线菌门为主[23];舞毒蛾中肠菌群为γ-变形菌门、α-变形菌门、放线菌门、拟杆菌门细菌[24];家蚕(Bombyxmori)肠道优势菌门主要是厚壁菌门、变形菌门[25];同为舟蛾科的栎黄掌舟蛾(Phaleraassimilis)肠道优势菌群也以变形菌门、厚壁菌门为主[26]。在门水平上,仁扇舟蛾前、中、后肠的优势菌群在组成上基本一致,但丰度具有一定的差异。在前肠中发现大量的蓝细菌门、叶绿体的序列,推测原因是仁扇舟蛾肠道内残存了破碎的植物组织,而植物细胞内的叶绿体核酸能够被细菌16S rDNA基因通用引物扩增,形成大量蓝细菌门微生物序列,此问题在植食性昆虫肠道菌群研究中十分普遍[27],故在分析仁扇舟蛾肠道细菌群落结构时,应排除蓝细菌门的影响。在目水平上,中肠、后肠的优势菌目较为丰富,而前肠的优势菌目较少。在属水平上,各肠段的优势属组成、丰度有所差异。肠杆菌属在前肠(9.88%)、中肠(6.44%)、后肠(4.26%)的丰度逐渐降低;盐单胞菌属在中肠的丰度最高,占18.34%,前肠(6.22%)、后肠(5.72%)的丰度较低;毛螺旋菌属、希瓦氏菌属在中肠的丰度最高,前肠、后肠的丰度较低;拟杆菌属只在前肠及中肠中存在,丰度由前肠的1.20%增至中肠的4.80%;芽孢杆菌属、假单胞菌属只在中肠及后肠发现,其中,假单孢菌属丰度从中肠的1.02%增至后肠的10.88%,为后肠的绝对优势属;芽孢杆菌属在中肠(2.70%)、后肠(1.40%)的丰度差异较小。中肠还注释到不动杆菌属、节杆菌属、罗斯氏菌属、颤螺旋菌属细菌,其丰度分别为4.00%、2.02%、1.10%、1.06%。由此可知,各优势菌属在不同肠段的丰度有所不同,其中,前肠的优势菌属种类较少,而中肠优势菌属的种类较为丰富。在鳞翅目海灰翅夜蛾肠道菌群研究中,各肠段的物种组成也不同,前肠以蒙氏肠球菌(Enterococcusmundtii)为主,中肠则为梭菌属(Clostridium)为主,后肠的菌落组成较均匀,主要是蒙氏肠球菌、梭菌及酪黄肠球菌(Enterococcuscasseliflavus)[9]。这种差异推测是由于肠道不同部位的pH、氧分压等条件不同造成的。
仁扇舟蛾中肠、后肠的细菌种类较为丰富且群落结构相似性较高,而前肠物种多样性、丰富度均最低。LEfSe差异分析所示,中肠的差异菌群种类最多,主要为放线菌门、厚壁菌门的细菌。从仁扇舟蛾幼虫肠道的形态学特征分析,前肠是食物进入肠腔的通道,作为食物临时储存的场所;中肠直径较大,肠腔大,食物停留的时间较长,是消化、吸收的主要场所;后肠呈光滑均匀的细长管状,主要用于排泄食物残渣,同时也用于水分及营养的重吸收[10,28]。因此,中肠、后肠的菌群多样性、丰富度高于前肠,而中肠作为食物消化及吸收的主要场所,菌群多样性较高,差异菌群也较多。
植物基于自我保护的目的,能够产生对植食性昆虫有毒的次级代谢产物,然而以这些植物为食的昆虫却不受影响。最近有研究表明,肠道菌群可以协助宿主降解植物中有毒的次级代谢产物。节杆菌属、芽孢杆菌属、假单胞菌属细菌均可降解单宁[29]。不动杆菌属细菌能够降解杨树分泌的酚苷类化合物[7]。肠道菌群还能降解食物中的难消化成分,研究表明肠杆菌属、假单胞菌属、芽孢杆菌属、肠球菌属细菌能够水解纤维素[5,30-31]。杨树叶片中含有丰富的单宁[32],仁扇舟蛾作为杨树重要的食叶害虫,研究仁扇舟蛾肠道中的细菌可以在食物利用及克服植物次生代谢物质等方面发挥作用。
本研究结果初步探究了仁扇舟蛾幼虫肠道细菌群落结构组成,发现仁扇舟蛾幼虫的前、中、后肠多样性存在差异,肠道细菌在提高宿主昆虫对环境的适应性上发挥作用。本研究为进一步研究昆虫与其共生菌群之间的复杂关系,探索新的害虫防治方法提供了参考。

