纳米鱼骨对鲢鱼肌球蛋白凝胶性能的影响
时浩楠,张梦玲,张 晋,尹 涛,胡 杨,尤 娟,熊善柏,刘 茹
(华中农业大学食品科学技术学院,国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
鱼骨是鱼片和鱼糜等水产品加工过程中产生的主要固体副产物之一,每100 g鱼中含有10~15 g鱼骨[1-2]。鱼骨中钙含量丰富,营养价值和生物利用率高[3],是优质的天然钙源。但目前鱼骨主要被用于生产鱼骨粉、低价饲料等[4],或直接作为下脚料丢弃[5],并未得到充分利用。鱼糜凝胶制品因其食用方便、美味可口而深受消费者欢迎[6]。肌球蛋白是鱼糜形成凝胶最重要的功能性蛋白,加热可使肌球蛋白变性,暴露的活性基团间相互作用形成凝胶网络结构[7-8]。有研究表明,将鱼骨尺寸降低至微米级能显著提高鱼骨的生物利用率、释放率和溶解度等[9-10],释放出的钙离子还能激活鱼内源性转谷氨酰胺酶,进而促进肌球蛋白间的共价交联,提高鱼糜的凝胶强度[11-12]。纳米鱼骨(nano-scaled fish bone,NFB)对内源性转谷氨酰胺酶激活能力低于CaCl2,但对鱼糜凝胶性能的增强效果却优于CaCl2[2],说明加入NFB能够增强凝胶性能不仅与Ca2+有关,还可能与NFB的鱼骨尺寸有关。NFB安全无毒且生物利用率显著高于微米鱼骨(micro-scaled fish bone,MFB)[13-14],因此,比较研究MFB和NFB对肌球蛋白凝胶特性的影响对鱼骨的高值化利用具有重要意义。
本实验以鲢鱼骨为原料制成NFB、MFB,并以CaCl2为对照,比较研究不同钙源作用下肌球蛋白的静态流变学性能、动态流变学性能,并结合肌球蛋白在加热过程中蛋白质构象变化及分子间相互作用,探讨不同钙源对肌球蛋白凝胶特性的影响,为将鱼骨应用于鱼糜制品生产提供理论依据。
1 材料与方法
1.1 材料与试剂
鲢鱼(每条体质量1 000~1 500 g)购自华中农业大学菜市场。使用采肉机分离出鱼骨,经一次冰水漂洗后,于-18 ℃保存,提取肌球蛋白的原料为当天购买的新鲜鲢鱼肉。
牛血清白蛋白、三羧甲基氨基甲烷(Tris)(均为分析纯) 美国Sigma Aldrich公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)(分析纯)阿拉丁试剂(上海)有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
1750型紫外-可见光分光光度计、RF-5301型荧光光谱仪 日本岛津公司;Avanti J-26 XP高速冷冻离心机美国Beckman Coulter公司;AR2000ex型动态流变仪美国TA公司;MKCA6-2骨泥机 日本Masuko公司。
1.3 方法
1.3.1 肌球蛋白提取及蛋白质质量浓度测定
参考Park等[15]的方法并稍作修改,僵直前的鲢鱼脊背肉用食品调理机绞碎,加入10 倍体积含0.1 mol/L KCl、质量分数0.02% NaN3和20 mmol/L Tris-HCl的缓冲液(pH 7.5),均质1~2 min。均质液于4 ℃下放置15 min后8 000 r/min离心5 min,去除上清液,将沉淀悬浮于5 倍体积含0.45 mol/L KCl-20 mmol/L Tris-HCl缓冲液(pH 6.8,含5 mmol/Lβ-巯基乙醇、0.2 mol/L Mg2CO3、1 mmol/L乙二醇双(2-氨基乙基醚)四乙酸)中,同时加入ATP-Na2使肌球蛋白与肌动蛋白解离,ATP-Na2的终浓度控制为5 mmol/L。于4 ℃下放置1 h后,10 000 r/min离心10 min,用10 倍体积1 mmol/L KHCO3稀释上清液,于4 ℃下放置15 min,然后12 000 r/min离心10 min。沉淀重新用2.5 倍体积含0.5 mol/L KCl和5 mmol/Lβ-巯基乙醇的20 mmol/L Tris-HCl缓冲液(pH 7.5)悬浮,于4 ℃下放置15 min,再用2.5 倍体积的1 mmol/L KHCO3稀释并加MgCl2至终浓度为10 mmol/L,于4 ℃下放置过夜,然后12 000 r/min离心15 min,所得沉淀溶于0.5 mol/L NaCl-20 mmol/L Tris-HCl缓冲液(pH 7.5)中,即得到肌球蛋白溶液。采用Lowry法[16]测定蛋白质质量浓度。
1.3.2 MFB和NFB的制备
参考Yin Tao等[17]的方法,将鱼骨蒸煮、漂洗、破碎后,加入1 倍质量的冰水。微粒化处理制备MFB,处理条件:磨盘转速3 000 r/min、磨盘间隙0.3 mm,研磨2 次。进一步将MFB加水调整至总固形物质量分数为5%。纳米化处理制备NFB,处理条件:磨盘转速3 000 r/min、磨球填充率85%、磨球直径0.5 mm、球磨时间6 h。所得MFB和NFB样品的总钙含量采用火焰原子吸收光谱法[18]测定。
1.3.3 样品处理
根据不同指标测定时对肌球蛋白溶液质量浓度的要求,使用0.5 mol/L NaCl-20 mmol/L Tris-HCl缓冲液(pH 7.5)调整蛋白溶液质量浓度,分别加入MFB、NFB和CaCl2,将样品中总钙浓度调至40 mmol/L(空白组不添加钙离子),该样品可直接用于流变学性能测试。用于其他指标测试的肌球蛋白溶液还需进行如下处理:1)未加热处理:样品不进行加热;2)S处理:40 ℃下加热60 min;3)S+K处理:40 ℃下加热60 min后90 ℃下加热30 min。加热后样品立即用流水使其冷却至室温,于4 ℃冰箱保存,并在30 min内测定相关指标。
1.3.4 静态流变学性能测定
采用SPSS 23.0统计学软件对数据进行处理,计数资料以百分数(%)表示,采用x2检验,以P<0.05为差异有统计学意义。
采用AR2000ex型动态流变仪在flow模式下扫描,测定条件:蛋白质量浓度10.0 mg/mL、温度4 ℃、锥板直径为40 mm(锥板与平台角度2°)、载物台与平板间距52 μm、数据获取模式Continuous step,以剪切速率为变量(变量范围0.1~1 000 s-1)、变量扫描模式为线性(linear)、采集变量点数为33,即可得到剪切应力随剪切速率变化曲线。采用Cross模型拟合其零剪切黏度,按公式(1)计算。

式中:η0为零剪切黏度/Pa;η∞为无穷剪切黏度/Pa;ηa为表观黏度/Pa;k为黏度系数;n为流动特性指数;γ为剪切速率/s-1。
1.3.5 动态流变学性能测定
参考Ding Yuqin等[19]的方法并稍作修改,采用AR2000ex型动态流变仪在振荡模式下和线性黏弹区的范围内进行温度扫描,测定条件:蛋白质量浓度10.0 mg/mL、温度4 ℃、夹板直径40 mm、载物台与平板间距1 mm。加热程序分升温阶段(1 ℃/min从4 ℃升温到90 ℃)和降温阶段(10 ℃/min 从90 ℃降温到4 ℃)。其中,测试过程保持剪切应力为1.0 Pa,升温、降温阶段振荡频率为0.01 Hz,对样品储能模量G’、损耗模量G”和相位角δ的变化进行测定。
1.3.6 表面疏水性的测定
参考Benjakul等[20]的方法,使用50 mmol/L磷酸盐缓冲液(pH 7.0)将肌球蛋白溶液质量浓度分别调整为0.125、0.25、0.5、1.0 mg/mL,按照1.3.3节对样品进行处理,使用ANS荧光探针剂测定表面疏水性。使用RF-5301型荧光光谱仪在激发波长374 nm(狭缝3 nm)和发射波长485 nm(狭缝3 nm)下测定荧光强度。通过一元线性回归分析,以荧光强度-蛋白质量浓度曲线的初始斜率表征表面疏水性。
1.3.7 活性巯基浓度的测定
参考Ellman法[21]测定活性巯基浓度,将肌球蛋白的质量浓度调整至1.0 mg/mL,按照1.3.3节处理样品。将5.5 mL的肌球蛋白溶液与100 μL Ellman试剂混匀,4 ℃下放置1 h,测其在412 nm波长处的吸光度。活性巯基浓度按公式(2)计算。

1.3.8 溶解度的测定
参考Riebroy等[22]的方法,将肌球蛋白质量浓度调整至1.0 mg/mL,按照1.3.3节处理样品。取5 mL样品在4 ℃下8 000×g离心10 min得上清液,使用Lowry法[11]测离心前后蛋白质量浓度。溶解度为离心后蛋白质量浓度与离心前蛋白质量浓度的比例。
1.4 数据分析及处理
实验重复3 次,每次做3 个平行,采用Excel软件进行数据统计,结果以平均值±标准偏差表示;应用Origin 2018软件作图;采用SAS 8.0统计软件中Duncan’s法进行显著性分析,显著水平设为P<0.05。
2 结果与分析
2.1 NFB对肌球蛋白静态流变学特性的影响
图1为不同钙源作用下肌球蛋白表观黏度(ηa)和剪切速率(γ)的关系曲线。空白组、NFB组和CaCl2组肌球蛋白分子在低剪切速率下表现出较高的黏度,这是肌球蛋白分子间相互缠绕导致的[23]。随着剪切速率的增加,3 组肌球蛋白表观黏度下降,均呈先迅速下降后下降速率变缓的趋势,这是由于肌球蛋白分子按一定方向流动,流体阻力降低,导致表观黏度下降而呈剪切稀化现象[24]。NFB组肌球蛋白与CaCl2组曲线最接近,ηa明显高于另外两组,这是由于NFB、CaCl2释放出的Ca2+在4 ℃条件下有利于肌球蛋白分子之间形成钙桥[25]。而MFB颗粒较大,易破坏蛋白质之间的作用,且钙释放率较低,故其表观黏度最低[2,14]。
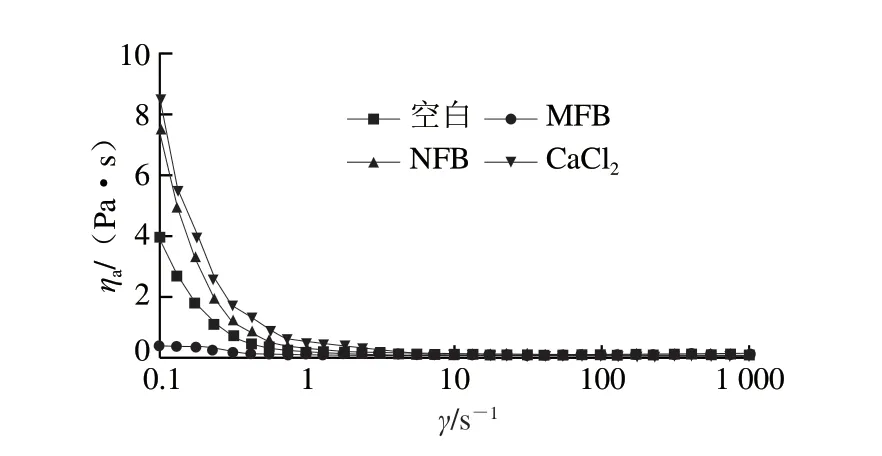
图1 不同钙源作用下肌球蛋白的表观黏度(ηa)和剪切速率(γ)的关系Fig.1 Relationship between apparent viscosity (ηa) and shear rate (γ) of myosin added with different calcium sources
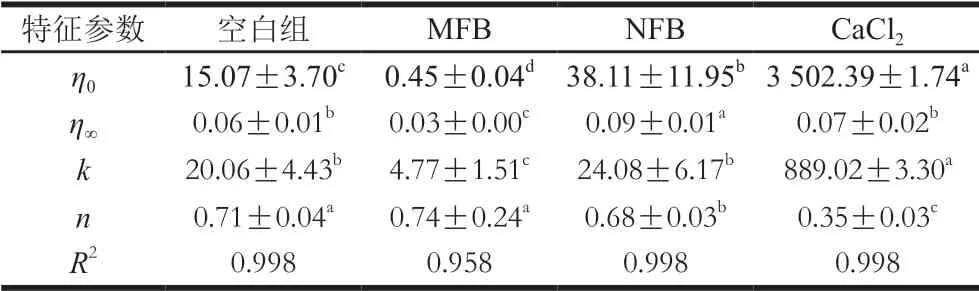
表1 不同钙源作用下肌球蛋白聚集体Cross模型拟合参数Table 1 Fitting parameters of Cross model for myosin aggregates added with different calcium sources
采用Cross模型对表观黏度ηa和剪切速率γ关系进行拟合,结果见表1(R2均大于0.958),所有特征参数n均小于1,表现为假塑性流体特性。CaCl2组肌球蛋白的黏度系数(k)和零剪切黏度(η0)显著高于其他组,NFB组次之,MFB组肌球蛋白k和η0最小,这进一步验证了CaCl2和NFB的加入能够提高肌球蛋白之间的相互作用,使其流动性下降。而MFB可能破坏了蛋白质之间的作用力,而增加了其流动性。
2.2 NFB对肌球蛋白动态流变学特性的影响
图2A1~C1为升温过程中不同钙源作用下肌球蛋白动态流变学性能的变化。4 组肌球蛋白在升温过程中变化趋势类似,tanδ随温度升高而降低。在4~30 ℃升温过程中G’呈下降趋势,这可能由于在4 ℃条件下肌球蛋白形成的主要是不稳定非共价键[26],升温破坏了该非共价键,使肌球蛋白流动性增强。30~38.8 ℃加热过程中所有样品G’均呈上升趋势,其中空白组肌球蛋白上升幅度最小。40~45 ℃所有样品G’轻微下降,这可能是由于肌球蛋白分子轻链解离使分子流动性增强或温度升高,破坏了以氢键为主的低温凝胶网络结构[27-28]。温度高于45 ℃后所有样品G’迅速升高,这是由于肌球蛋白分子间发生疏水相互作用及大量二硫键生成形成稳定的网络结构[24]。54.3~80 ℃加热过程中NFB组G′明显低于CaCl2组,继续加热至90 ℃,两组肌球蛋白G’相近,这可能由于温度升高促进NFB释放更多离子钙,加强了分子间的疏水相互作用[8],促进了肌球蛋白的聚集。MFB的钙释放量低于NFB,且颗粒过大,影响了有序凝胶网络的形成[11,14];因此MFB组肌球蛋白继续加热G’下降。
如图2A2~C2所示,整个降温过程中,4 组肌球蛋白G’和G”都呈上升趋势,且G’的增幅远大于G”,tanδ小幅度波动。这是由于降温冷却可促进肌球蛋白分子间的氢键形成,有利于形成稳定的凝胶体系。从90 ℃降温至40 ℃时,3 组加钙肌球蛋白的G’高于空白组。而从40 ℃降温至4 ℃时,MFB组和NFB组肌球蛋白G’相近,低于CaCl2组,但明显高于空白组。这是因为鱼骨所释放的钙离子促进了肌球蛋白的胶凝,但其释放的Ca2+含量低于CaCl2组。


图2 不同钙源作用下肌球蛋白的动态流变学性能Fig.2 Dynamic rheological properties of myosin added with different calcium sources
2.3 NFB对肌球蛋白表面疏水性的影响
表2为不同钙源作用下肌球蛋白在加热过程中表面疏水性的变化。CaCl2组和空白组肌球蛋白表面疏水性在加热过程中呈上升趋势,NFB组和MFB组肌球蛋白经40 ℃加热处理后表面疏水性上升,经90 ℃加热处理后下降。这是因为加热及离子钙的加入促进了肌球蛋白分子展开,使原包埋在分子内部的疏水性基团暴露出来[23,29];但继续加热会使暴露出的疏水性基团因相互作用聚集,而导致表面疏水性降低。未加热条件下NFB组肌球蛋白表面疏水性介于CaCl2组和空白组之间,MFB组表面疏水性最低。这可能是由于鱼骨中钙的释放率与鱼骨粒径成反比,鱼骨粒径越小其钙释放率越高[9]。NFB可溶性钙的释放率显著高于MFB,NFB可在4 ℃条件下诱导肌球蛋白分子构象发生变化,使肌球蛋白分子表面疏水性升高。而MFB可能由于其颗粒较大使部分蛋白沉降,导致可与ANS荧光探针结合的蛋白含量减少而使表面疏水性下降。推测NFB组、MFB组肌球蛋白在40 ℃加热阶段时疏水性基团暴露占主导,在90 ℃加热阶段形成了大量疏水相互作用。

表2 不同钙源作用下肌球蛋白的表面疏水性Table 2 Surface hydrophobicity of myosin added with different calcium sources
2.4 NFB对肌球蛋白巯基含量的影响
表3为不同钙源作用下肌球蛋白在加热过程中活性巯基浓度的变化。未加热条件下,与空白组相比,MFB组肌球蛋白活性巯基浓度增加,而CaCl2、NFB的加入对肌球蛋白的活性巯基浓度无显著影响。经40 ℃加热60 min后,空白组、NFB组及CaCl2组活性巯基浓度显著升高,且NFB组肌球蛋白活性巯基浓度介于CaCl2组和空白组之间;经90 ℃加热30 min后,NFB组和CaCl2组活性巯基浓度下降程度均高于空白组,说明NFB和CaCl2的添加促进了蛋白质间二硫键的形成。加热过程中,MFB组肌球蛋白活性巯基浓度无显著变化,这进一步印证了颗粒较大的MFB干扰了二硫键的形成。此外,CaCl2所释放的离子钙含量高于NFB[14],其活性巯基浓度变化也最高,推测活性巯基浓度的变化与所添加钙源释放的离子钙浓度密切相关。Li Yanqing等[30]也得到了类似的结论,加热及离子钙的加入使蛋白的疏水结构发生变化,包埋在分子内部疏水区域中的巯基基团暴露在蛋白-水界面从而促进活性巯基发生反应导致活性巯基含量下降。

表3 不同钙源作用下肌球蛋白的活性巯基浓度Table 3 Reactive sulfhydryl group contents of myosin added with different calcium sources mol/L
2.5 NFB对肌球蛋白溶解度的影响
溶解度可以反映蛋白的聚集情况,表4为不同钙源作用下肌球蛋白在加热过程中溶解度的变化。相同加热条件下,MFB组肌球蛋白溶解度最高,NFB组溶解度介于空白组和CaCl2组之间,而CaCl2组最低,与钙源的离子钙释放量趋势刚好相反,这是由于Ca2+促进了蛋白质聚集,从而导致溶解度降低[31];MFB则因为其颗粒较大破坏了蛋白质间的相互作用,导致肌球蛋白聚集程度降低[11]。这与流变学实验结果相符,进一步说明了肌球蛋白经加热处理后溶解度均降低,蛋白质分子经加热后结构变得松散,α-螺旋向β-转角和无规卷曲结构转变[23],原包埋在内部的部分活性基团暴露在表面,分子间形成疏水相互作用(表2)和二硫键(表3),导致蛋白质聚集,溶解度下降。NFB的添加有利于提高肌球蛋白凝胶特性。
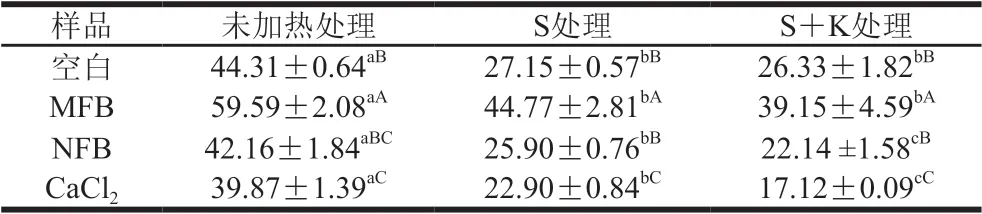
表4 不同钙源作用下肌球蛋白的溶解度Table 4 Solubility of myosin in the presence of different calcium sources %
3 结 论
静态流变学结果表明,Cross模型可以很好地拟合肌球蛋白表观黏度ηa和剪切速率γ之间的关系,各组肌球蛋白样品特征参数n均小于1,呈现出剪切稀化现象。NFB组和CaCl2组肌球蛋白表观黏度增加,NFB和CaCl2的添加增强了肌球蛋白分子间的相互作用,而MFB因其释放的钙离子浓度较低,且颗粒较大,使蛋白质分子间相互作用程度降低,产生相反的效果。进一步结合动态流变学结果及蛋白质分子间作用和构象变化发现,肌球蛋白分子间二硫键的生成及疏水相互作用的发生与钙源释放的钙离子浓度密切相关,NFB和CaCl2在加热过程中释放的大量钙离子促进了肌球蛋白分子间生成二硫键,疏水相互作用增强,肌球蛋白聚集程度升高。NFB对肌球蛋白凝胶性能的促进作用与CaCl2相近,明显优于MFB。综上,NFB的加入能够增强肌球蛋白的凝胶性能,这可为将NFB作为一种天然安全低价的钙源应用于鱼糜制品中提供一定的理论依据。

