制备富含γ-氨基丁酸酸奶的乳酸菌筛选及相关特性分析
孙世鑫,李科,骆鹏飞,俞兰秀,莫小叶,孙海燕,张丽君,刘冬
(1.深圳职业技术学院,深圳市发酵精制检测系统重点实验室,广东深圳 518055)
(2.绿雪生物工程(深圳)有限公司,广东深圳 518055)
γ-氨基丁酸,又名γ-氨酪酸、4-氨基丁酸,是一种在自然界广泛存在的小分子量非蛋白质氨基酸。GABA是人体中枢神经系统中重要的抑制性神经递质[1],具有改善睡眠[2]、降低血压[3]、缓解焦虑[4]和免疫调节[5]等多种生理功能。研究表明,健康人群体内产生的GABA 能够满足自身需要,但受到年龄增长或失眠、抑郁等亚健康状态的影响,体内的GABA 会因为过度消耗导致含量明显下降[6]。2009 年,我国将GABA纳入新资源食品目录。开发富含GABA 的功能性食品,能够有效缓解和预防因体内GABA 减少而诱发的各种慢性疾病和亚健康症状,因而具备良好的市场前景。
目前,GABA 可通过化学合成[7]、天然植物提取[8]和微生物发酵等方法制备。但化学合成法的产物在安全性上存在争议,尚不能应用于食品领域。天然物植物提取法受到原料、工艺等因素限制,提取分离产率低,不适用于工业化生产。相比之下,利用微生物如乳酸菌发酵,依靠其体内的谷氨酸脱羧酶(Glutamate decarboxylase,GAD,EC4.1.1.15)将L-谷氨酸经α-脱羧反应生成GABA,具有合成速度快、生产成本低、发酵产量高等优点[9],近年来被广泛应用于富含GABA 的食品和药品的合成[10]。
以酸奶为代表的发酵乳制品一直深受消费者欢迎,乳酸菌作为益生菌也被广泛应用于酸奶生产中。但迄今为止,利用乳基底物培养食品安全级的产GABA 乳酸菌,并直接用于发酵生产富含GABA 的酸奶的研究报道鲜见,也尚未见到国内外有富含GABA的酸奶上市的报道。因此,筛选适宜在乳基底物中生长并具备高产GABA 能力的乳酸菌具有巨大的市场应用前景。
本研究从国内市售发酵食品中分离筛选具备合成GABA 能力的食品安全级乳酸菌,得到1 株在乳基底物中具备高产GABA 潜力的菌株,并对其菌株特性进行了初步研究,以期为富含GABA 的酸奶开发提供理论参考。
1 材料与方法
1.1 菌种来源
本实验选用国内市售奶酪、奶疙瘩和米糟等发酵食品作为菌种分离原料。
1.2 培养基
MRS 肉汤培养基(g/L):葡萄糖20,蛋白胨10,牛肉粉5,酵母粉5,硫酸镁0.1,醋酸钠5,柠檬酸铵2,磷酸氢二钾2,硫酸锰0.05,吐温80 1 mL,调节pH 值为7.2±0.1,121 ℃灭菌15 min。
M17 肉汤培养基(g/L):大豆胨5,肉胨2.5,酪胨2.5,酵母粉2.5,牛肉浸粉5,乳糖5,抗坏血酸0.5,甘油磷酸钠19,硫酸镁0.25,调节pH值为7.2±0.1,121 ℃灭菌15 min。
MRS 平板培养基:在MRS 肉汤培养基中添加琼脂20 g/L。
MI7 平板培养基:在M17 肉汤培养基中添加琼脂20 g/L。
乳基底物培养基:市售脱脂乳粉,纯水溶解后配置成10%(m/V)的复原乳,添加L-谷氨酸钠(L-Glu-Na)2 g/L[11]。
1.3 试剂
GABA(色谱纯),Sigma 公司;四氢呋喃、甲醇、乙腈(色谱纯),天津大茂化学试剂厂;L-Glu-Na(生化试剂纯),国药集团化学试剂有限公司;革兰氏染色液试剂盒,北京陆桥技术股份有限公司;API 试剂盒,法国梅里埃公司;其他试剂均为国产分析纯。
1.4 仪器与设备
5810R 型高速冷冻离心机,德国Eppendoff 公司;LC-20AT 型高效液相色谱,日本Shimadzu 公司;Spectra Max M2 型荧光酶标仪,美国Molecular Devices 公司;ECLIPSE TS100 型倒置显微镜,日本Nikon 公司;PHS-3C 型pH 计,上海仪电科学仪器股份有限公司。
1.5 方法
1.5.1 菌株的分离纯化与培养
对原料进行前处理后,取样品10 mL,用无菌生理盐水梯度稀释后涂布于MRS 平板培养基上,静置于37 ℃和30 ℃培养箱中恒温培养48 h,随后挑选生长较快、肉眼可见的菌落在MRS 平板培养基上进行划线培养,重复操作直至分离出形态一致的单菌落。对上述单菌落进行镜检、革兰氏染色和过氧化氢酶实验。将革兰氏染色呈阳性、过氧化氢酶反应呈阴性的菌落纯化后接种于适宜的肉汤培养基(乳杆菌-MRS培养基,乳球菌-M17 培养基)中静置培养24 h。分别吸取等体积的菌悬液和40%(V/V)灭菌甘油于2 mL冻存管,摇匀,-80 ℃冻存。
1.5.2 分子生物学鉴定
16S rDNA 序列委托深圳华大基因科技有限公司测定。测序引物 27F 和 1492R 分别为:27F AGAGTTTGATCMTGGCTCAG,1492R TACGGYTA CCTTGTTACGACTT。PCR 反应体系(总体积30 μL):无菌超纯水17.8 μL,Buffer 3 μL,d NTP 2 μL,正向引物3 μL,反向引物3 μL,DNA 模板1 μL,酶0.2 μL。
PCR 反应条件:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸1 min,共循环35 次;最后72 ℃延伸10 min。将测序结果与NCBI 中Gene Bank 数据库进行BLAST 对比,采用MEGA 7.0 构建系统发育树。
1.5.3 产GABA 菌株的初筛和复筛
将菌株菌悬液以3%(V/V)体积分数接种于适宜的肉汤培养基(乳杆菌:MRS 肉汤培养基;乳球菌:M17 肉汤培养基)中,于该菌最适生长温度下恒温培养12 h,重复活化3 次。取单菌株种子液以3%(V/V)体积分数接种于适宜的肉汤培养基(同上)中,于最适生长温度下恒温培养72 h。取菌悬液1 mL 于4 ℃、12000 r/min 离心3 min,吸取适量上清液加入等体积5%(m/V)三氯乙酸溶液,再次于4 ℃、12000 r/min离心15 min。测定上清液中GABA 含量,并以其为指标初筛出具备合成GABA 能力的菌株。
从初筛的菌株中选择产量相对较高的菌株,按初筛方法接种于乳基底物培养基,于最适生长温度下恒温发酵48 h,按初筛方法测定发酵乳中GABA 含量,并以其为指标复筛出具备高产GABA 能力的菌株。
1.5.4 GABA 的定量检测
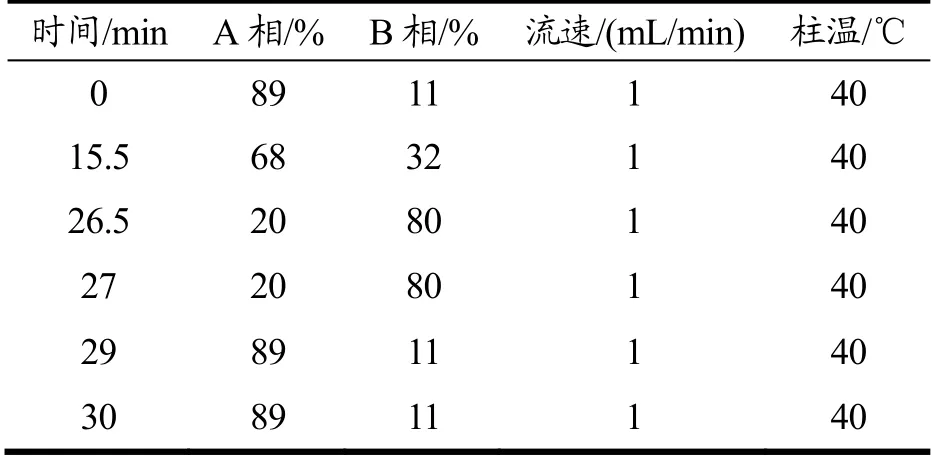
表1 梯度洗脱程序Table 1 The gradient elutionprogram
HPLC 法,在QB/T 4587-2013 检测方法基础上加以改进。精密吸取适量样品液与等体积的邻苯二甲醛衍生剂混合,室温反应2 min 后经0.22 μm 尼龙针头过滤器转移至液相进样瓶。流动相A 为25 mmol/L 醋酸钠,调节pH 至7.2;流动相B 为甲醇和乙腈,混合比例为50:50,两相均经0.45 μm 有机系滤膜抽滤后超声脱气20 min 后使用。色谱柱Agilent ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm),柱温为40 ℃,流速为1 mL/min,进样量为20 μL,检测波长334 nm,梯度洗脱。
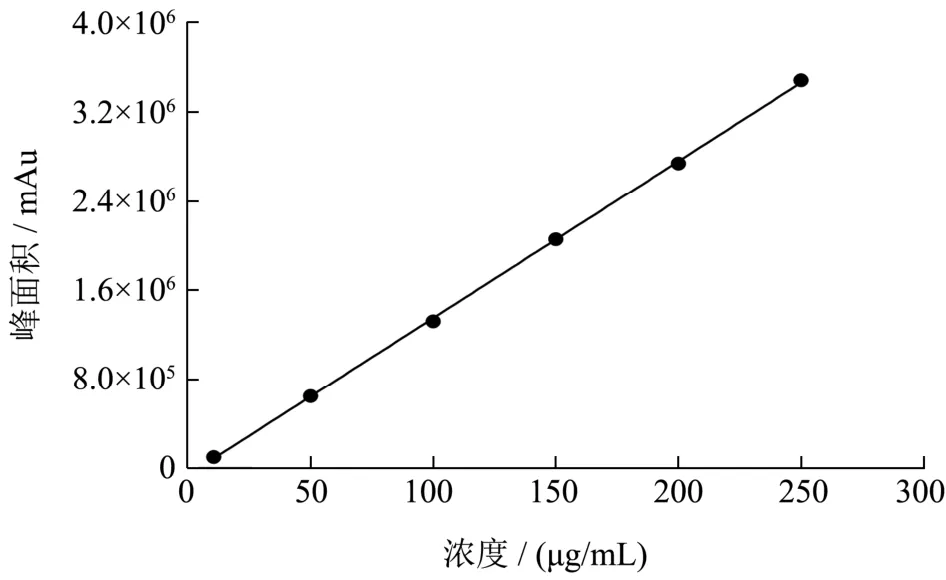
图1 GABA 标准浓度曲线Fig.1 The standard curve of GABA
用质量浓度为10、50、100、150、250 μg/mL 的GABA 标准工作液并绘制标准曲线,如图1 所示。以峰面积(y)对GABA 浓度(x)做线性回归,得线性回归方程y=14179x-59007,线性相关系数R2=0.9998。
1.5.5 菌株特性测定
1.5.5.1 形态学观察
取菌液0.1 mL 涂布于平板培养基,在30 ℃下恒温培养48 h,观察、记录菌落颜色、大小、边缘生长情况。取少量经革兰氏染色后用显微镜于100 倍油镜观察并拍照,记录其菌体形态特征。
1.5.5.2 糖代谢特性分析
将菌株于30 ℃厌氧培养48 h 后,选取API 50 CH试验条,按照试验条的使用说明进行操作,对菌株的糖代谢特性进行分析。
1.5.5.3 生长曲线测定
比浊法[12]。将菌株接种于M17 肉汤培养基中,在30 ℃下恒温培养48 h,以空白培养基作为对照,每隔2 h 使用酶标仪测定发酵液在600 nm 下的吸光度(即OD600值),并以时间为横坐标,OD600值为纵坐标,绘制菌株生长曲线。
1.5.5.4 产酸曲线测定
pH 计法[13]。将菌株接种于M17 肉汤培养基中,在30 ℃下恒温培养48 h,每隔4 h 测定发酵液pH 值,并以时间为横坐标,pH 值为纵坐标,绘制菌株产酸曲线。
1.5.5.5 耐酸能力测定
将菌株分别接种于pH 值为2.0、3.0、4.0 的M17肉汤培养基中,在30 ℃下恒温培养3 h,而后对不同pH 值培养基中的活性乳酸菌进行平板计数[14],按式(1)计算菌株在不同pH 值下的存活率,测定菌株的耐酸能力。

1.5.5.6 耐胆盐能力测定
菌株分别接种于胆盐浓度为1.0、2.0、3.0 g/L 的肉汤培养基中,在30 ℃下恒温培养3 h,而后对不同胆盐浓度培养基中的活性乳酸菌进行平板计数[15],按式(2)计算菌株在不同胆盐浓度下的存活率,测定菌株的耐胆盐能力。

1.5.5.7 自凝聚能力测定
取菌种菌悬液1 mL,在4 ℃下以4000 r/min 离心5 min,弃上清液,收集菌体,再用pH 值7.0 的磷酸盐缓冲液重复洗涤菌体两次,使菌体重悬于1 mL 磷酸盐缓冲液中。分别测定在30 ℃下静置2、4、24 h后上层悬液的OD600值,按式(3)计算菌株的自凝聚能力[16]。
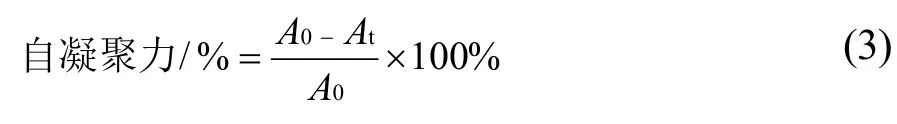
式中:A0为t=0 时刻的OD600值;At为t 时刻的OD600值。
1.5.5.8 表面疏水性测定
取菌种菌悬液3 mL,在4 ℃下以4000 r/min 离心5 min,弃上清液,收集菌体,再用pH 值7.0 的磷酸盐缓冲液重复洗涤菌体两次,使菌体重悬于3 mL 磷酸盐缓冲液中。分别吸取1 mL 的乙酸乙酯及1 mL 的氯仿与上述磷酸盐缓冲液混合,室温静置分层15 min,测定水相的OD600值,按式(4)计算菌株的表面疏水性[17]。
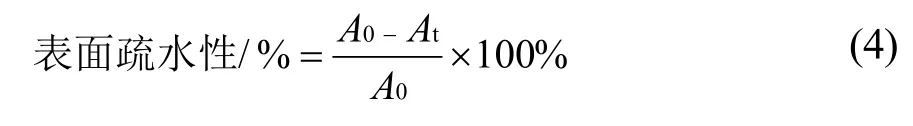
式中:A0为溶剂萃取前水相t=0 时刻的OD600值;At为溶剂萃取后水相t=15 min 时刻的OD600值。
1.5.6 数据处理与分析
每次实验均做3 次平行,数据结果以Mean±SD表示。实验数据的差异显著性用SPSS 22.0 软件中one-way ANOVA 法检验,p<0.05 视为有显著差异,并用GraphPad Prism 8 软件作图。
2 结果与讨论
2.1 菌株的分离与鉴定

表2 菌株的种属分类鉴定Table 2 Classification and identification of strains
从原料中共分离纯化出菌株171 株,经深圳华大基因科技有限公司16S rDNA 测序并构建系统发育树鉴定,全部为乳酸菌,鉴定结果见表2。所有待测菌株与对照菌株的同源性均在99%以上,其中基于一株乳酸乳球菌乳酸亚种菌株构建的系统发育树如图2 所示。
2.2 具备高产GABA 能力菌株的筛选
利用改进后的HPLC法测定171株菌株发酵液中GABA 的质量浓度,对菌株进行初筛。得到具备GABA 合成能力的菌株74 株,其中乳杆菌2 种共41株,乳球菌3 种共33 株。经比较后发现,不同种属的乳酸菌的GABA 合成能力存在显著差异。初筛中GABA 产量高于0.01 g/L 的17 株乳酸菌及其产量如表3 所示。

图2 基于一株乳酸乳球菌乳酸亚种菌株构建的系统发育树Fig.2 Phylogenetic treeconstructed based onstrain of Lactococcus lactis subsp. lactis
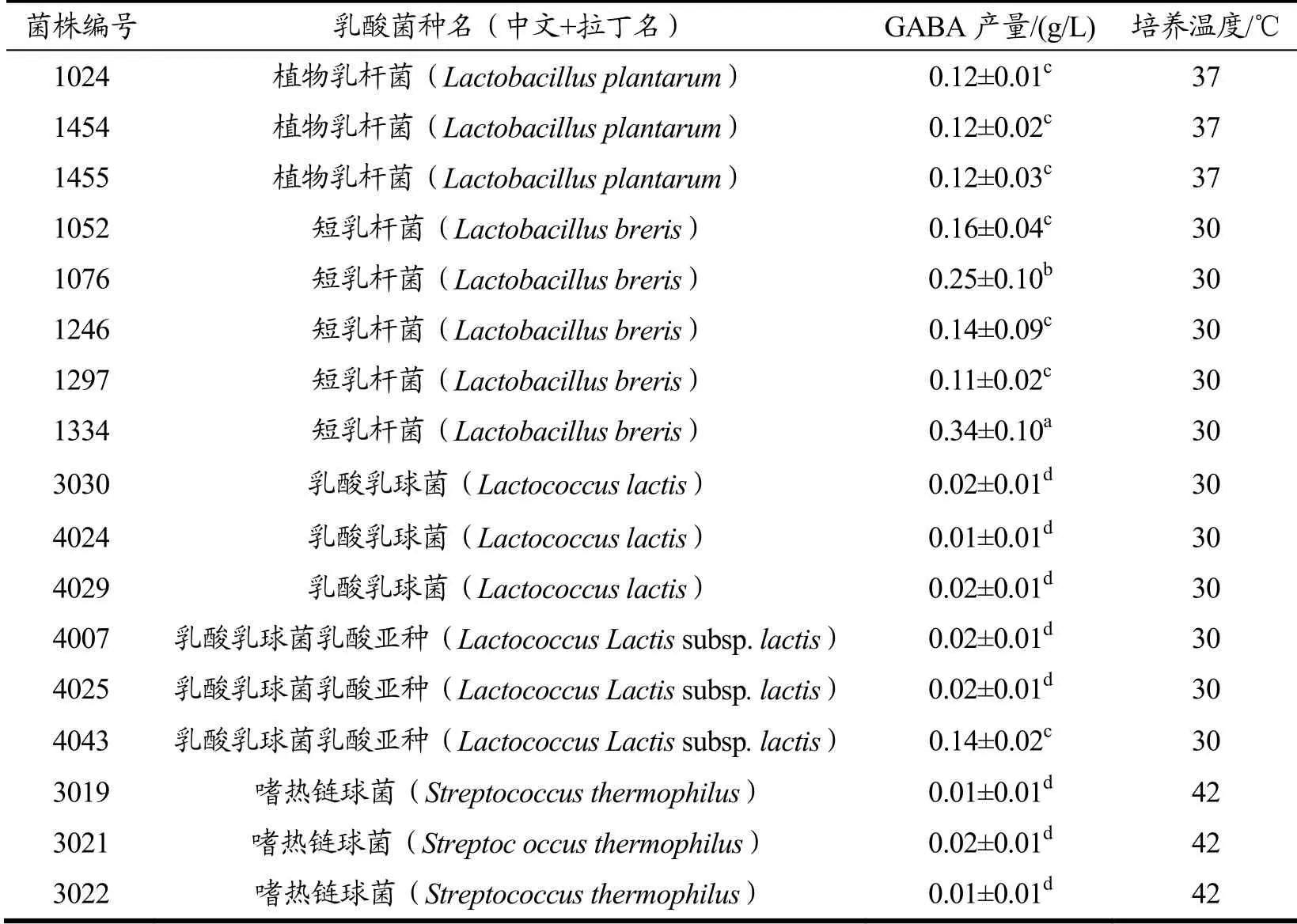
表3 初筛中具备较高GABA 合成能力的菌株Table 3 Strains with relatively high yield of GABA in preliminary screening
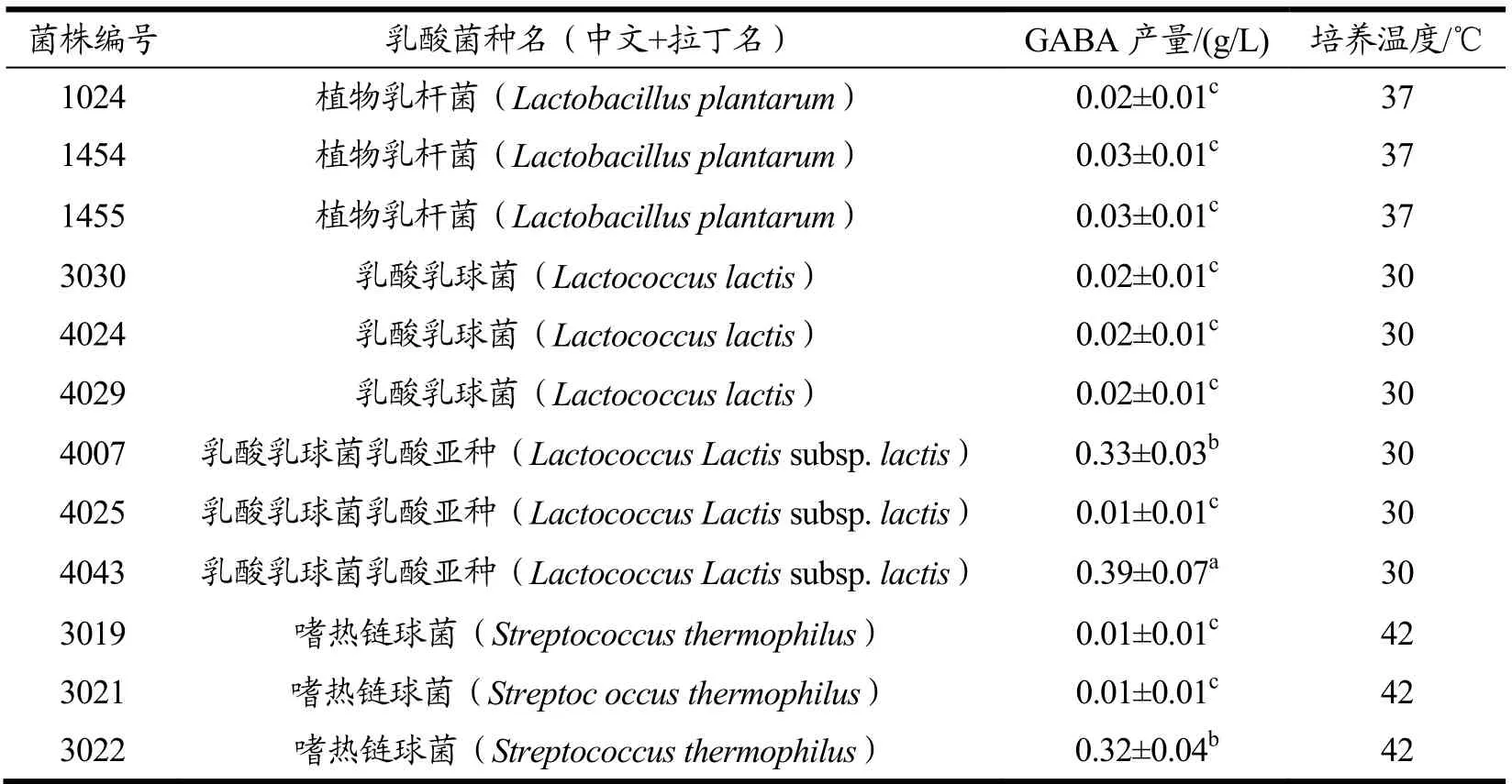
表4 复筛中菌株GABA 产量情况Table 4 GABA production of strainsin rescreening
从上表可以发现,短乳杆菌的GABA 合成能力相对突出。但目前短乳杆菌尚未列入我国《可用于食品的菌种名单》,不能满足食品安全要求,故将短乳杆菌剔除。将剩余的12株乳酸菌转接于乳基底物培养基中,于最适温度下恒温发酵48 h,并以发酵乳中GABA 含量为指标进行复筛,结果如表4 所示。
由上表可见,编号为4043 的乳酸乳球菌乳酸亚种菌株(以下简称4043 号菌株)在乳基底物中合成GABA 的能力最强,产量约为0.39 g/L。贤乾隆等[18]从酸菜和酸奶中分离得到干酪乳杆菌QL-20,按3%(V/V)接种至含L-Glu-Na 0.2%(m/V)的12%(m/V)的脱脂乳培养基中,37 ℃下静置发酵,凝乳时间为6 h,发酵乳中GABA 产量约0.09 g/L。Nejati F 等[19]用添加了5 g/L 酵母膏和20 mmol/L 谷氨酸钠的灭菌炼乳培养乳酸乳球菌 DIBCA1(Lactococcus lactisDIBCA1)和植物乳杆菌PU11(L. plantarumPU11),在37 ℃下复配发酵48 h,GABA 的产量超过了0.14 g/L。

表5 4043 号菌株API 50CH 试验条代谢结果Table 5 Metabolism results of strain No. 4043 with API 50CH reagent strip
赵树平等[20]从酸马奶中筛选的瑞士乳杆菌ND01(L.helveticusND01),按3%(V/V)接种于11%(m/V)的灭菌复原乳中,于37 ℃下静置发酵30 h,GABA产量最高近0.17 g/L。Wu QL 等[21]利用嗜热链球菌YI-B1(Streptococcus thermophilusYI-B1)复配短乳杆菌NPS-QW-145(Lactobacillus brevisNPS-QW-145),于37 ℃下在添加2 g/L L-Glu-Na 的10%(m/V)脱脂乳中发酵24 h,GABA 的产量达到0.31 g/L。此外,闫天文等[22]将分离自内蒙古传统发酵乳制品中的植物乳杆菌NDC75017(L. plantarumNDC75017)与德氏乳杆菌保加利亚亚种、嗜热链球菌混合(L. P:L. b:S.t=0.5:0.5:1.5)作为发酵剂,当接种量为2%(V/V),L-Glu-Na 添加浓度为75 mmol/L,辅酶浓度为20 μmol/L,发酵温度为43 ℃时,GABA 产量最高可达550 mg/kg。谢芳等[23]利用从生水牛乳中分离出的乳酸乳球菌乳酸亚种按照1:0.5:1 的比例复配德氏乳杆菌保加利亚亚种(1.2717Lactobacillus delbrueckii subsp.Bulgaricus)和嗜热链球菌(1.2718Streptococcus thermophilus),当乳酸乳球菌接种量为3%(V/V)时,在L-Glu-Na添加量为6‰(m/V)的脱脂水牛乳中37 ℃恒温发酵,GABA 产量最高可达0.7 g/L。而薛玉清等[24]将从内蒙古传统酸奶中筛选的植物乳杆菌与德氏乳杆菌保加利亚亚种和嗜热链球菌按照0.5:0.5:1.5 的比例,总接种量为2%(V/V)接种至灭菌乳中,在43 ℃恒温发酵3.6 h,GABA 产量超过了1.51 g/L。可见,未经发酵条件优化的4043 号菌株在乳基底物中单菌种发酵的GABA 产量明显优于文献报道的产量,但相较优化后的多菌种复配发酵的产量还有一定距离,后期可通过多菌种混合发酵及条件优化进一步提升自身GABA 产量。
2.3 4043 号菌株的菌株特性
2.3.1 形态学特性
4043 号菌株的平板菌落及菌株的镜检结果如图3所示。由图可知,菌落为半透明乳白色,呈不规则圆形,直径在1 mm 左右,中央略微隆起,表面光滑湿润,边缘整齐。菌体呈球形或卵圆形。
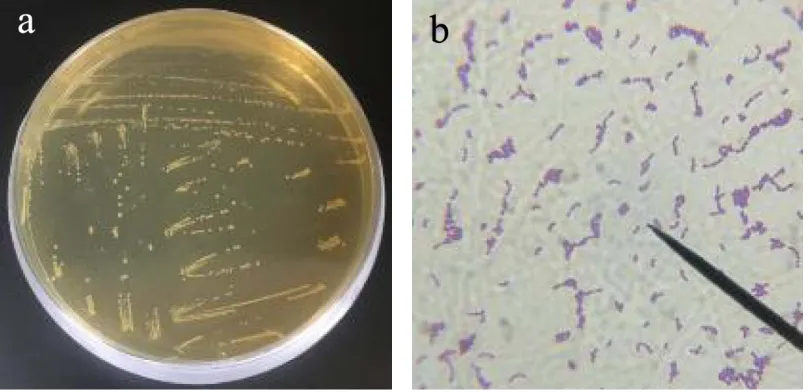
图3 4043 号菌株的菌落及菌体形态Fig.3 Colony and morphological characteristics of strain No.4043
2.3.2 糖代谢特性
采用API 50CH 试验条对4043 号菌株的糖代谢特性进行测定,各底物试验条代谢结果判别见表5。
可见,4043 号菌株可发酵葡萄糖、半乳糖、麦芽糖、乳糖、淀粉、蔗糖和海藻糖等18 种单糖、二糖及多糖,不能代谢山梨糖、蜜二糖、山梨醇等31 种底物,后续在针对4043 号菌株开展的产品配方和发酵工艺优化过程中,应根据该菌种的糖代谢特征选择合适的糖类。
2.3.3 菌株的生长和产酸曲线
4043 号菌株在30 ℃下恒温培养48 h 的生长曲线和产酸曲线如图4 所示。由图4 OD600曲线可知,总菌数在接种后0~2 h 显著增加,在2~8 h 内呈指数增加,8~12 h 缓慢增加并在13 h 附近到达峰值,随后缓慢波动,自32 h 后开始显著下降,直至发酵终点。这表明4043 号菌株适应期较短;对数生长期为接种后2~8 h,菌株繁殖迅速;8~32 h 为稳定期,能够维持基本的生长能力;自32 h 后进入衰亡期。
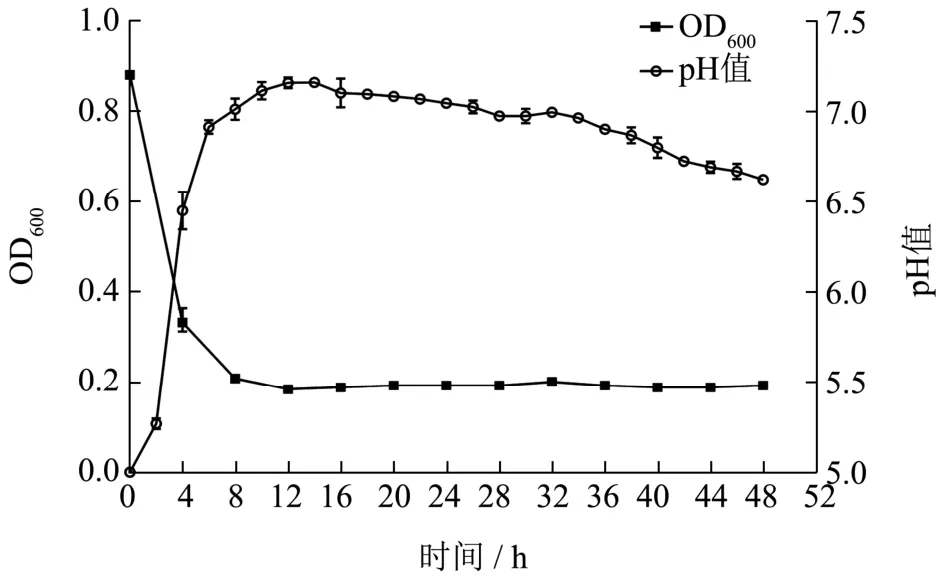
图4 4043 号菌株的生长及产酸曲线Fig.4 Growth and acid production curve of strain No.4043
由图4 中pH 值曲线可知,4043 号菌株在适应期和对数生长期内产酸迅速,导致发酵液pH 值自7.2迅速降低至5.5 左右,但其后pH 值便稳定于此,直至发酵结束也未能进一步降低。这表明4043 号菌株的持续产酸能力较弱,容易导致发酵乳的凝乳形态不佳。此外有研究表明,对于乳酸乳球菌乳酸亚种而言,菌株GAD 的最适pH 值在4.7 左右[25]。较高的终点pH值也不利于自身GAD 活性的充分发挥,从而限制了GABA 产量的进一步增长。因此在应用于富含GABA的酸奶生产时,可复配具备较强持续产酸能力的菌种与4043 号菌株进行混合发酵,以进一步降低环境pH值,改善终点凝乳形态,提升GABA 产量。
2.3.4 菌株对酸和胆盐的耐受性
能够顺利通过胃酸和胆盐所构成的生物屏障,并稳定粘附于肠道上皮细胞从而实现定植,是益生菌在人体内发挥益生功能的前提条件[26]。因此,能够在胃肠道中发挥作用的益生乳酸菌必须拥有较强的对酸和胆盐的耐受性。4043 号菌株在不同pH 值和胆盐浓度下的耐受情况如图5 所示。由5a 图可知,4043 号菌株对酸的耐受性随pH 值变化差异显著。于30 ℃下在pH 值为2.0 的M17 肉汤培养基中培养3 h 后,菌株存活率几乎为零。随着pH 值上升,4043 号菌株的存活率也显著上升。当pH 值>3 时,存活率明显高于60%。结合其生长曲线和产酸曲线可知,在pH 值3~5.5 的条件下,4043 号菌株对酸具备较强的耐受性。由5b图可知,当培养基中胆盐浓度≥1 g/L 时,在30 ℃下静置培养3 h 后,菌株基本无法存活,对胆盐的耐受性极差。
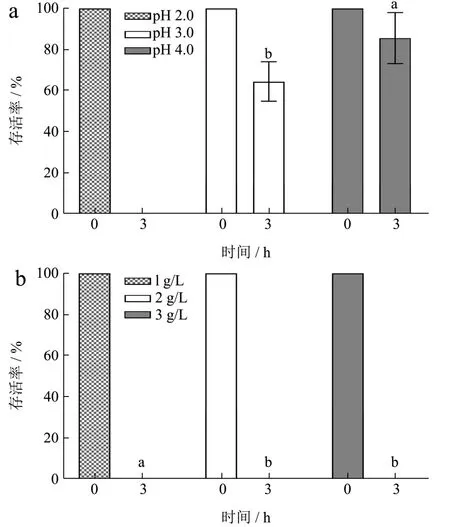
图5 4043 号菌株的耐酸和耐胆盐特性Fig.5 Acid and bile salttolerance ability of strain No.4043
研究表明,健康人群胃肠道中,胃液pH 值和肠液胆盐浓度都是动态变化的。在进食状态下,胃部pH值在1.8~5.0之间波动,通常情况下维持在2.0左右[27],而肠液胆盐浓度在3~5 g/L 之间变化[28]。结合4043 号菌株对酸和胆盐的耐受范围可知,该菌无法在健康人群的胃肠道环境中存活,不适宜在胃肠道内定植以发挥益生菌功能,但仍可在发酵制备富含GABA 酸奶的过程中充分发挥其高产GABA 的潜力。
2.3.5 菌株的自凝聚能力和表面疏水性
研究显示,自凝聚特性有助于乳酸菌形成生物膜,表面疏水性是决定乳酸菌非特异性粘附的重要动力,两者对于乳酸菌向肠道上皮细胞的顺利粘附和稳固定植至关重要[29]。4043 号菌株的自凝聚能力及表面疏水性如图6 所示。从6a 图可以发现,4043 号菌株的自凝聚力随着时间延长呈非线性增加趋势。在静置2~4 h期间,4043 号菌株自凝聚力有所增加但差异不大,至24 h 后则迅速增加至72.77%,略优于夏海燕等[30]筛选的发酵乳杆菌18-2(70.50%)和17-1(70.67%)。
从6b 图可以发现,4043 号菌株对乙酸乙酯的疏水性明显高于对氯仿的疏水性,但两者数值均低于8%。参照表6 可判定,4043 号菌株为弱疏水性菌株,粘附特性较差。虽然具备良好的自凝聚力,但低疏水性的菌体表面决定了4043 号菌株难以在人体肠道内实现有效粘附与定植。这再次印证,4043 号菌株不适宜在胃肠道内定植以发挥益生菌功能。
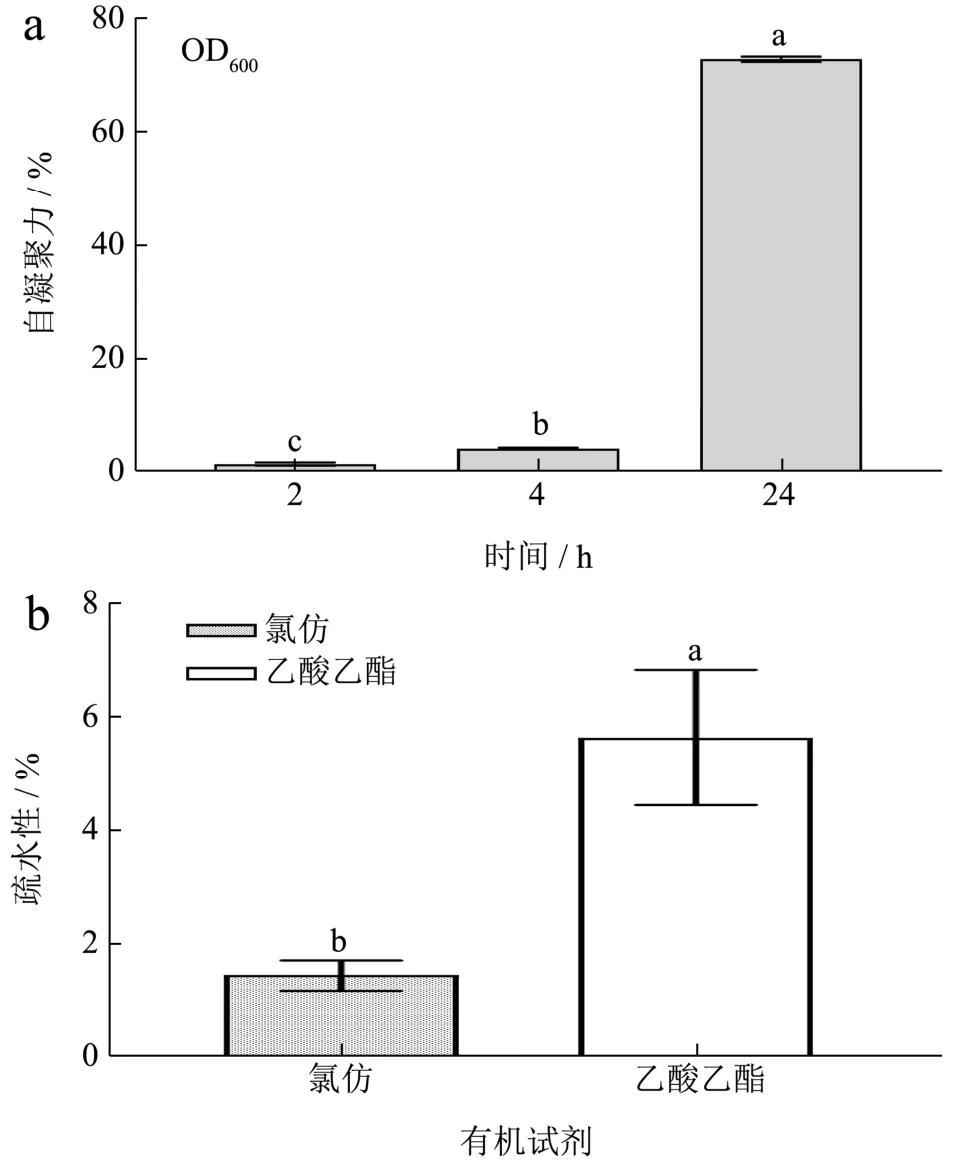
图6 4043 号菌株的自凝聚能力和表面疏水性Fig.6 Auto-aggregationand hydrophobicity of strain No.4043

表6 菌株疏水性判定标准Table 6 Judgement standard of hydrophobicity
3 结论
3.1 本研究针对从市售发酵食品中分离出的171株乳酸菌,经肉汤培养基初筛和脱脂复原乳培养基复筛,最终得到一株在乳基底物中具有高产GABA 潜力的食品安全级乳酸乳球菌乳酸亚种菌株。将该菌以3%(V/V)接种于含L-Glu-Na 2 g/L 的10%(m/V)乳基底物培养基中,在30 ℃下单菌种发酵48 h,GABA产量约0.39 g/L。
3.2 所筛的乳酸乳球菌乳酸亚种菌株能够代谢葡萄糖、半乳糖等18 种糖分。于30 ℃下接种于M17 培养基中,对数生长期为2~8 h。该菌持续产酸能力较弱,在pH 值3~5.5 的环境中具备良好的酸耐受性,菌株自凝聚力良好,但对胆盐的耐受性极差,且属于弱疏水性菌株,粘附特性较差,难以在人体肠道内有效粘附与定植,不适宜在胃肠道内定植以发挥其益生菌功能。
3.3 该菌种具有较高的产GABA 能力,可作为研制富含GABA 酸奶的潜力菌种应用于富含GABA 功能性酸奶的生产中。

