LiaX 家族表面蛋白LPL9_0968 在副干酪乳杆菌L9 胆盐胁迫应激中的作用
王艳美,刘永乐,邓凯,玛依热·奥斯曼,马夏吟
(长沙理工大学食品与生物工程学院 长沙 410114)
副干酪乳杆菌属于干酪乳杆菌群,是一种在人类和动物肠道内常见的革兰氏阳性益生菌,被广泛用于乳制品发酵中,在干酪发酵过程中对风味的形成起关键性作用[1]。此外,副干酪乳杆菌具有增强人体免疫力,维持肠道微生态平衡等诸多益生特性[2]。然而,益生乳酸菌在进入人体消化道后会遇到各种各样的环境胁迫,如胃酸、胰消化酶及肠道中的胆盐等[3],此时益生菌存活率显著降低。副干酪乳杆菌随发酵食品进入人体内并最终定植于肠道系统,能否耐受一定程度的胆盐胁迫是其发挥益生作用的关键。
胆盐是胆酸形成的不同钠盐或钾盐的混合物,首先由胆固醇经过一系列反应形成初级胆盐,后转化为次级胆盐,最后次级胆盐与甘氨酸或牛磺酸形成结合型胆盐,人体中甘氨酸结合型胆盐与牛磺酸结合型胆盐的比例约为3∶1[4]。结合型胆盐比游离型胆盐的溶解度更高,两亲性更强,是胆汁中发挥功能的主要成分。胆盐作为一种具有较强抗菌活性的物质,可通过破坏微生物细胞膜,诱导胞内蛋白质错误折叠及引发DNA 损伤等途径发挥抑菌作用[5-7],而细胞膜是胆盐攻击细菌的首要靶点,低浓度胆盐会影响细胞膜上蛋白和酶的活性[8],同时还会改变菌体的表面性质,如疏水性和表面电位[9-10];而高浓度的胆盐会直接溶解微生物细胞膜,致细胞破裂菌体死亡[11]。肠道益生菌在长期胆盐胁迫环境下形成一系列复杂的细胞表面蛋白抗性机制:一些膜转运蛋白能够将胞内胆盐转运到胞外,减轻其对菌体的毒性[12-13];另有一些膜蛋白,如唾液乳杆菌OppA 蛋白、艰难梭菌跨膜蛋白激酶PrkC、丙二酸杆菌tolC 编码蛋白具有维持细胞膜结构,减少胆盐进入,提高细菌耐受能力的功能[14-16]。此外,一些膜蛋白还具有感受胆盐胁迫,调控胞内胆盐应激机制的功能,如双歧杆菌中SenX3-RegX3 双组分调控系统[17]。目前大部分关于胆盐胁迫下表面蛋白的研究仅限于组学推测阶段[18-19],且乳酸菌抵抗胆盐的机制存在菌株特异性,例如:在胆盐应激下,唾液乳杆菌(Lacticaseibacillus salivarius)FWXBH36M1 中LSL_1568、LSL_1716 和LSL_1709 的相对表达与LSL_0951相比有显著变化,这些功能基因在唾液乳杆菌FJLHD9M1 中的相对表达水平呈相反趋势,其中LSL_0951 表现出比其它基因更高的表达水平[20]。探究乳酸菌表面蛋白在胆盐胁迫下的抗性机制,对于推动乳酸菌肠道适应机制研究具有十分重要的作用。
副干酪乳杆菌(Lacticaseibacillus paracasei)L9(CGMCC No.9800)分离自广西巴马长寿老人肠道[21],具有维持肠道菌群平衡,调节免疫系统,缓解过敏症状等益生作用[22-23]。在前期胆盐胁迫研究中,副干酪乳杆菌 L9 中假定表面蛋白LPL9_0968 所在操纵子基因均显著上调(9.67~23.75 倍),为所有差异表达基因中上调倍数最高[24]。本试验通过生物信息学分析发现,LPL9_0968编码一个属于LiaX 家族的表面蛋白,目前该家族蛋白仅在粪肠球菌的达托霉素抗性机制中有表述,研究显示这种表面蛋白可与抗生素结合,通过调控胞内LiaFSR 系统引起细胞膜结构变化,从而提升粪肠球菌的耐药性[25-26]。本文通过构建突变体及胆盐胁迫试验,验证LPL9_0968 蛋白在L9 胆盐胁迫抗性机制中的重要作用,探究失去该表面蛋白后,突变菌株对4 种组分胆盐的敏感性,以及细胞膜表面产生的电位、形态变化,通过生物信息学分析及模拟分子对接佐证该表面蛋白与胆盐组分之间结合方式及作用位点。本文首次探究了LiaX家族的表面蛋白在乳酸菌中的功能,对乳酸菌胆盐胁迫机制的研究提供参考。
1 材料与方法
1.1 材料、试剂与仪器
MRS(Man-Rogosa-Sharpe)培养基、LB(Luria-Bertani)培养基,广东环凯生物科技有限公司;红霉素、氨苄西林、FastPurebacterium DNA 试剂 盒、FastPureEndoFree Plasmid 试剂盒、T4 DNA 连接试剂盒,南京诺唯赞生物科技股份有限公司;混合牛胆盐,上海麦克林生化科技有限公司;牛磺酸胆盐、牛磺酸脱氧胆盐、甘氨酸胆盐、甘氨酸脱氧胆盐,美国Sigma 公司;E.coli DH5α,北京擎科生物科技有限公司;限制性内切酶,赛默飞世尔科技公司。
电穿孔仪,美国BIO-RAD;纳米粒度分析仪,NanoBrook 90plus,美国Bookhaven;场发射扫描电子显微镜(SU8220),日本JEOL。
1.2 菌株和载体
本研究用菌株和质粒列于表1 中。将副干酪乳杆菌L9 在MRS 培养基中37 ℃厌氧培养,大肠杆菌DH5α 在LB 培养基中37 ℃、200 r/min 振荡培养。在培养基中添加10 μg/mL 红霉素用于筛选副干酪乳杆菌L9 突变株,添加100 μg/mL 氨苄西林用于大肠杆菌DH5α 重组菌株筛选。加入不同浓度的牛混合胆盐(Ox-bile)和单一组分胆盐——牛磺酸胆盐(TCA)、牛磺酸脱氧胆盐(TDCA)、甘氨酸胆盐(GCA)、甘氨酸脱氧胆盐(GDCA)。

表1 本试验所用菌株和质粒Table 1 Strains and plasmids used in this study
1.3 DNA 操作技术
试验所用引物均为软件primer 5 设计(表2)。采用FastPurebacterium DNA 试剂盒提取副干酪乳杆菌L9 的基因组;采用FastPureEndoFree Plasmid 试剂盒提取大肠杆菌的质粒;采用Green Taq Mix DNA 聚合酶扩增DNA 片段;采用限制性内切酶进行DNA 酶切;用T4 DNA 连接试剂盒进行载体和片段的连接。采用热休克转化法将重组质粒引入大肠杆菌DH5α[28],采用电穿孔法将重组质粒引入副干酪乳杆菌L9[29]。所有重组菌株均通过DNA 测序(生工生物工程),并用DNAMAN 软件对测序结果进行比对分析。

表2 引物序列Table 2 Sequences of oligonucleotide primers
1.4 突变体菌株构建
利用同源重组单交换的方法构建LPL9_0968基因并插入失活突变体。首先用引物LPL9_0968-F 和LPL9_0968-R 扩增LPL9_0968 基因内部长度为400 bp(50~450 bp)的片段作为同源臂,该同源臂片段两侧包含Xba I 和EcoR I 限制性内切酶位点。然后,将所得同源臂片段和质粒pUC19E 均用Xba I 和EcoR I 酶切连接,并将连接产物热激转化入大肠杆菌DH5α 中,通过氨苄霉素筛选获得重组菌株,将提取获得的重组质粒命名为pUC19E0968。最后,利用电穿孔法将重组质粒pUC19E0968 电转入副干酪乳杆菌L9 中,自杀载体pUC19E0968 在乳酸菌中无法复制,在红霉素的筛选压下只能通过同源重组插入LPL9_0968 基因内部,导致该基因失活,产生的突变体被命名为LPL9_0968-。在红霉素耐药基因内部及LPL9_0968 基因组序列下游设计引物(总长2 396 bp),PCR 扩增后测序验证突变株LPL9_0968-是否构建成功。
同时,为了消除培养中红霉素对突变株菌株后续胆盐胁迫试验产生的影响,选择构建副干酪乳杆菌 L9 菌株α-半乳糖苷酶基因(melA,LPL9_2172)突变株作为对照菌株(LPL9_melA-)。
1.5 胆盐胁迫试验
将活化3 代后的LPL9_melA-和LPL9_0968-接种于含红霉素的MRS 液体培养基中培养至OD600nm=0.6,于常温下8 000×g 离心4 min,收集菌体,弃培养基后将菌体重悬于同体积新鲜MRS 液体培养基中,添加不同浓度的胆盐。继续培养2 h,通过梯度稀释法进行菌落计数,以不添加胆盐组为对照,计算胆盐胁迫下菌株的存活率。本试验中添加的胆盐组分及含量为:混合牛胆盐(Oxbile;0%,0.025%,0.05%,0.075%)、牛磺酸胆盐(TCA;0%,1.0%,2.0%,3.0%)、牛磺酸脱氧胆盐(TDCA;0%,0.2%,0.4%,0.6%)、甘氨酸胆盐(GCA;1.0%,2.0%,3.0%)和甘氨酸脱氧胆盐(GDCA;0%,0.025%,0.05%,0.075%)。所有试验至少进行3 个生物学重复,每个生物学重复均做3 份技术平行试验,用单因素方差分析(ANOVA)来评估数据。
1.6 Zeta 电位试验
Zeta 电位依照Giaouris 等[30]的方法进行测定:将LPL9_melA-和LPL9_0968-在含有红霉素的MRS 中培养12 h,收集菌体(6 000×g,10 min,4℃),用1.5 mmol/L 的NaCl 清洗菌体两遍并重悬至OD400nm=0.3。用纳米粒度分析仪测量其Zeta 电位数值。所有试验至少进行3 个生物学重复,每个生物学重复均进行3 份技术平行试验,使用单因素方差分析(ANOVA)来评估数据。
1.7 扫描电镜
将LPL9_melA-和LPL9_0968-培养至OD600nm=0.6,收集菌体,用0.85%的生理盐水洗涤2 次后,重悬于含胆盐(0.4% TDCA)的MRS 培养基中培养2 h。离心收集菌体,用4%戊二醛在4 ℃下过夜固定。用双蒸水洗涤3 次,然后,依次用30%,50%,70%,85%,95%,100%的乙醇浸泡13 min,6 000×g 离心5 min,弃上清,再用100%乙醇重复上述操作3 次,使用冷冻干燥机(宁波新芝SCIENTZ-10N)冻干成粉,用场发射扫描电子显微镜进行13 万倍和30 万倍放大成像。
1.8 生物信息学分析
通过 GenBank 及 KEGG 等数据库对LPL9_0968 基因进行原位分析;用TMHMM server v.2.0 工具分析相关蛋白中的跨膜区;用NCBI 中的Blast 工具进行蛋白同源序列的分析,并使用MEGA 软件,采用邻位相接法设置各分支的置信度,构建N-J 系统进化树。利用ClustalX 软件对LPL9_0968 相似蛋白序列进行比对,分析其保守位点。
1.9 分子对接
利用I-TASSER(https://zhanggroup.org//ITASSER/)服务器对LPL9_0968 进行蛋白三维结构建模,在PubChem 数据库中下载各胆盐组分的结构文件。以LPL9_0968 编码蛋白为受体,各胆盐组分分子为配体,运用Discovery Studio(DS)软件中CDOCKER 模块进行分子对接。在分子对接开始前使用DS 中Preparation Protein 对蛋白进行优化,Prepare Ligands 对配体进行优化,执行诸如删除重复、枚举异构体和互变异构体以及生成3D 构象等任务。准备结束后使用CDOCKER 模块进行对接,设置Pose Cluster Radius 为0.5 以确保对接构象尽可能具有多样性,其余参数默认。最终数据以-CDOCKER ENERGY为主,以-CDOCKER INTERACTION ENERGY 为辅,以Binding Energy、Ligand Energy 等数据为参考进行结果分析。
2 结果与分析
2.1 生物信息学分析结果
根据GenBank 和KEGG 等数据库的分析结果,副干酪乳杆菌L9 中LPL9_0968 基因所在操纵子的结构如图1 所示:LPL9_0968、LPL9_0969和LPL9_0970 3 个基因构成一个功能未知的操纵子。利用在线工具TMHMM server w.2.0 进行跨膜区域分析,结果(图2),LPL9_0969 和LPL9_0970分别编码两个89AA 和111AA 大小的跨膜区域蛋白,LPL9_0968 编码的493AA 蛋白则完全位于细胞外侧。通过Blast 进行蛋白序列比对,发现LPL9_0968 编码的蛋白属于LiaX 家族的膜蛋白,用MEGA 7.0 中的Neighorjoining 算法构建进化树,系统发育关系分析如图3 所示。LiaX 家族蛋白多存在于肠球菌属和乳酸菌干酪乳杆菌群中(干酪乳杆菌、副干酪乳杆菌、鼠李糖乳酪杆菌),在乳酸菌中该蛋白间相似度高达93.59%,而与粪肠球菌中的LiaX 蛋白从进化上看明显分为两个亚组,副干酪乳杆菌L9 中LPL9_0968 蛋白与粪肠球菌中的LiaX 蛋白序列相似度高达61.96%。通过ClustalX 序列比对结果发现(图4),LiaX 家族蛋白具有一些明显的保守区域,蛋白N 端1~30序列处存在多个保守氨基酸位点。此外,蛋白200~500 序列处也属于保守氨基酸较多的部分,其中包含多个天冬酰胺和甘氨酸(ng)保守位点。

图1 LPL9_0968 基因所在操纵子结构图Fig.1 The structure of the operon where the LPL9_0968 gene is located.
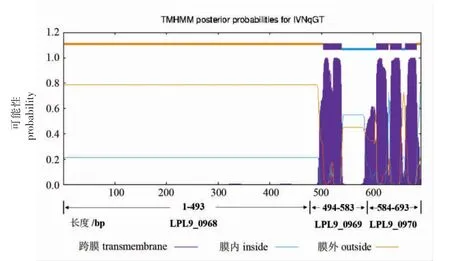
图2 LPL9_0968、LPL9_0969、LPL9_0970 基因蛋白跨膜区域分析Fig.2 Analysis of the transmembrane domain in LPL9_0968,LPL9_0969 and LPL9_0970 proteins
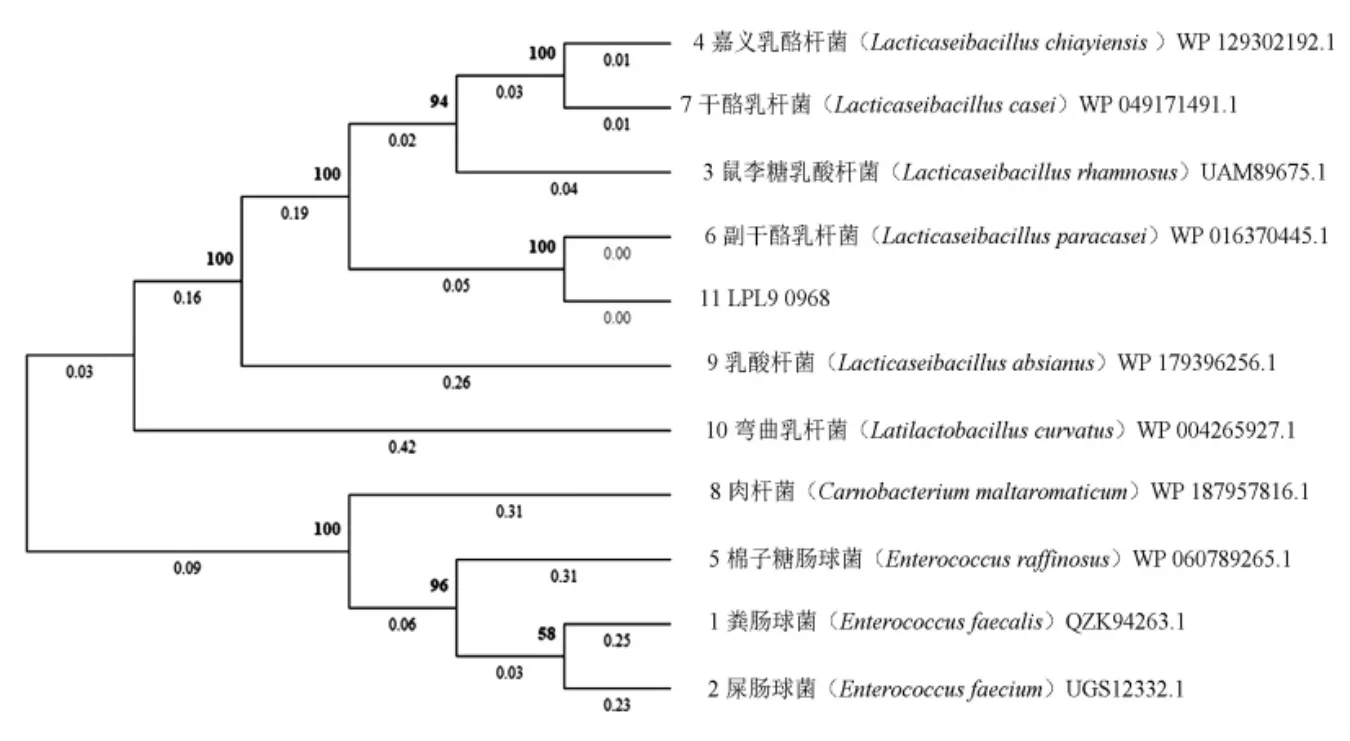
图3 Neighorjoining 法构建LiaX 家族蛋白系统进化树Fig.3 Phylogenetic tree of LiaX proteins constructed by Neighorjoining method
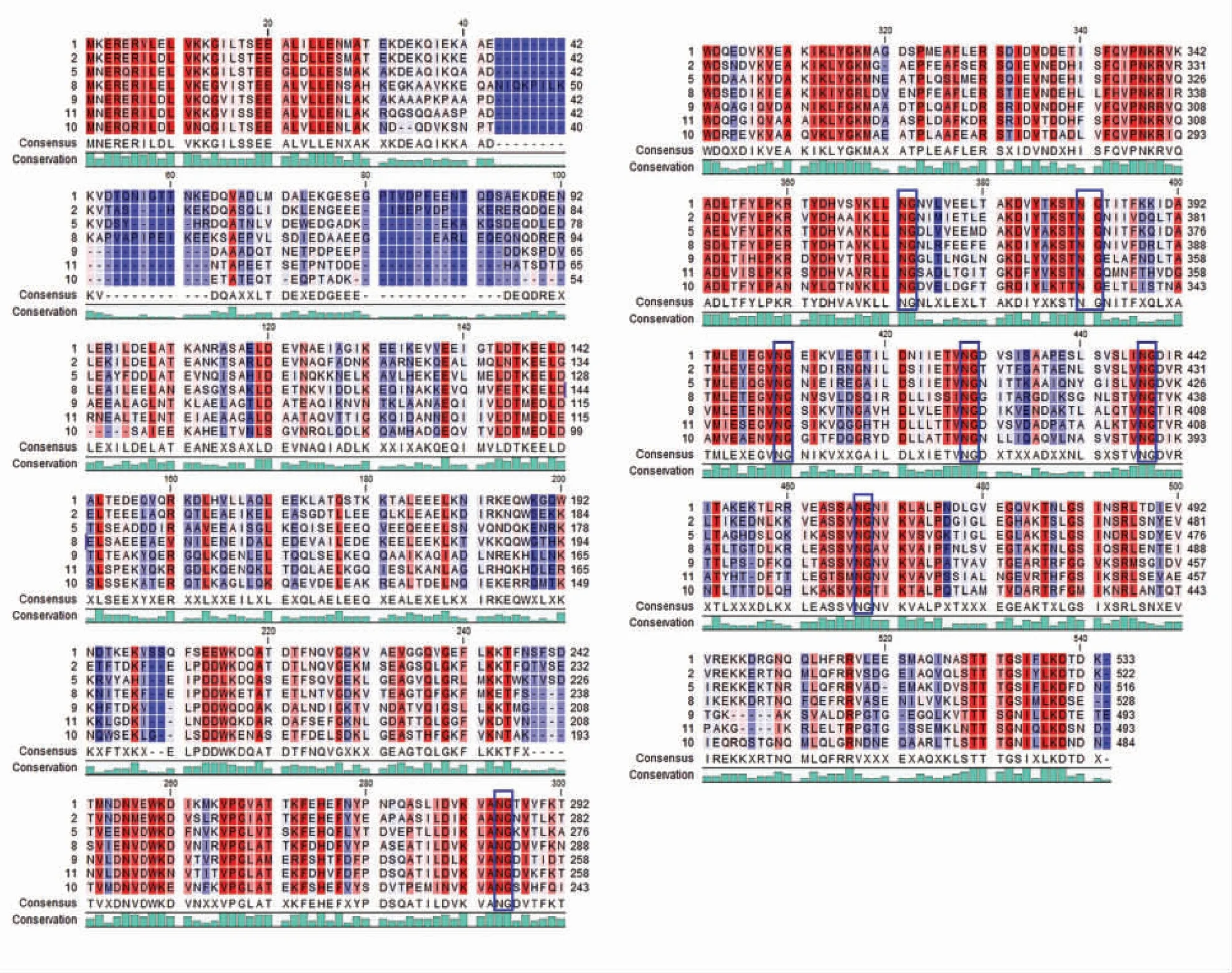
图4 假定表面蛋白LPL9_0968 与其它乳酸菌和肠球菌中LiaX 蛋白氨基酸序列的多重比对分析Fig.4 Multiple alignment of LPL9_0968 with LiaX proteins from other Lacticaseibacillus and Enterococcus.
目前该家族蛋白仅在粪肠球菌中被报道参与达托霉素抗药性机制[31]。研究发现,LiaX 膜蛋白存在胞外游离态和细胞膜结合态两种状态,能够根据环境中的达托霉素信号改变与细胞膜上蛋白的结合状态,从而激活菌体的达托霉素抗性相关基因[25]。推测LPL9_0968、LPL9_0969 和LPL9_0970 3个基因表达的蛋白可能共同构成一个细胞膜表面蛋白,其中LPL9_0969 和LPL9_0970 表达的蛋白构成跨膜锚定区域,LPL9_0968 通过与跨膜锚定区域蛋白相连而位于细胞膜表面。有研究表明,副干酪乳杆菌L9 在胆盐胁迫下,该操纵子中的3个基因转录水平分别上调9.67,10.33 倍和23.75倍[24],表明该表面蛋白很有可能参与副干酪乳杆菌L9 胆盐胁迫抗性机制。
2.2 突变体的构建及胆盐胁迫
为了研究LPL9_0968 相关基因在副干酪乳杆菌L9 胆盐胁迫中的作用,利用同源重组单交换的方法构建LPL9_0968 基因,插入失活突变株LPL9_0968-,试验原理见图5。PCR 扩增及测序结果表明(数据未显示),自杀载体pUC19E0968 已成功插入副干酪乳杆菌L9 基因组LPL9_0968 基因内部,整个操纵子均已失活。同理,本试验成功构建了α-半乳糖苷酶基因melA 突变株LPL9_melA-作为对照菌株。对突变株LPL9_melA-和LPL9_0968-进行混合牛胆盐胁迫试验,结果如图6 所示:在质量分数0.025%,0.050%和0.075%混合牛胆盐含量下,LPL9_0968 基因突变株的胆盐耐受能力均低于对照组,其中质量分数0.075%下LPL9_0968-存活率为4.2%,与对照组相比降低10.17 倍,存在显著性差异(P<0.05)。这表明LPL9_0968 及其相关基因所构成的表面蛋白在副干酪乳杆菌L9 胆盐抗性机制中具有重要作用。

图5 基于同源重组单交换原理构建LPL9_0968-基因突变菌株Fig.5 Construction of L.paracasei mutant strain LPL9_0968- based on homologous recombination single crossover

图6 LPL9_melA- and LPL9_0968- 在牛混合胆盐胁迫下的存活率Fig.6 Survival rate of recombination strain LPL9_melA- and LPL9_0968- under Ox-bile stress
2.3 单一组分胆盐胁迫试验
为了研究该表面蛋白在胆盐胁迫抗性机制中是否对不同胆盐组分具有特异性,采用4 种单一胆盐组分(TCA、TDCA、GCA、GDC)来评估突变株LPL9_melA-和LPL9_0968-的胆盐耐受能力,结果见图7。在4 种单一胆盐胁迫下,LPL9_0968-存活率与LPL9_melA-相比均出现不同程度的下降,在质量分数3.0%的TCA 中,LPL9_0968-存活率显著下降1.95 倍(P<0.05);在质量分数0.4%的TDCA中,LPL9_0968-存活率显著下降2.85 倍(P<0.05);在质量分数2.0%的GCA 中,LPL9_0968-存活率显著下降2.05 倍(P<0.05);在质量分数0.15%的GDCA 中,LPL9_0968-存活率显著下降8.21 倍(P<0.05),下降程度最高。以上结果表明,试验菌株和对照菌株对TDCA 和GDCA 的耐受能力明显低于TCA 和GCA,这与脱氧结合型胆盐有更强的毒性有关[32]。此外,在4 种结合型胆盐中,突变株对甘氨酸脱氧胆盐更为敏感,表明LPL9_0968 表面蛋白在菌株胆盐抗性中对甘氨酸脱氧胆盐具有特异性。
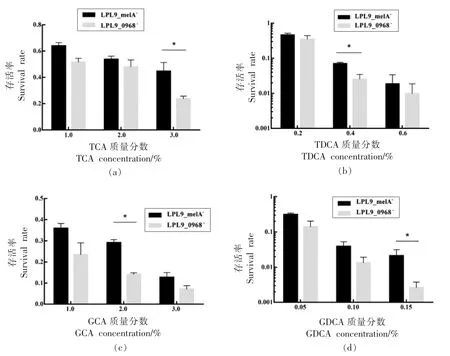
图7 LPL9_melA- and LPL9_0968-在单一组分胆盐胁迫下的存活率Fig.7 Survival rate of mutant strains LPL9_melA- and LPL9_0968- under different kind of bile salt stress
2.4 Zeta 电位
为了进一步探究LPL9_0968 假定表面蛋白在副干酪乳杆菌L9 胆盐抗性中的作用机制。通过Zeta 电位考察突变菌株表面所带电荷量的变化,结果见图8。LPL9_0968-的表面电位显著低于LPL9_melA-(P<0.05),负值增大。这表明LPL9_0968膜蛋白缺失后,菌体的双电层吸附层的负电荷增加,从而反映菌体表面所带的正电荷增加,这可能导致膜电位的紊乱,细胞膜稳定性降低,菌株的胆盐耐受能力降低。

图8 LPL9_melA-和LPL9_0968- Zeta 电位Fig.8 Zeta potential of LPL9_melA- and LPL9_0968-
2.5 扫描电镜结果
为了验证LPL9_0968 蛋白缺失引起的菌体Zeta 电位下降会导致突变株更易受胆盐的攻击,用场发射扫描电子显微镜观察胆盐胁迫下LPL9_melA-和LPL9_0968-细胞表面的形态结构。结果如图9 所示,经2 h,0.4% TDC 的胁迫后,LPL9_0968-菌体表面形态的完整性明显差于对照组LPL9_melA-,出现较多的粗糙和萎缩现象(绿色箭头处)。这表明LPL9_0968-在相同浓度胆盐胁迫下,细胞膜受损和细胞内含物泄露更为严重。

图9 场发射扫描电子显微镜观察LPL9_melA-和LPL9_0968-胆盐胁迫下菌体形态Fig.9 The morphology of LPL9_melA- and LPL9_0968- under bile stress by FESEM.
3 讨论
细胞膜是胆盐攻击细菌的首要目标,而表面蛋白作为第1 道防线,通过多种机制抵抗胆盐胁迫,以提高细菌的生存能力[5]。LPL9_0968,LPL9_0969 和LPL9_0970 是副干酪乳杆菌L9 基因组中一组功能未知的假定膜蛋白,在前期胆盐胁迫相关研究中,该组基因在胆盐胁迫下转录水平上调倍数为全基因组中最高。通过构建插入失活突变体及胆盐胁迫试验,成功证明LPL9_0968相关的假定膜蛋白参与副干酪乳杆菌L9 的胆盐抗性机制。然而,通过分析可知LPL9_0968 假定蛋白为膜表面蛋白,并不具有膜内部分及跨膜转运通道,因此不具有转运胆盐的能力。
经分析比对,LPL9_0968 基因编码的蛋白属于LiaX 家族表面蛋白,与粪肠球菌中的LiaX 蛋白具有很高的相似性。LiaX 蛋白在粪肠球菌中是细菌抵抗达托霉素的表面响应蛋白,它能够感受胞外抗达托霉素分子,通过与细胞表面LiaFSR 调节蛋白结合,激活细胞膜表面的多种蛋白响应机制来修复因外界胁迫而导致的细胞膜完整性受损[25,31,33]。推测副干酪乳杆菌L9 中的LPL9_0968蛋白很可能也通过感受胆盐信号,调控相关膜蛋白基因的表达,从而在胆盐胁迫下维持细胞膜的平衡,抵抗胆盐胁迫。Zeta 电位结果反映突变体表面正电荷量增加,而结合型胆盐在溶液中会解离成为带负电的分子,菌体表面正电荷增加可能导致胆盐分子吸附增多,细胞膜受到更为严重的破坏。通过扫描电镜观察胆盐胁迫下的菌体表面,证实了这一结果,表明LPL9_0968 参与了维持细胞表面电荷稳定与细胞膜完整性的过程。
为了进一步探讨LPL9_0968 蛋白是否能感受胆盐分子信号,通过分子对接来考察假定表面蛋白与胆盐组分的相互作用。通过I-TASSER 网站建立LPL9_0968 蛋白模型(图10),利用DS 将蛋白与4 种单一胆盐组分对接,结果表明:蛋白与胆盐组分之间存在以氢键为主的相互作用(图11)。4 种胆盐与LPL9_0968 蛋白对接所产生的结合能均为负值,说明二者间发生结合的可能性很大,且发生结合后的状态相对稳定。LPL9_0968 与GDCA 间还存在电荷之间的吸引力,并且胆盐分子与LPL9_0968 相互作用的区域是LiaX 家族蛋白序列300~500 部分氨基酸保守度较高的区域,该区域可能与感受环境信号分子相关,同时也可能控制LiaX 与膜上蛋白结合或分离。通过比对发现,LPL9_0969 和LPL9_0970 与粪肠球菌中LiaFSR蛋白相似度并不高,且未在副干酪乳杆菌L9 中找到与之相似的同源蛋白,因此LPL9_0968 感受胆盐胁迫参与调控机制尚待探究。
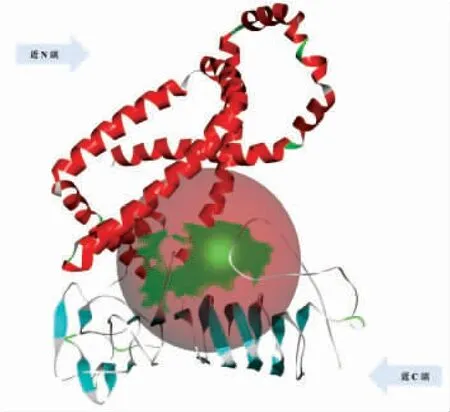
图10 同源建模Fig.10 Homology modeling
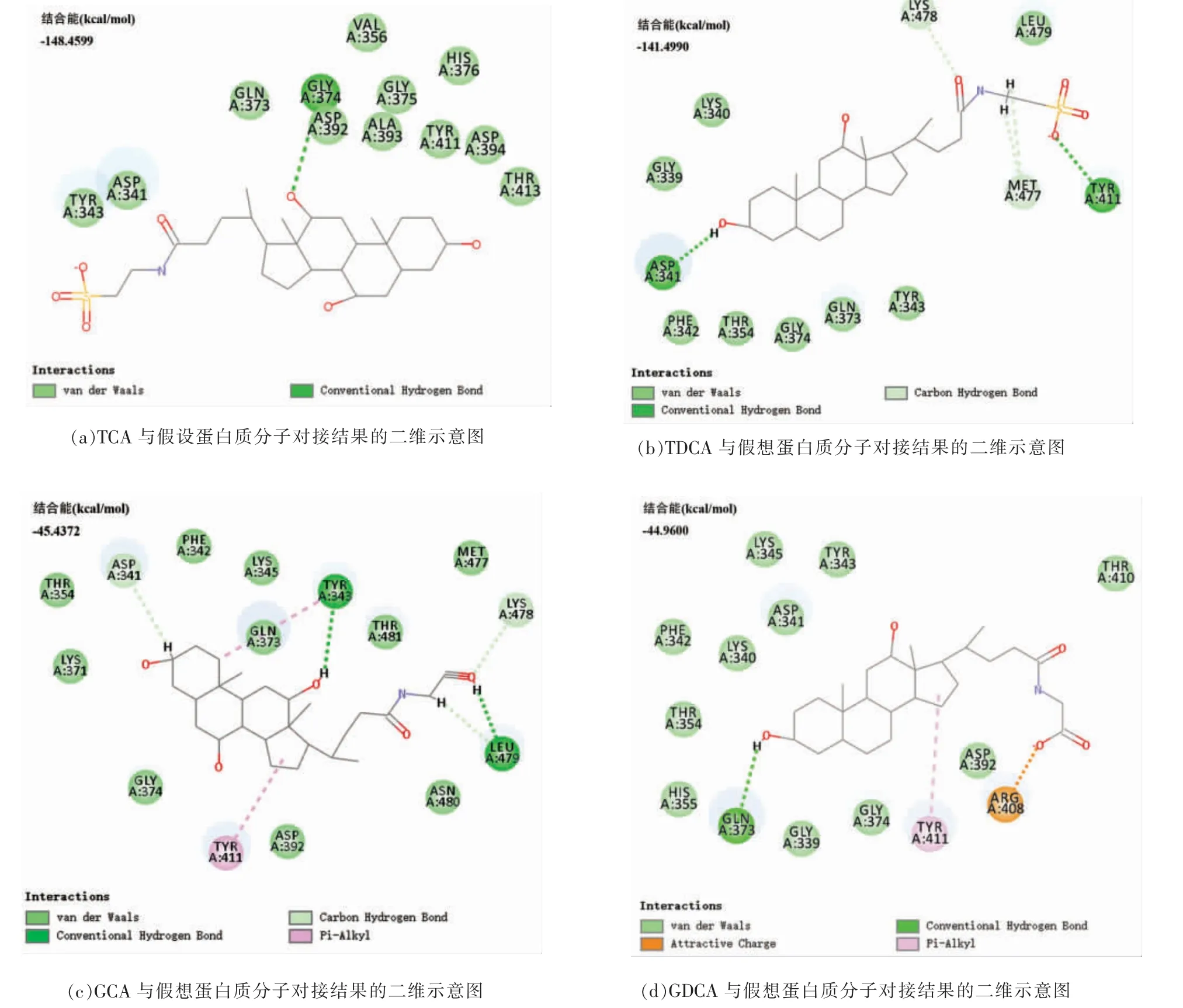
图11 假定表面蛋白与4 种胆盐组分模拟分子对接的结合能及对接结果2D 示意图Fig.11 2D schematic diagram of binding energy and docking results between hypothetical surface protein and four simulated bile salt components
4 结论
本研究首次报道乳酸菌中的LiaX 家族表面蛋白LPL9_0968,采用生物信息学分析对其基因结构、蛋白序列保守性及其与肠球菌中LiaX 家族蛋白的关系进行初步分析,同时探究了LPL9_0968 的功能,确定其参与副干酪乳杆菌L9胆盐胁迫抗性机制。该蛋白可能通过维持细胞膜的平衡及完整性来提高菌株的胆盐耐受能力。通过分子对接推测该表面蛋白可能与胆盐组分存在相互作用,可作为胆盐胁迫的表面响应蛋白,参与胞内未知的调控。
致谢
感谢长沙理工大学创新项目:假定表面蛋白LPL9_0968 在副干酪乳杆菌L9 胆盐胁迫应激中的作用对本试验给予的经费支持。

