不同程度颈动脉狭窄对大鼠脑缺血再灌注损伤的影响
向入平,陈 琼,崔 嵘,余辉云,周美君,李 枝,黄玉涓,余 成
(湖南师范大学附属长沙医院/长沙市第四医院,长沙 410006)
缺血性脑卒中(ischemic stroke,IS)是神经系统的常见病和多发病,具有高发病率、高死亡率、高致残率等特点,是目前人类疾病主要死亡原因之一[1]。现有研究表明,30%的缺血性脑卒中是由颈动脉狭窄(carotid artery stenosis,CAS)引起的[2];颈动脉狭窄程度与缺血性脑卒中发生率呈正相关,常被作为卒中患者危险性的评估依据之一[3]。CAS 可以导致IS 发生,但目前关于CAS 对脑缺血再灌注损伤的影响及作用机制尚不清楚,本研究通过建立不同程度大鼠颈动脉狭窄缺血再灌注模型,通过观察缺血再灌注后缺血半暗区病理、神经细胞凋亡和XIAP、Smac 蛋白表达的变化,探讨不同程度颈动脉狭窄对大鼠脑缺血再灌注损伤的影响及其机制。
1 资料与方法
1.1 实验动物与实验试剂 SPF 级健康雄性SD 大鼠,8 周龄,体重260~310 g,均购自于湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2016-0002。Smac 抗体和XIAP 抗体,均购自于北京博奥森生物技术有限公司。TUNEL 细胞凋亡检测试剂盒购自于上海七海复泰生物科技有限公司。总RNA 提取试剂盒购自于北京索莱宝科技有限公司;通用逆转录试剂盒和Realtime PCR 荧光定量试剂盒均购自于上海翊圣生物科技有限公司。显微镜和成像系统购自于日本尼康公司。
1.2 动物模型的制备与实验分组 参照Zhou[4]等的方法制备轻、中、重度颈动脉狭窄大鼠模型。大鼠于术前8~12 h 禁食,自由饮水,经乙醚诱导麻醉,仰卧固定,颈正中去毛备皮消毒后,行颈正中切口2~3 cm,分离颈总动脉,在颈动脉近心侧距颈内动脉和颈外动脉分叉处约1.5 cm 平行放置0.45mm(轻度狭窄)、0.7 mm(中度狭窄)、0.9 mm(重度狭窄)不同直径的注射用针头,用0 号手术缝线结扎颈总动脉和针头,然后小心拔出针头剪断丝线,缝合皮肤,肌注40 万单位青霉素预防感染。建立颈总动脉狭窄模型,将造模大鼠分为轻度狭窄组、中度狭窄组、重度狭窄组。颈总动脉分离未结扎的大鼠作为对照组。
以上4 组大鼠,普通饲料喂养30 d。30 d 后,所有实验大鼠参照Longa[5]等方法行大脑中动脉脑缺血-再灌注处理。用乙醚诱导麻醉大鼠,颈正中切口,分离颈总动脉、颈外动脉和颈内动脉,在颈外动脉距离颈动脉分叉处约17~18mm 处结扎,在结扎处的近端将颈外动脉离断并反折致残端与颈内动脉呈一直线,用一根直径为30mm 的钝头尼龙缝线自颈外动脉残端向颈内动脉缓缓插入,直到感觉到轻微的阻力不能进线时停止插线,将颈外动脉残端及尼龙线栓一同结扎,记录时间作为动脉阻塞开始时间,缝合伤口。在手术过程中,通过加热灯监测直肠体温并保持在36.5~37.0℃之间,分别于阻塞12 h 和24 h 后取下尼龙缝线恢复血供。对照组、轻度狭窄组、中度狭窄组和重度狭窄组4 组大鼠根据动脉阻塞时间每组内各又随机分成12 h、24 h 两个亚组,每个亚组入组大鼠5 只。恢复血供24 h 后对大鼠实施安乐死,取脑组织。
1.3 病理变化观察 各组大鼠脑组织在4%多聚甲醛中固定12 h,将标本包埋切片,切片厚度5μm,PBS 冲洗3 次,每次10 min,装片。切片制备后,在68℃下苏木精染色5min,盐酸乙醇分化。将样品用体积分数为1%的氨水还原成蓝色,用伊红染液染色,用自来水冲洗30 s,最后用酒精脱水。将用二甲苯封闭的切片置于×200 显微镜下观察脑组织的病理变化。
1.4 神经细胞凋亡检测 脑组织切片准备好后,在3%过氧化氢溶液孵化5 分钟,在100℃下0.05 mol / L柠檬酸溶液修复10 分钟,15%脱脂奶粉封闭1 h。1:500 TUNEL 检测溶液室温下黑暗中孵化90 分钟,37℃下1:500 荧光素抗体孵化60 分钟,与PI 染色液反应5 min,60℃干燥。最后在荧光显微镜下观察并拍照。用 Image 软件统计显微镜视野中亮绿光的凋亡细胞数,计算每个样本细胞凋亡阳性率=阳性凋亡细胞数/总细胞数×100%。
1.5 XIAP、Smac 蛋白表达检测 严格按照总RNA 提取试剂盒、逆转录试剂盒和Realtime PCR 荧光定量试剂盒说明书中方法,用Trizol 从脑组织中提取总RNA,逆转录酶逆转录总RNA,使用Hieff ® qPCR SYBR 在检测系统中进行RT-qPCR。以2-ΔΔCt法(Livak 法)进行定量分析。
1.6 统计分析 实验数据以平均值±标准差表示,多组间比较采用单因素方差分析法。数据使用SPSS 26.0软件进行统计分析,检验水准α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 不同程度CAS 对缺血半暗带的形态学影响 对照组神经元结构正常,核仁清晰。轻度狭窄组、中度狭窄组和重度狭窄组梗死侧脑组织疏松,细胞结构紊乱、细胞空泡样变、细胞核裂解、胞浆染色较深;且随着狭窄程度的加重,脑损伤程度加深,胞浆染色加深,细胞核裂解加重;缺血再灌注时间越长,损伤程度亦越严重。结果见图1。
2.2 不同程度的CAS 对缺血半暗区细胞凋亡的影响缺血再灌注12 h,重度狭窄组神经细胞凋亡阳性率明显高于对照组、轻度狭窄组、中度狭窄组(P<0.05);缺血再灌注24 h,较对照组,轻度狭窄组、中度狭窄组和重度狭窄组神经细胞凋亡阳性率均明显升高(P<0.05)。同组间,缺血再灌注24 h 较12 h 神经细胞凋亡阳性率均明显升高(P<0.05)。结果见图2,表1。
2.3 不同程度CAS 对缺血半暗带XIAP 和Smac 表达的影响 缺血再灌注12 h 和24 h,与对照组相比,中度狭窄组和重度狭窄组XIAP 表达均显著上调(P<0.05)。缺血再灌注24 h,不同程度颈动脉狭窄组间比较显示,狭窄程度越重,XIAP 表达越高。同组间,缺血再灌注24 h 较12 h XIAP 表达均明显升高(P<0.05)。结果见表2。
缺血再灌注12 h 和24 h,与对照组相比,中度狭窄组和重度狭窄组Smac 表达均显著上调(P<0.05);不同程度颈动脉狭窄组间比较显示,狭窄程度越重,XIAP表达越高。结果见表3。
3 讨论
IS 病理过程的基本因素是血管狭窄或闭塞导致了局部脑组织血流量的下降,及时恢复血流供应是IS 患者临床治疗的关键。但是,当受阻血管再通或建立并开放侧支循环恢复血流供应后,脑组织损伤程度反而进一步加重,即“脑缺血/再灌注损伤(cerebral ischemia reperfusion injury,CIRI)”。本研究建立了大鼠不同程度颈动脉狭窄脑缺血再灌注模型,并与正常缺血再灌注大鼠进行比较,研究发现,颈动脉狭窄可加重脑缺血再灌注后神经细胞凋亡,且随着颈动脉狭窄程度的加重,神经细胞的破坏程度加重。这一结果提示在IS 的临床防治中,需要密切关注颈动脉狭窄带来的潜在危害,在脑缺血时不但要考虑及时恢复血液供应,同时也应该重视对神经细胞的保护,从而减少再灌注后造成的继发性损伤。

图1 不同组别大鼠脑组织病理改变(HE染色,×200)
CIRI 的发生机制较为复杂,目前研究报道的主要有能量代谢障碍[6]、氧化应激[7]、细胞凋亡[8]、炎症反应[9]等。其中,细胞凋亡不仅参与了CIRI 的过程,并与炎症反应、自由基损伤等目前已知导致CIRI 的其它作用机制密切相关[10],是介导CIRI 主要的机制之一,能够促进神经功能损伤进行性发展。本研究结果显示,与对照组相比,中度狭窄组和重度狭窄组神经细胞凋亡阳性率明显升高,说明中、重度CAS 可促进缺血半暗带区细胞凋亡。
细胞凋亡的机制非常复杂,其中XIAP/Smac 信号的激活起着关键作用,XIAP 和Smac 是细胞凋亡途径中的重要蛋白[11-12]。XIAP 被认为是迄今作用最强的内源性Caspase 抑制因子,能通过抑制Caspase-3[13]、Caspase-7[13]、Caspase-9[14]等多种途径发挥抗凋亡作用;而Smac 的表达增加能竞争性地与XIAP[15]、 c IAP1[16]等相互作用,解除XIAP 对Caspase-3、Caspase-7、Caspase-9 的抑制发挥促凋亡作用。Zhang[17]等研究发现Caspase9 与XIAP 在缺血半暗区通过转亚硝化反应相互作用,从而导致细胞凋亡;Siegelin[18]等和Saito[19]等发现在小鼠局灶性脑缺血再灌注和大鼠海马脑缺血再灌注后,Smac 的合成增加,提示Smac 参与了脑缺血后神经元的死亡过程;Lotocki[20]等研究表明,抑制XIAP/Smac 信号通路的活性可以减缓缺血再灌注对缺血半暗区的损伤;这些结果与我们的发现相似。在本研究中,我们发现,缺血再灌注12 h和24 h,中度和重度狭窄组缺血半暗区XIAP 和Smac的表达显著上调,且随着CAS 程度加重,XIAP 和Smac的表达越高。由此可见,CAS 可诱导XIAP/Smac 信号通路的激活,从而启动细胞凋亡。
本研究发现,CAS 能加重脑缺血再灌注损伤,且随着狭窄程度的加重和再灌注时间的延长,损伤进一步加重;其机制与激活XIAP/Smac 信号通路,诱导神经细胞凋亡有关。因此,密切关注颈动脉狭窄的潜在危害,及时恢复再灌注的同时对神经细胞加以保护是临床防治急性缺血性脑损伤的关键。CAS 介导脑缺血再灌注损伤加重的机制是否还与能量代谢、氧化应激、炎症反应等其他途径有关,有待进一步深入研究,以期为IS 的临床防治提供更丰富的基础理论依据。

图2 不同组别大鼠脑组织细胞凋亡阳性率检测(TUNEL染色,×400)
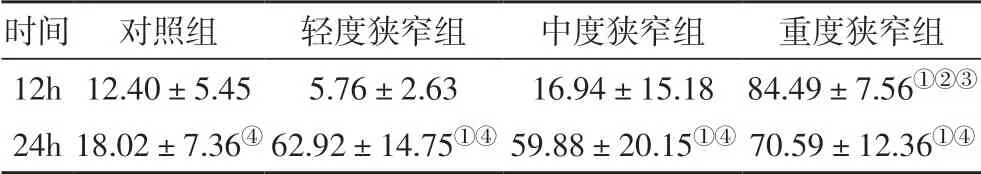
表1 不同组别大鼠细胞凋亡阳性率(%)
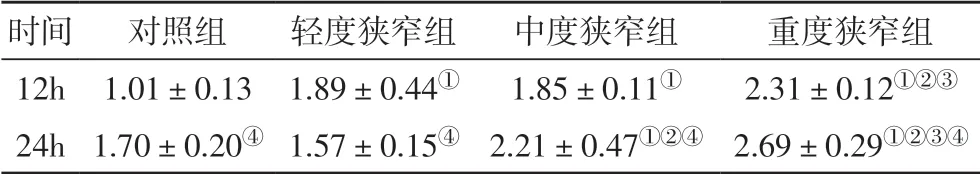
表2 不同组别大鼠缺血半暗区XIAP蛋白表达

表3 不同组别大鼠缺血半暗区Smac蛋白表达

