血小板/淋巴细胞在贝伐珠单抗联合化疗治疗晚期非小细胞 肺癌中的预测价值
陈忆玲,周光华 ,郝 娟
(湖南师范大学第二附属医院,中国人民解放军联勤保障部队第九二一医院,长沙 410003)
非小细胞肺癌(non-small celllung cancer,NSCLC)约占肺癌的80%以上[1],其恶性程度高,大部分患者确诊时已是晚期,而在晚期非鳞NSCLC 患者中,贝伐珠单抗是第一个被证明与化疗药物联用可增加患者存活时间的血管生成抑制剂[2],它是单克隆抗体中的一种,可以与VEGF-A 结合,从而阻止其受体(VEGFR)的激活,并减少肿瘤组织中新生血管的形成[3]。但到目前为止,仍未发现可以用来预测贝伐珠单抗疗效的可靠生物标志物[4]。众所周知,炎症因子在肿瘤释放的炎症介质作用下参与肿瘤的增殖及血管生成过程[5]。血小板与淋巴细胞的比值(Platelet-lymph ratio,PLR)是近年研究的热门,越来越多的研究表明,PLR 与肝癌[6]、结直肠癌[7]、胃癌[8]等患者的预后有关。有研究证实,血清VEGF 浓度与血小板计数呈正相关[9],而VEGF 正是贝伐珠单抗的作用靶点[10]。鉴于炎症因子和血管生成、贝伐珠单抗之间已经出现的密切关系,PLR 作为贝伐珠单抗疗效的预测因子是有可能的。如果得到验证,那么就能为NSCLC 患者提供一种可重复、廉价且简单的方法来选择贝伐珠单抗治疗的候选者。故本研究通过回顾性分析,探讨贝伐珠单抗治疗晚期NSCLC 时,治疗前PLR 对其疗效和预后的预测作用,现报道如下。
1 资料与方法
1.1 一般资料 本研究对2015 年1 月~2019 年6 月期间于解放军第921 医院诊疗的晚期NSCLC 患者140例进行回顾性研究。病例纳入标准:(1)年龄≥18 岁;(2)均经细胞学或组织学明确诊断为NSCLC;(3)临床分期为Ⅲ-Ⅳ期;(4)ECOG(Eastern Cooperative Oncology Group,美国东部肿瘤协作组)评分≤2 分;(5)无靶向治疗与化疗禁忌症;(6)有评价病情的客观指标。病例剔除标准:(1)有手术治疗或放射治疗史;(2)随访资料不完整;(3)不能明确疗效;(4)首诊时合并有血液系统疾病或全身感染。
1.2 临床资料 对患者的临床资料进行分析,收集淋巴细胞计数、血小板计数、年龄、性别、是否吸烟、ECOG 评分情况、分化程度、临床分期、有无接受贝伐珠单抗治疗等。
1.3 随访 通过电话询问、门诊复查对患者进行随访,获得患者的中位无进展生存期(PFS)及总生存时间(OS)。随访截至2020 年6 月1 日。PFS 指从确诊疾病开始到发现疾病进展或患者死亡的时间间隔(以先发生的情况为准)。OS 指从确诊疾病开始到患者死亡的时间。
1.4 研究方法 将140 例晚期NSCLC 患者分为两组,贝伐珠单抗+化疗治疗者70 例为A 组,单纯化疗者70 例为B 组。使用SPSS 22.0 中的ROC 曲线进行统计分析,确定PLR=174 为界值,将A 组患者分为低PLR组A1(PLR <174,n=34)和高PLR 组A2(PLR ≥174,n=36),B 组患者分为低PLR 组B1(PLR <174,n=32)和高PLR 组B2(PLR ≥174,n=38)。按分组对每组患者的临床资料进行分析。
1.5 统计方法 通过 SPSS 22.0 统计软件进行数据处理,各组间的临床特征对比采用χ2检验。采用 Kaplan -Meier 法绘制生存分析曲线图,并行 Log-rank 检验比较不同组别生存率,采用 Cox 比例风险回归模型行多因素预后分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗前PLR 分别与A、B 两组晚期(NSCLC)患者临床特征的关系 对PLR 与A 组NSCLC 患者的临床特征进行分析,结果发现:A1(PLR <174,n=34)与A2(PLR ≥174,n=36)在ECOG 评分、临床分期等分布情况比较,差异有统计学意义(P<0.05),而在性别、年龄、是否吸烟、分化程度等分布情况比较,差异均无统计学意义(P>0.05)。对PLR 与B 组NSCLC 患者的临床特征进行分析,结果发现:B1(PLR <174,n=32)和B2(PLR≥174,n=38)在是否吸烟、ECOG 评分、分化程度等分布情况比较,差异有统计学意义(P<0.05),而在性别、年龄、临床分期等分布情况比较,差异均无统计学意义(P>0.05),结果见表1。
2.2 治疗前PLR 分别与A、B 两组晚期(NSCLC)患者的生存分析 A 组(贝伐珠单抗+ 化疗)患者中A1(PLR <174)组与A2(PLR ≥174)组的中位PFS 为19 个月(95%CI=16.163~21.837)和9 个月(95%CI=6.795~11.205),差异有统计学意义(P<0.05);A1(PLR <174)组与A2(PLR ≥174)组的中位OS 为28 个月(95%CI=21.515~34.485)和19 个月(95%CI=12.735~25.265),差异有统计学意义(P<0.05)(图1)。B 组(单纯化疗)患者中B1(PLR <174)组和B2(PLR ≥174)组的中位PFS 为11 个月(95%CI=9.900~12.100)和9 个月(95%CI=7.834~10.166),差异有统计学意义(P<0.01);B1(PLR <174)组和B2(PLR ≥174)组的中位OS 为26 个月(95%CI=23.369~28.631)和19 个月(95%CI=18.138~19.862),差异有统计学意义(P<0.01),结果见图2。
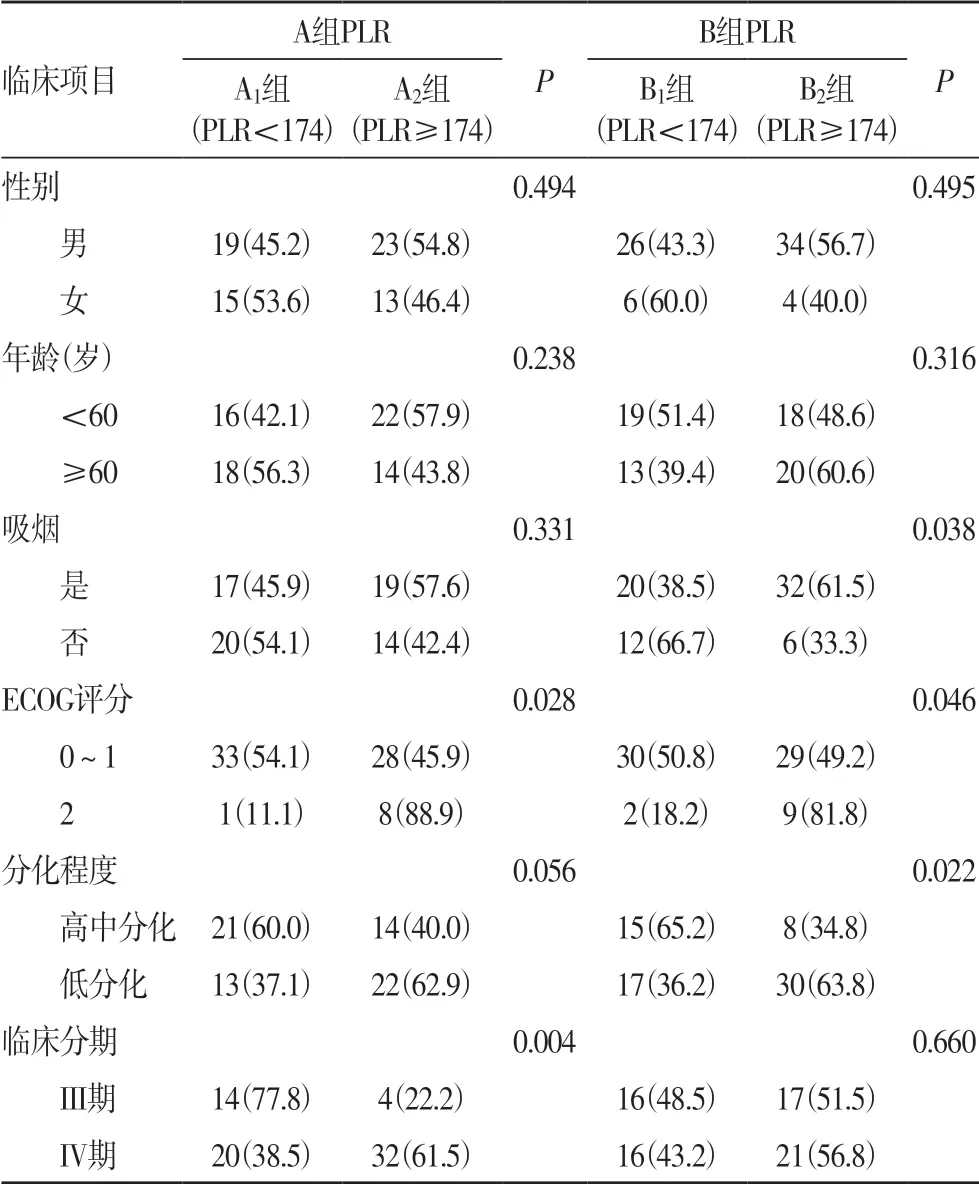
表1 A、B两组PLR与各临床因素的关系[n(%)]
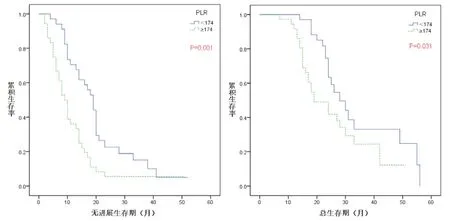
图1 A组(贝伐珠单抗+化疗)NSCLC患者中A1(PLR<174)组与A2(PLR≥174)组的无进展生存曲线和总生存曲线图
2.3 低P L R 组与高P L R 组晚期(N S C L C)患者的生存分析 低P L R 组患者中(化疗+ 贝伐珠单抗)A 1 组与(单纯化疗)B 1 组的中位P F S为19 个月(95%CI=16.163~21.837)和11 个月(95%CI=9.900~12.100),差异有统计学意义(P<0.05);中位O S 为2 8 个月(9 5%C I=2 1.5 1 5 ~3 4.4 8 5)和26 个月(95%CI=23.369~28.631),差异无统计学意义(P>0.05)(图3)。高PLR 组患者中(化疗+ 贝伐珠单抗)A 2 组与(单纯化疗)B 2 组的中位PFS 为9 个月(95%CI=6.795~11.205)和9 个月(95%CI=7.834~10.166),差异无统计学意义(P>0.05),中位OS 为19 个月(95%CI=12.735~25.265)和19 个月(95%CI=18.138~19.862),差异无统计学意义(P>0.05)(图4)。
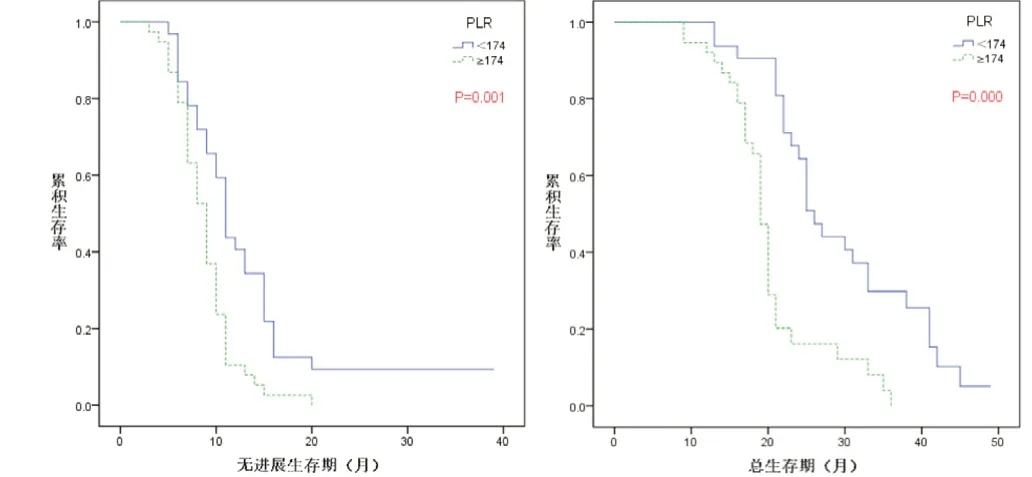
图2 B组(单纯化疗)NSCLC患者中B1(PLR<174)组和B2(PLR≥174)组的无进展生存曲线和总生存曲线图
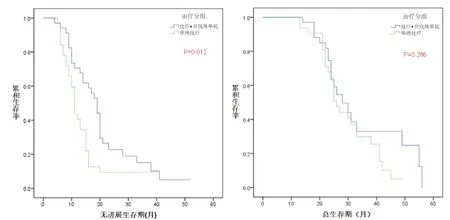
图3 PLR<174的NSCLC患者中A1组(化疗+贝伐珠单抗)与B1组(单纯化疗)的无进展生存曲线和总生存曲线
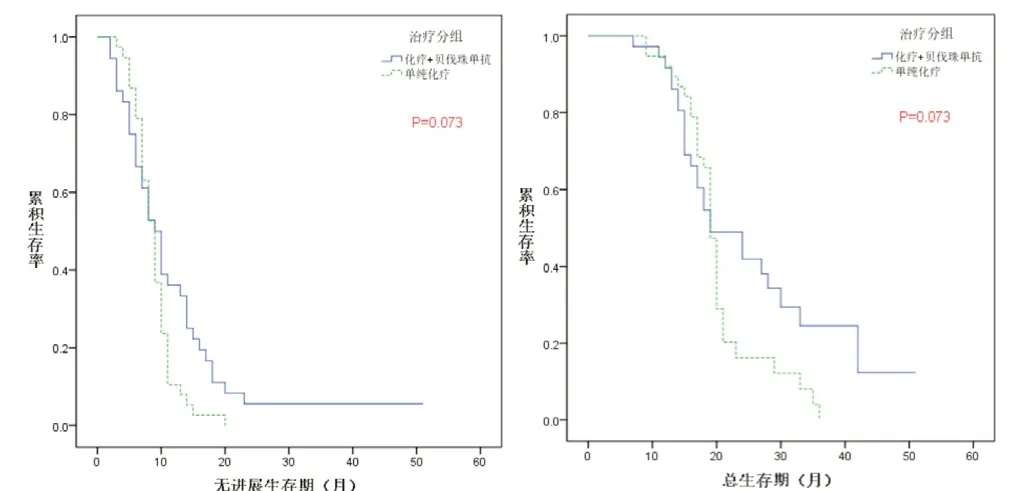
图4 PLR≥174的NSCLC患者中A2组(化疗+贝伐珠单抗)与B2组(单纯化疗)组的无进展生存曲线和总生存曲线
2.4 多因素分析A、B 两组晚期(NSCLC)患者预后的风险因素 将A 组(化疗+贝伐珠单抗)患者的性别、年龄、吸烟、ECOG 评分、分化程度、临床分期、PLR 等应用COX 风险回归进一步分析,结果得出分化程度(HR=1.794,95%CI=1.034~3.112,P<0.05)、PLR(HR=1.800,95%CI=1.006~3.220,P<0.05)可作为A 组晚期NSCLC 患者PFS 的预后因素,分化程度(HR=2.824,95%CI=1.443~5.524,P<0.05)是A 组晚期NSCLC 患者OS 的独立预后因素。结果见表2。将B组(单纯化疗)患者的性别、年龄、吸烟、ECOG 评分、分化程度、临床分期、PLR 等应用COX 风险回归进一步分析,PLR(HR=2.342,95%CI=1.313~4.178,P<0.05)可作为B 组晚期NSCLC 患者PFS 的预后因素,ECOG评分(HR=2.237,95%CI=1.068~4.683,P<0.05)、PLR(HR=3.530,95%CI=1.904~6.543,P<0.01)是B 组晚期NSCLC 患者OS 的独立预后因素,结果见表3。
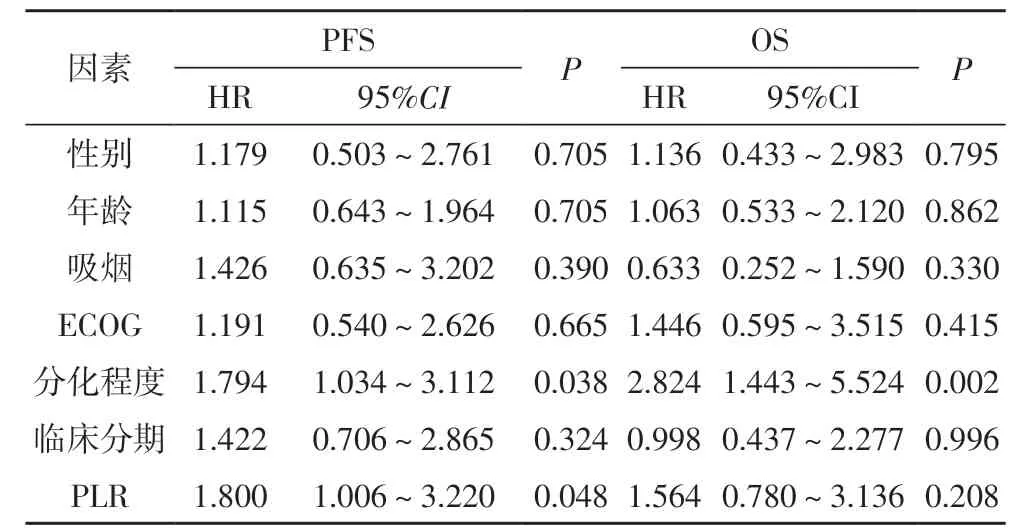
表2 A组患者PFS、OS相关因素的COX回归分析
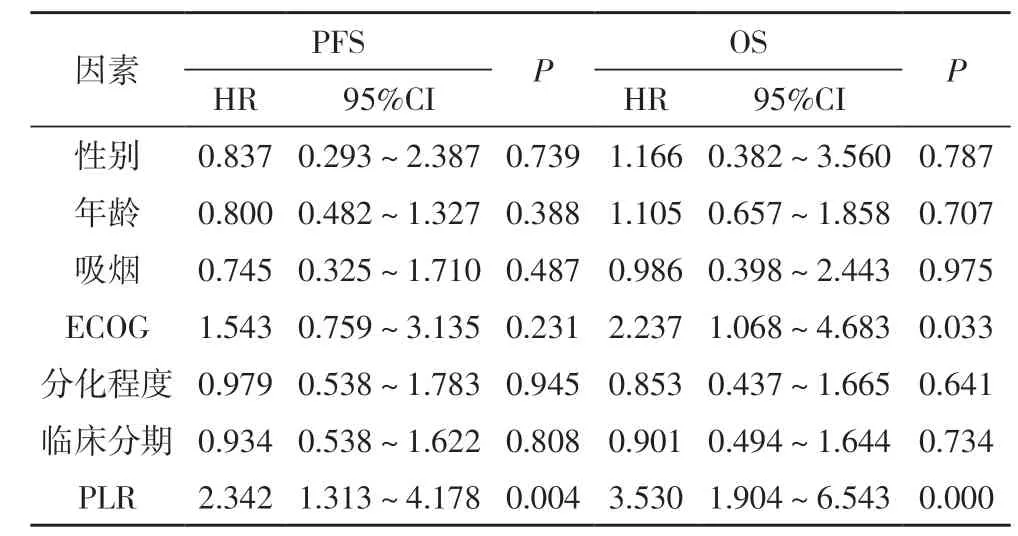
表3 B组患者PFS、OS相关因素的COX回归分析
3 讨论
有研究表明,炎症不但与肿瘤的生长相关,并且与肿瘤患者的存活时间相关[11]。淋巴细胞通过诱导细胞毒而促进细胞死亡,从而抑制肿瘤细胞的增长和转移[12]。肿瘤和炎性细胞可释放各种炎性介质,如IL-1、IL-3、IL-6 等,通过刺激血小板内皮干细胞,导致血小板增多,而血小板又可以通过释放VEGF 等因子促进肿瘤细胞生长和血管生成,并产生正反馈[13]。因此,当血小板增多或淋巴细胞减少时,血小板/淋巴细胞(PLR)会增高,它除了可以反映机体的炎症状况,也可以影响肿瘤患者的疗效和预后。血管生成是肿瘤生长和转移的必要条件,贝伐珠单抗可通过与VEGF 结合来抑制血管生长,诱导新形成的血管退缩,并使血管正常化以便于细胞毒化疗的输送,同时对肿瘤细胞也有直接作用[14]。但现已有证据表明,IL-6 在几种实体恶性肿瘤的微环境中发挥促血管生成作用,并且越来越多的证据表明IL-6 信号与抗VEGF 抗体(如贝伐珠单抗)治疗失败有显著关系[15]。Alessandro Passardi 等人[16]对结直肠癌患者的研究表明,接受贝伐珠单抗+化疗的低PLR 患者比只接受化疗的患者有更好的PFS,而PLR高的患者在两个治疗组中的PFS 相似,在PLR 值高或低的患者中,贝伐珠单抗的增加不会影响OS。Alberto Farolfi 等人[17]对卵巢癌患者的研究发现,在总体人群中,炎症指数低的患者PFS 和OS 明显延长。在多因素分析中,PLR 是PFS 预后因素。在单纯化疗组中,炎症指标与患者预后显著相关。在贝伐珠单抗组中,多因素分析表明PLR 不是PFS 和OS 的独立预后因素。
由于目前缺少关于PLR 对贝伐珠单抗治疗晚期NSCLC 疗效和预后的观察,在本研究中,我们探讨了PLR 对其疗效和预后的预测作用。我们发现,在对A(贝伐珠单抗+化疗)组与B(单纯化疗)组临床特征分别进行分析时,A1(PLR <174)组与A2(PLR ≥174)组在ECOG 评分与临床分期中存在差异,B1(PLR <174)组和B2(PLR ≥174)组在是否吸烟、ECOG 评分、分化程度中存在差异。生存分析时得出,在A(贝伐珠单抗+化疗)组与B(单纯化疗)组中,A1(PLR <174)组较A2(PLR ≥174)组、B1(PLR <174)组较B2(PLR ≥174)组均有更好的PFS 与OS,差异有统计学意义,而在总体人群中,A1(PLR <174)组患者比B1(PLR <174)组的患者有更好的PFS,差异有统计学意义,但OS 差异无统计学意义,并且在高PLR 组中,PFS 与OS 差异均无统计学意义。由此可见,低PLR 患者接受贝伐珠单抗+化疗比单纯化疗会有更好的疗效和预后,而在高PLR 患者中没有明显区别。在COX 多因素回归分析中,结果显示PLR 是贝伐珠单抗+化疗组中PFS 的独立预后因素,低PLR 组有较好的PFS,但在OS 中无统计学意义。而在单纯化疗组中,PLR 既是PFS 的独立预后因素,也是OS 的独立预后因素。本研究的结果与该领域的其他研究结果有一致性,但由于样本数量较少,并且各研究中心可能存在差异,所以有一定的局限性。
综上所述,对于接受贝伐珠单抗联合化疗治疗的晚期NSCLC 患者,低PLR 患者的疗效较好,预后更优。PLR 具有容易获得、经济、快速的优点,可以用来评估贝伐珠单抗联合化疗治疗晚期NSCLC 的疗效和预后,但仍需前瞻性的大样本研究进一步验证。

