LncRNA-ATB 对乳腺癌细胞增殖、迁移和凋亡的影响
刘安娜,骆沿极,肖创清
(湖南师范大学附属第二医院/中国人民解放军联勤保障部队第921医院检验科,长沙 410003)
乳腺癌(breast carcinoma,BC)是全球重要公共卫生问题,是女性最常见的恶性肿瘤之一,也是20~59 岁女性恶性肿瘤死亡的主要原因。目前,BC 的发病率仍较高,严重威胁女性身心健康[1]。而BC 的诊断主要依靠传统肿瘤标志物、影像学及病理检查,以手术、放化疗及内分泌治疗为主,近年来分子靶向治疗也逐渐成为热点。我们仍需进一步研究和发现新的特异性指标,提高BC 的早期诊断水平,也需要寻找更好的分子靶点以促进治疗效果的提高,使该病死亡率降低。
长链非编码RNA(lncRNA-activated by TGF-β,lncRNA-ATB)是位于第14 号染色体,长度约80kb 的lncRNA[2]。目前有文献报道lncRNA-ATB 在多种恶性肿瘤中呈高表达,如肝细胞癌、胃癌、结直肠癌等,并且参与调控肿瘤细胞的增殖、迁移、侵袭和凋亡过程[2-6]。也有研究证明其在BC 中呈异常表达[7],但目前对lncRNAATB 调控BC 细胞具体功能及机制的研究仍较少。本文通过研究lncRNA-ATB 对BC 细胞体外增殖、迁移、凋亡等生物学过程的影响,探讨lncRNA-ATB 在BC 细胞中的作用,以期为BC 患者的治疗提供新的靶点。
1 材料与方法
1.1 材料 乳腺癌细胞系MCF-7、MDA-MB-231 购自上海中乔新舟生物科技有限公司;RNA 反转录试剂盒、荧光实时定量聚合酶链反应(qRT-PCR)试剂盒购自北京康为世纪公司,lncRNA-ATB 引物及特异干扰siRNA引物由上海生物工程公司合成。胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司;DMEM 培养基、碘化丙啶(Propidium Iodide,PI)购自美国Sigma 公司;胰酶消化液、双抗(青链霉素)购自碧云天公司;RNA 提取试剂TRIzol、转染试剂Lipofectamine2000 购自美国Invitrogen公司;Transwell 小室购自Corning 公司;Annexin V-APC细胞凋亡检测试剂盒购自江苏凯基生物公司。
1.2 方法
1.2.1 细胞培养 将人乳腺癌MCF-7 和MDAMB-231 细胞培养于10%胎牛血清(FBS)+1%双抗DMEM 培养基中,置于37℃,5% CO2培养箱中培养。
1.2.2 特异干扰RNA 序列合成及细胞转染 应用ATB 特异性siRNA 序列信息如下:si-ATB-1:正义5′-GCACAGAGCAACUCUAUAATT-3′,反义5′-UUAUAGAGUUGCUCUGUGCTT-3′;si-ATB-2:正义5′-GAGCCGCUAAUUAAUUGAUTT-3′,反义5′-AUCAAUUAAUUAGCGCCUCTT-3′;si-ATB-3:正义5′-GCUAAGGAAAGAUCCAAAUTT-3′,反义5′-AUUUGGAUCUUUCCUUAGCTT-3′;阴性对照:正义5′-UUCUCCGAACGUGUCACGUTT-3′,反义5-′ACGUGACACGUUCGGAGAATT-3′。利用Lipofectamine2000 将siRNA 转染至MCF-7 和MDAMB-231 细胞,细胞密度为每毫升1×105个,共设5 组:①空白对照组:乳腺癌MCF-7、MDA-MB-231 细胞组;②阴性对照组:在MCF-7、MDA-MB-231 细胞中转染阴性对照序列;③si-ATB-1:将siRNA-ATB-1 序列转染至MCF-7、MDA-MB-231 细胞中,同样将si-ATB-2和si-ATB-3 转染至MCF-7、MDA-MB-231 细胞中成为第4 组和第5 组,转染48 小时后采用实时荧光定量PCR 检测siRNA 对lncRNA-ATB 的抑制率。
1.2.3 RNA 提取及q RT-PCR 检测 按Trizol 说明书,采用苯酚-氯仿提取法,分别提取上述细胞中总RNA 提取细胞总RNA,分光光度计测定RNA 纯度及浓度,根据反转录试剂盒操作说明进行反转录合成c DNA,以c DNA 作为模板进行PCR 特异性扩增,检测lncRNA-ATB 的基因表达量。LncRNA-ATB 引物序列:正义5′- AGTTTTCTGTTCTGCCGTCT -3′,反义5′- CCTTACATGGCGTTTAGTCCTG -3′;内参β-actin:正义:5′-ACCCTGAAGTACCCCATCGAG-3′,反义:5′- AGCACAGCCTGGATAGCAAC-3′,反应条件:95℃预变性5min,95℃变性15 s,60℃退火30 s,循环40 次,采用2-△△Ct 法计算各组细胞中LncRNA-ATB 表达水平。
1.2.4 细胞克隆形成实验 分别取转染48h 上述5 组细胞,经胰酶消化后再用DMEM 高糖培养基重悬细胞,以每孔200 个细胞的密度接种于6 孔板内,置37°C 、5%CO2及饱和湿度的细胞培养箱中,培养2~3 周,2~3 天换液一次,培养皿中出现肉眼可见的克隆时,终止培养,弃培养液,PBS 液浸洗2 次,每孔加入4%多聚甲醛固定细胞15min,去固定液,结晶紫染液室温染色30min,流水缓慢洗去染色液,空气干燥,细胞拍照。10%的醋酸浸泡,使脱色,550nm 处,酶标仪测定吸光度(OD)值,重复三次结果。
1.2.5 Transwell 细胞迁移实验 分别取转染48h 上述5 组细胞,经胰酶消化离心后,再用无血清DMEM 培养基重悬细胞至重悬细胞至2×106个细胞/mL,基质胶包被的Transwell 小室上室中每孔接种100μL,下室每孔均加入500μL 10%FBS 完全培养基置37℃培养箱中放置48h 后,吸出上室培养基,用PBS 洗3 遍,棉球擦去上室残余细胞,用4%多聚甲醛固定20min,去除固定液,用结晶紫染色5min,水洗5 次,加入10%的醋酸浸泡脱色,550nm 处酶标仪测定吸光度(OD)值,重复三次,取平均值。
1.2.6 细胞凋亡实验 取适量上述转染后的各组细胞,用结合缓冲液500uL 悬浮细胞,加入5μL Annexin V-APC 混匀后,再加入5μL PI,混匀;室温避光反应15min;采用流式细胞术检测细胞凋亡情况。
1.3 统计学方法 数据分析采用SPSS 25.0 统计软件,计量资料用均数±标准差,多组间采用单因素方差分析,组间比较采用Bonferroni 法,以P<0.05 差异有统计学意义。
2 结果
2.1 下调lncRNA-ATB 基因效率验证 采用qRTPCR 检测各组lncRNA-ATB 的相对表达量,图1 可见,在MCF-7 细胞中,空白组、si-NC 组、si-ATB-1 组、si-ATB-2 组、si-ATB-3 组中lncRNA-ATB 相对表达量分别为1.01±0.13、1.09±0.04、0.16±0.01、0.41±0.03、0.27±0.02。可见si-ATB-1 组、si-ATB-2 组、si-ATB-3 组lnc RNA-ATB 的表达量显著低于空白组及NC 组(P<0.05),空白组与NC 组无明显差异(P>0.05)。在MDA-MB-231 细胞中,空白组、si-NC 组、si-ATB-1组、si-ATB-2 组、si-ATB-3 组lncRNA-ATB 表达量分别0.83±0.08、0.76±0.09、0.18±0.01、0.44±0.09、0.23±0.02。可见si-ATB-1 组、si-ATB-2 组、si-ATB-3组lncRNA-ATB 表达水平较空白组及NC 组明显降低(P<0.05),空白组与NC 组无显著差异(P>0.05)。在这两种细胞系中,si-ATB-1 组lncRNA-ATB 的表达量较si-ATB-2 及si-ATB-3 低,因此选择si-ATB-1 转染lncRNA-ATB 进行后续实验。

图1 MCF-7、MDA-MB-231细胞lncRNA-ATB表达水平比较与空白组及NC组比较,* P<0.05
2.2 下调lnc RNA-ATB 后两种乳腺癌细胞克隆形成能力 图2 可见,两组细胞克隆集落生长情况有所差异,在MCF-7 细胞中,空白组、si-NC 组及si-ATB-1 组OD 值分别为1.343±0.010、1.327±0.003、0.985±0.007。si-ATB-1 组细胞OD 值明显较空白组及si-NC 组低(P<0.05),空白组与si-NC 组无明显差异(P>0.05)。在MDA- MB-231 细胞中,空白组、si-NC组及si-ATB-1 组OD 值分别为1.365±0.011、1.331±0.015、0.847±0.011,空白组及si-NC 组测得OD 值明显高于si-ATB-1 组(P<0.05),空白组与si-NC 组间无显著差异(P>0.05)。因此,我们发现下调lncRNA-ATB的表达可降低乳腺癌细胞克隆形成能力。

图2 下调lncRNA-ATB对MCF-7、MDA-MB-231细胞克隆形成能力的影响与空白组及NC组比较,* P<0.05
2.3 下调lncRNA-ATB 后两种乳腺癌细胞迁移能力 图3 可见,在MCF-7 细胞及MDA-MB-231 细胞中下调lncRNA-ATB 后,采用Transwell 实验分析各组细胞迁移能力,MCF-7 细胞中空白组、si-NC 组、si-ATB-1组测得OD 值分别是0.734±0.026、0.730±0.027、0.551±0.019,si-ATB-1 组与空白组及NC 组比较OD值显著降低(P<0.05),而空白组与NC 组无明显差异(P>0.05)。MDA-MB-231 细胞中空白组、si-NC 组与si-ATB-1 组OD 值分别为1.507±0.026、1.432±0.037、1.140±0.067,si-ATB-1 组OD 值明显小于空白组及si-ATB-1 组(P<0.05),空白组与NC 组差异无统计学意义(P>0.05)。由此我们可见,下调lncRNA-ATB 后的两种乳腺癌细胞迁移能力明显下降。
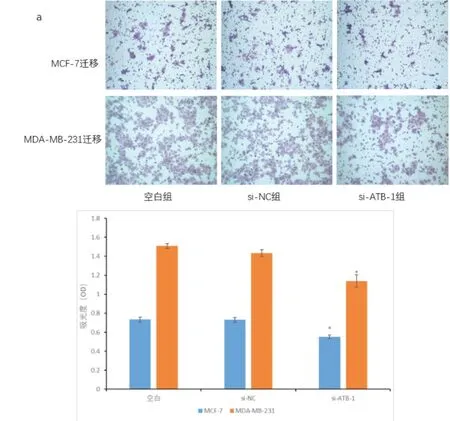
图3 下调lncRNA-ATB对MCF-7、MDA-MB-231细胞transwell迁移能力的影响与空白组及NC组比较,*P<0.05
2.4 下调lncRNA-ATB 对乳腺癌细胞凋亡的影响 图4 中,在MCF-7 细胞中,si-ATB-1 组、空白组及NC组细胞凋亡率分别为(7.19±0.26)%、(3.26±0.34)%、(2.61±0.32)%,下调lncRNA-ATB 的MCF-7 细胞凋亡率明显高于空白组及NC 组(P<0.05)。在MDAMB-231 细胞中,si-ATB-1 组、空白组及NC 组细胞凋亡率分别为(6.88±0.17)%、(3.34±0.12)%、(3.35±0.14)%,空白组及NC 组细胞凋亡率明显低于si-ATB-1 组(P<0.05),提示下调lncRNA-ATB 基因可促使乳腺癌细胞凋亡。
3 讨论
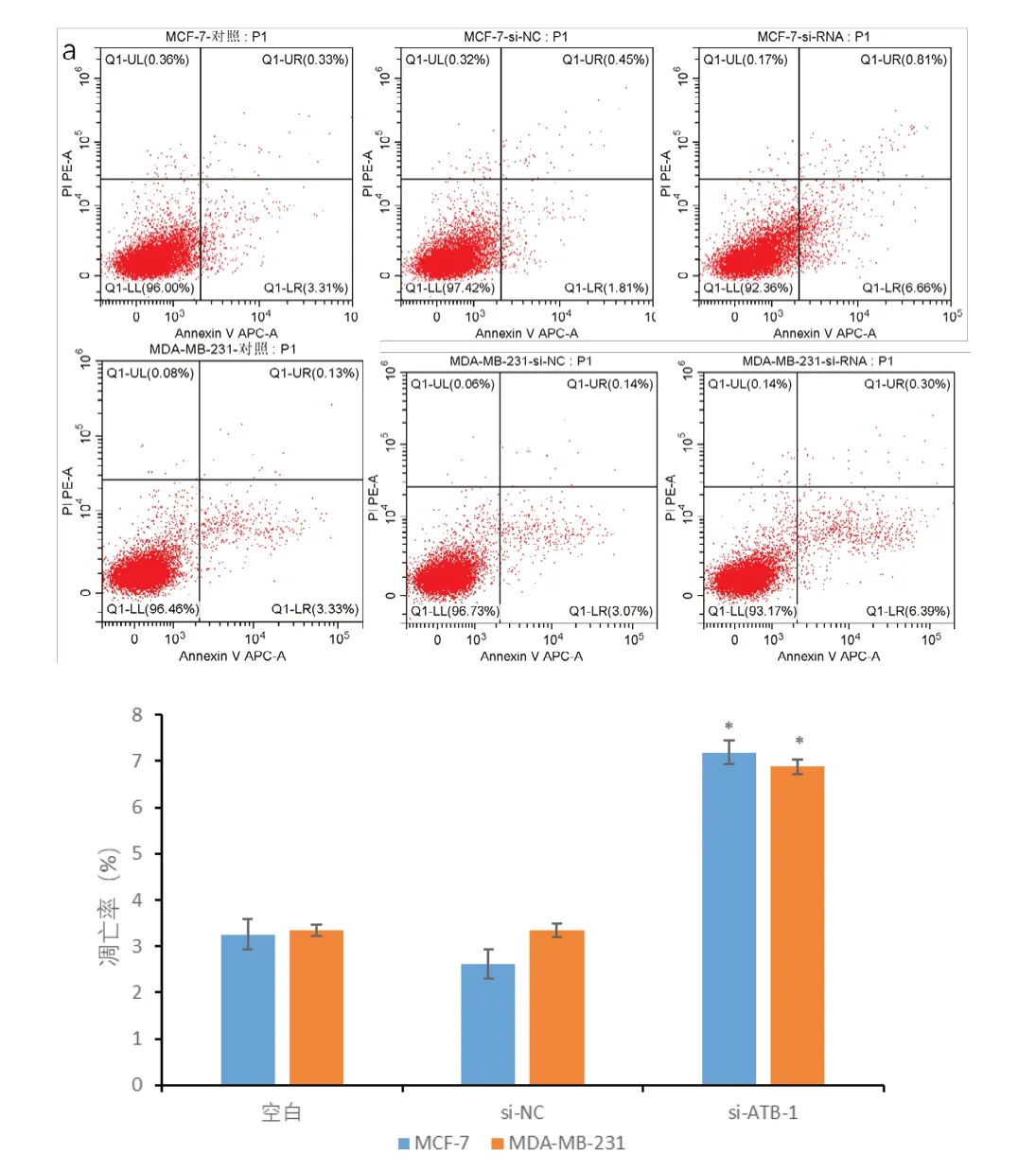
图4 下调lncRNA-ATB对MCF-7、MDA-MB-231细胞凋亡的影响与空白组及NC组相比,*P<0.05
许多研究发现lncRNA-ATB 作为一种癌基因在多种恶性肿瘤组织中呈高表达,并且参与肿瘤细胞生长、侵袭、迁移和凋亡的过程。目前在BC 的相关研究中,也发现了其在BC 组织中表达水平明显高于相邻正常组织,但在BC 细胞水平的研究仍较少,因此,从细胞分子层面探索BC 的发生和转移侵袭的机制,将为BC 患者基因治疗提供新的靶点。
本实验通过特异s i R N A 靶向抑制B C 细胞lncRNA-ATB 的表达,再通过克隆平板形成实验,发现下调lncRNA-ATB 表达水平后BC 细胞的增殖能力明显下降。其可能的机制:(1)lncRNA-ATB 可作为一种竞争内源性RNA(ceRNA),竞争性结合miRNA 反应元件,从而影响下游靶基因的表达[8],促进恶性肿瘤细胞的增殖。(2)miR-200c 被认为是lncRNA-ATB 直接结合位点,LncRNA-ATB 可通过抑制miR-200c 的水平进一步促进癌细胞的生长,同时上调miR-200 目标基因ZEB1 和ZEB2[9,10]。(3)LncRNA-ATB 还可以竞争性结合miR-590-5p 上调NF-90 水平影响肺鳞癌细胞增殖能力[11]。
之后,我们在两种转染siRNA-ATB 的BC 细胞中进行了transwell 迁移实验,我们发现下调lncRNA-ATB的BC 细胞组较阴性对照组迁移率显著降低,其机制离不开上皮-间质转化(epithelial-mesenchymal transition,EMT),上皮细胞失去黏附和紧密连接能力,获得间充质细胞的特性[12,13]。这个过程的发生伴随着上皮标记物E-钙黏蛋白(E-cadherin)表达水平的降低和间充质标记物N-钙黏蛋白(N-cadherin)和波形蛋白(vimentin)等的表达水平的升高[14]。一方面,lncRNA-ATB 可促进N-cadherin 和vimentin 的表达,抑制E-cadherin 的表达,从而促进EMT 的过程[11,15,16];而另一方面,miRNA也可调控EMT 的过程,lnc RNA-ATB 通过TGF-β/ miR-200s / ZEB 轴诱导癌细胞EMT,促进癌细胞发生侵袭和迁移[2,3]。
最后,我们采用流式细胞术检测了下调lncRNAATB 的BC 细胞组和阴性对照组的细胞凋亡情况,实验发现前者细胞凋亡率明显提高,因此我们认为下调lncRNA-ATB 可促进BC 细胞凋亡。已有研究表明细胞凋亡程序失调导致肿瘤的发生,细胞凋亡程序的调控受到许多因素的调节,最常见的细胞凋亡因子包括B淋巴细胞瘤-2(Bcl-2)蛋白家族和半胱氨酸天冬氨酸蛋白酶3(caspase-3)。Bcl-2 蛋白家族由促凋亡因子和抗凋亡因子两组蛋白组成,Bax 作为Bcl-2 蛋白家族中的成员之一促进细胞的凋亡,而Bcl-2 作为Bcl-2 家族成员之一是一种抗凋亡因子,可以下调Bax 的表达从而以抑制凋亡的发生,促凋亡因子和抗凋亡因子之间的失衡导致细胞凋亡的失调;Caspases-3 是caspases 家族中重要的角色,它在多种凋亡因子的作用下激活,诱导细胞的凋亡[17]。下调lncRNA-ATB 的表达可下调Bcl-2、上调Bax 和激活caspase-3 来促进癌细胞凋亡[18]。
综上,lncRNA-ATB 在乳腺癌细胞的恶性生物学过程起重要的作用,下调lncRNA-ATB 的水平可使BC细胞的增殖和迁移能力明显下降,并促使BC 细胞的凋亡。因此,它有望成为BC 患者预后评估的生物学标志物和基因治疗的新靶点。

