MicroRNA-194缓解高脂环境下肝细胞脂质沉积、炎症反应的分子机制研究
罗昕 徐梓馨 周璀 徐铭益
MicroRNA(miRNA)是一类在人体中广泛分布非编码小RNA,有多种miRNA如miR-29a、miR-223等与非酒精性脂肪性肝病(NAFLD)疾病的进展有关[1-4]。肝细胞的脂质沉积及炎症反应是导致脂肪肝的核心环节[5,6]。本研究通过构建脂肪肝小鼠模型及脂肪肝细胞模型,了解在高脂环境下miR-194调控肝细胞脂质代谢及炎症反应的作用。
材料与方法
一、材料与试剂
实验小鼠购于上海斯莱克实验动物中心,LO2细胞系购于中科院上海细胞库。小鼠低脂饲料及高脂饲料均购于南通特洛菲实验饲料有限公司,胎牛血清、高糖DMEM培养基、0.25%胰蛋白酶购自美国Gibco公司,1%青霉素链霉素双抗溶液、棕榈酸、LipofectamineTM3000 脂质体转染试剂、Trizol试剂购自美国Invitrogen公司,TNF-α单克隆荧光抗体购自美国Abcam公司,PCR引物序列由生工生物工程(上海)股份有限公司合成,反转录试剂盒、SYBR Green PCR 试剂盒,HE染色、油红染色试剂盒均购于上海懿圣生物科技有限公司。
二、方法
(一)动物模型构建 共有10只8周龄雄性SPF级C57BL/6小鼠用于脂肪肝小鼠模型的构建。小鼠体质量为25~30 g,由上海斯莱克实验动物中心提供,饲养于上海交通大学附属第一人民医院实验动物中心。10只小鼠随机分为低脂组(LFD)与高脂组(NFD),每组5只,LFD组小鼠喂养普通饲料(即低脂饲料),HFD组小鼠喂养高脂饲料。喂养相应饲料16周后处死小鼠,取部分肝组织经脱水、石蜡包埋或OCT凝胶包埋用于病理学检测。取适当组织行qPCR检测,余组织冻存于液氮中。
(二)肝组织病理检查 建模小鼠处死后,取适当大小的新鲜组织块置于4%甲醛溶液中固定48 h,后常规脱水处理,石蜡包埋。蜡块以4 μm切片用以HE染色,光学显微镜下观察其病理改变。
新鲜肝组织经过4%甲醛中固定48 h,依次经过20%、10%蔗糖溶液梯度各24 h脱水后,用OCT溶胶包埋。以10 μm厚度进行冰冻组织切片,用于油红染色,光学显微镜下检测其病理程度并拍照。
(三)细胞培养 采用含有10%FBS及1%双抗的DMEM高糖培养基培养人肝细胞系LO2,细胞培养置于37 ℃、体积分数为0.05的CO2、饱和湿度的培养箱。待细胞融合度达到70%时行细胞传代。用0.25%胰蛋白酶消化细胞后,以1∶3的比例行细胞传代。
(四)细胞转染 用0.25%的胰酶消化细胞后,以1×105/孔的密度将生长状态良好的LO2细胞接种于十二孔板中,置于37℃、体积分数为0.05的CO2、饱和湿度的培养箱中培养24 h,次日观察细胞生长状态,细胞透亮伸展,融合度达到约80%时细胞转染处理。使用 LipofectamineTM3000转染试剂盒进行转染。细胞分为空白转染对照组(miR-NC组)和miR-194过表达组(miR-194),分别转染micro-RNA 阴性对照mimics和microRNA-194 mimics,转染浓度为50 nmol/mL,转染完成48 h后收集细胞,以200 μmol PA刺激LO2细胞24 h(模拟高脂环境)。
(五)RT-qPCR检测相关基因miRNA及mRNA表达 建模后的小鼠组织及转染后的LO2细胞按照说明书提取总RNA,检测RNA纯度及丰度。按照说明书将获取的RNA反转录为cDNA。使用SYBR Premix染料进行qPCR扩增。目的基因相对表达量采用 △△CT 方法计算,目的基因的相对表达率(relative expression,RQ)=2-△△CT。miRNA的检测以U6作为内参,mRNA的检测以GAPDH作为内参。内参基因及目标基因均设3个复孔。各基因引物见表1。

表1 qPCR相关引物序列
(六)LO2细胞油红染色 取生长状态良好的LO2细胞接种于十二孔板中,接种密度为1×105/孔,行细胞转染,在细胞瞬转完成后的24 h后更换浓度为200 μmol PA的完全培养基进行高脂处理24 h。细胞处理完成后,按照说明书进行细胞油红染色,光学显微镜下观察细胞脂质沉积。
(七)免疫荧光检测LO2细胞TNF-α表达 生长状态良好的LO2细胞接种于十二孔板细胞爬片中,接种密度为 1×105/孔。完成预处理的细胞爬片后用4%多聚甲醛固定15 min, 然后以0.2%Triton X-100室温通透20 min; 5%BSA溶液, 室温封闭30 min;以1∶100稀释一抗孵育细胞爬片并入湿盒, 4 ℃孵育过夜,以上各步骤之间以PBS浸洗3次, 每次3 min;次日室温复温1 h, 以1∶200的浓度稀释荧光二抗, 湿盒中室温孵育爬片1 h。滴加DAPI避光孵育5 min, 对标本进行染核, 并用含抗荧光淬灭剂的封片液封片, 在荧光显微镜下观察采集图像。
三、统计学分析
采用 SPSS 18.0 统计软件分析。满足正态分布的计量资料以均数±标准差表示,两组之间比较采用独立样本t检验。P<0.05为差异有统计学意义。所有实验均独立重复3次。
结 果
一、脂肪肝小鼠造模情况
LFD组小鼠肝小叶结构完整,细胞排列整齐,细胞核居于细胞正中,无明显脂肪变性及气球样变(图1A)。HFD组小鼠可见肝小叶中肝细胞排列紊乱,细胞出现明显的脂肪变性及气球样变,有大量炎细胞浸润(图1B)。油红染色显示,LFD组小鼠细胞形态正常,肝脏脂质沉积较少(图1C);HFD组小鼠可见胞内大量鲜红色脂滴沉积(图1D)。HE染色及油红染色显示脂肪肝小鼠模型成功构建。
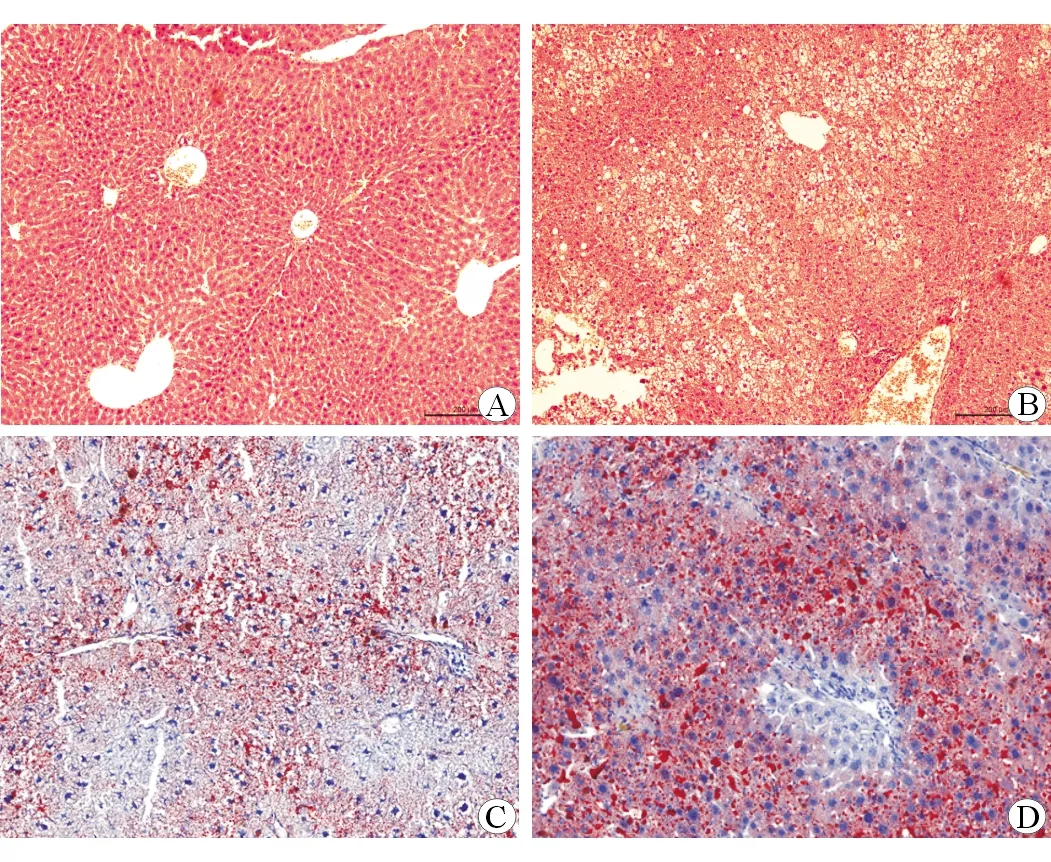
A:低脂小鼠(HE染色×100);B:高脂小鼠(HE染色×100);C:低脂小鼠(油红染色×100);D:高脂小鼠(油红染色×100)
二、miR-194在脂肪肝小鼠肝组织中明显下降
LFD组小鼠组为miR-194的相对表达水平为1.000±0.147,HFD组为0.634±0.116, 差异有统计学意义(t=3.478,P=0.025)。说明在脂肪肝的病理过程中,miR-194表达受到了抑制,相关功能受到了影响。
三、脂肪肝小鼠肝组织中脂质合成基因及炎症相关基因表达明显上升
与LFD小鼠相比,在HFD组小鼠肝脏组织中促脂质合成基因SCD1及ACC的表达都显著上调,分别为[LFD:1.000±0.287,HFD:1.658±0.216, (t=4.802,P=0.009]和[LFD:1.000±0.252,HFD:1.851±0.245, (t=4.194,P=0.015)]。SCD1和ACC1是脂质合成的关键调控因子,能够促进肝细胞脂质的合成,促进脂质在细胞内沉积。此外,与LFD小鼠相比,HFD小鼠的TNF-α及IL-6表达明显上调[LFD:1.000±0.172,HFD:1.952±0.147, (t=7.288,P=0.002)]和[LFD:1.000±0.207,HFD:1.452±0.108, (t=3.242,P=0.029)]。这表明,随着脂质沉积于肝细胞内,细胞的炎症反应增多,氧化应激明显加强。
四、高脂环境下,miR-194高表达可以缓解LO2细胞内脂质沉积
QPCR结果显示miR-194在LX2内升高约1 100倍,过表达miR-194 LO2细胞模型成功构建。此外,qPCR检测SCD1和ACC表达,可以发现在过表达miR-194后的LO2细胞内, SCD1[miR-NC:1.000±0.149,miR-194:0.625±0.112, (t=3.340,P=0.029)]和ACC[miR-NC:1.000±0.204,miR-194:0.572±0.124, (t=3.105,P=0.038)]表达明显下调。油红染色检测细胞内脂质沉积,同样可以发现过表达miR-194的LO2细胞内红色脂肪颗粒明显变少(图2)。以上结果表明,在高脂环境下,miR-194可以明显LO2细胞内的脂质沉积。

A:miR-NC; B:miR-194
五、高脂环境下,miR-194高表达可以缓解LO2细胞内炎症反应
结果表明与miR-NC组LO2相比,过表达miR-194的LO2细胞中TNF-α [miR-NC:1.000±0.149,miR-194: 0.563±0.059, (t=4.723,P=0.009)]及IL-6[miR-NC:1.000±0.156,miR-194:0.685±0.112, (t=2.853,P=0.048)]的mRNA表达水平显著下降。免疫荧光检测二组细胞中TNF-α表达情况,可以发现过表达miR-194的LO2细胞内红荧光程度明显降低,相对强度为[miR-NC:1.000±0.124,miR-194:0.655±0.152, (t=3.020,P=0.039)],TNF-α表达明显下降(图3)。以上结果表明在高脂环境下,miR-194可以明显减轻LO2细胞内的炎症反应。
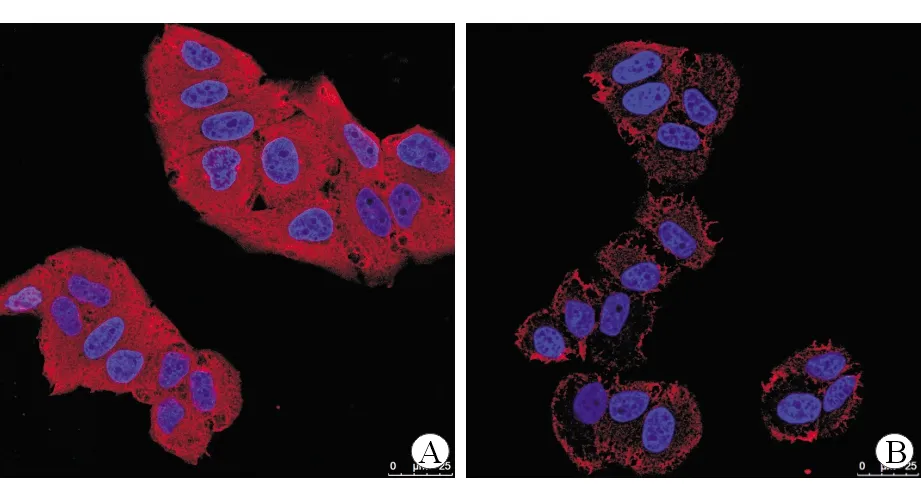
A:miR-NC; B:miR-194
讨 论
He等[7]发现,miR-233可以通过减轻高脂环境下肝细胞的炎症反应使脂肪肝的进展减缓。Zhang等[8]发现miR-27a可以通过靶向调控肝细胞FAS及SCD1基因,抑制其脂质合成从而促进脂肪肝的进展。MiR-194是肝脏中丰度最高的RNA[9]。Wu等[10]在肝星状细胞中发现miR-194可以通过靶向调控AKT2 基因 延缓肝纤维化的进展。RAN等[11]发现 miR-194可以通过靶向调控肝癌细胞RAC1基因延缓肝癌的进展。本研究结果表明,与低脂组小鼠相比高脂小鼠肝细胞脂肪变性明显,有大量脂肪滴沉积与肝脏内,脂肪肝小鼠模型成功构建。通过qPCR检测,发现miR-194在高脂小鼠肝脏内表达明显降低,说明在脂肪肝进程中,miR-194的功能受到了抑制。
本研究中,在棕榈酸刺激LO2后,采用qPCR检测miR-NC组及过表达miR-194组细胞的脂质合成因子表达,发现ACC及SCD1表达明显减少。ACC和SCD1均为脂肪酸合成步骤过程中的限速酶,其丰度的高低可以作为显示脂质合成的活跃情况[12]。油红染色进一步表明在过表达miR-194组,细胞内的脂肪沉积明显减少。这证明miR-194起到了减缓细胞内脂质沉积的作用。采用qPCR检测对照组及过表达miR-194 LO2细胞内的炎症因子的表达,发现TNF-α、IL-6的表达都在过表达组中出现了明显的下降。TNF-α、IL-6是经典的炎症因子,其丰度可以表明目前细胞的炎症反应状态。此外,通过免疫荧光检测TNF-α的表达,可以发现在过表达组中LO2细胞红荧光显著减弱,这表明TNF-α的表达显著下降。这些结果表明miR-194可以减少高脂环境下LO2细胞的炎症反应。
综上所述,通过体内实验及体外实验的结果表明miR-194可以负向调控高脂环境下肝脏的脂质合成及炎症反应,起到保护肝脏的作用,有望成为治疗NAFLD的新靶点。而miR-194在脂肪肝进程中起到保护作用的具体机制及下游靶基因的调控需要进一步的研究证实。

