AIH还是NASH?
——肝硬化临床病理报告2例及文献回顾
范海纳 邢 枫 陈高峰 刘成海
病例1:患者女,68岁,于2018年5月8日因“反复乏力、皮肤瘙痒4年余,肝功能异常1年余”入院。2014年因乏力、皮肤瘙痒于外院就诊,考虑为“干燥综合征”,给予激素和中药治疗(具体用药不详),服药后效果一般。2017年8月发现转氨酶轻度升高,予保肝治疗后好转。2018年4月25日体检血常规示:WBC 2.3×109/L,RBC 4.27×1012/L,PLT 74×109/L。血生化检查:ALT 43 U/L,AST 45 U/L,GGT 52 U/L,ALP 57 U/L,TBil 25 μmol/L,DBil 9.3 μmol/L,Alb 45 g/L,Glo 42 g/L。IgG 24.4 g/L。血清纤维化标志物:PCIII 85.49 ng/mL,LN 77.53 ng/mL,HA 240.2 ng/mL,CIV 90.80 ng/mL。HBV血清标志物:抗-HBs(+)、抗-HBc(+)。ANA 1:300(+),抗-LKM1 (+),抗-SLA(+)。铜蓝蛋白:24.1 mg/dL。FibroScan:肝硬度36.3 KPa。腹部超声示:“肝脏回声增粗,门脉增宽,肝弥漫性病变;脾稍大,胆囊切除术后,肝外胆管扩张;右肾囊肿”。
既往高血压病史15年,药物控制理想;1996年因“胆石症”行胆囊切除术。否认烟酒史。查体:BMI 29.6 kg/m2,肝掌阳性。近期无明确致肝损害药物服用史。入院后完善检查:INR 1.09;ESR 43 mm/h。MRI:“肝硬化伴多发再生结节,脾肿大,门脉高压伴食管下段、胃底静脉曲张,腹腔少量积液;轻度脂肪肝;肝左内叶小血管瘤可能大;胆囊切除后,胆总管轻度扩张;肝门区淋巴结肿大;两侧肾脏多发囊肿”。胃镜检查:“食管静脉曲张;门脉高压性胃炎伴胆汁反流”。肝组织病理见图1。
该患者主要诊断为自身免疫性肝炎后肝硬化。治疗予抗肝纤维化(扶正化瘀胶囊 1.6 g,3次/d口服)、保肝(熊去氧胆酸胶囊250 mg,3次/d口服、多烯磷脂酰胆碱胶囊 228 mg,3次/d口服)及中和胆酸护胃(铝碳酸镁片0.5 g,3次/d口服),另予缬沙坦胶囊控制血压。由于患者WBC长期<4×109/L,故不使用免疫抑制剂[1]。其口服糖皮质激素方案为甲泼尼龙起始剂量16 mg/d,生化指标好转后逐渐减量为12 mg/d。6个月后,患者转氨酶指标恢复至正常水平,症状平稳,改甲泼尼龙剂量为6 mg/d;继服熊去氧胆酸胶囊、扶正化瘀胶囊及中药对症治疗。随访期间肝功能好转,复查血清IgG 16.8 g/L,获得较满意疗效。
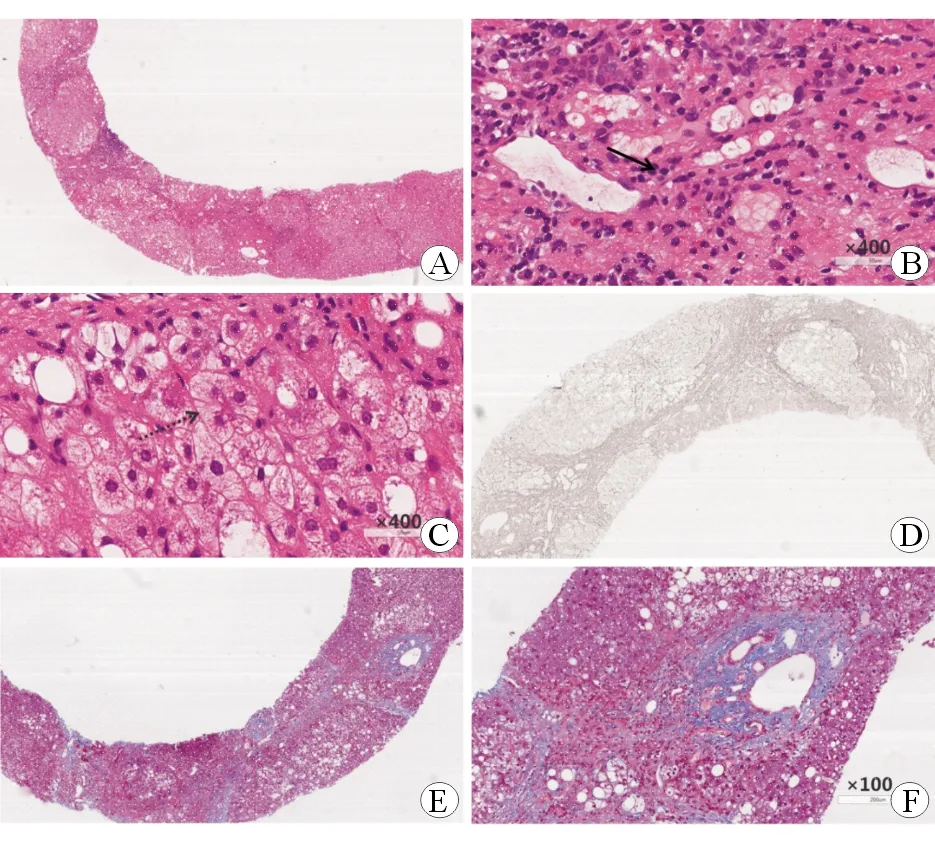
A、B、C:HE染色,汇管区炎性细胞浸润,以淋巴细胞为主、少量浆细胞(实线箭头),轻度界面性炎,部分肝细胞脂肪变性(大泡型为主);肝细胞玫瑰花环排列(虚线箭头)。D:网状染色;E、F:Masson染色,汇管区可见纤维沉积,部分区域纤维间隔、假小叶形成。
病例2:患者女,71岁,于2019年4月23因“肝功能异常伴乏力2个月”入院。2019年2月,患者因乏力伴劳累后胸口隐痛,于外院就诊,无明显心肌缺血。血常规示:WBC 5.91×109/L,HGB 149 g/L,PLT 120×109/L;肝肾功能示:ALT 186 U/L,AST 156 U/L,GGT 134 U/L,尿酸455 μmol/L。腹部超声示:肝硬化;脾门区静脉曲张;肝左叶类圆形低密度影;胆囊炎,胆囊结石;左肾结石。胃镜检查示:胆汁反流性胃炎。考虑诊断:1.肝硬化;2.胆汁反流性胃炎。予谷胱甘肽、天晴甘平、泮托拉唑、铝碳酸镁等保肝护胃对症治疗,肝功能指标好转但仍高于正常。
既往慢性胃炎病史20年;轻中度脂肪肝病史10年余(ALT>1~2×ULN),未治疗。甲肝病史。否认烟酒史。磺胺类药物过敏。近期无明确致肝损害药物服用史。BMI 26 kg/m2,体格检查未见明显异常。入院完善检查示:INR 0.99;HDL-C 1.22 mmol/L;γ-球蛋白 21.7%;抗U1核糖核蛋白弱阳性,ANA、AMA系列抗体均阴性;IgG 14.1 g/L,IgE 222.0 IU/mL。铜蓝蛋白:21.10 mg/dL。FibroTouch:肝硬度 19.3 kPa,CAP 295 dB/m。肝组织病理见图2。
此例患者诊断为非酒精性脂肪性肝炎肝硬化。治疗上予多烯磷脂酰胆碱、甘草酸二胺、熊去氧胆酸胶囊(200 mg,3次/d口服)以保肝降酶、抗氧化;同时予护胃(雷贝拉唑 10 mg,1次/d口服)、抗肝纤维化(扶正化瘀胶囊1.6 g,3次/d口服)及中药对症治疗。患者经治疗后肝功能等指标较前明显好转出院。此后门诊随诊,嘱其调整饮食结构,控制体质量。继续口服保肝降酶(熊去氧胆酸、甘草酸二胺)、抗纤维化(扶正化瘀胶囊)及中药对症治疗。治疗后随访,ALT 34 U/L,AST 34 U/L,GGT 38 U/L,病情明显好转。
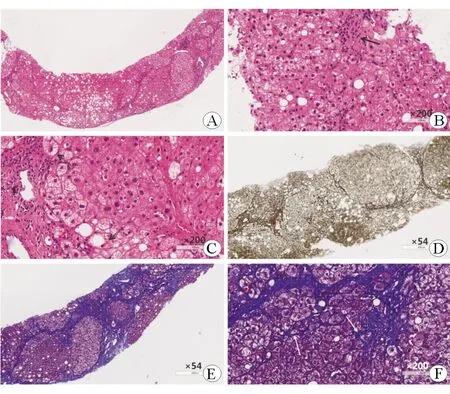
A、B、C:HE染色,可见肝细胞脂肪变(大泡型为主),部分肝细胞胞质疏松与气球样变(双线箭头);汇管区及小叶内可见炎性细胞(淋巴细胞为主,黑色箭头)浸润。 D:网状染色,E、F:Masson染色,中央静脉周围及窦周胶原纤维沉积,鸡丝样纤维化(白色箭头),假小叶形成。
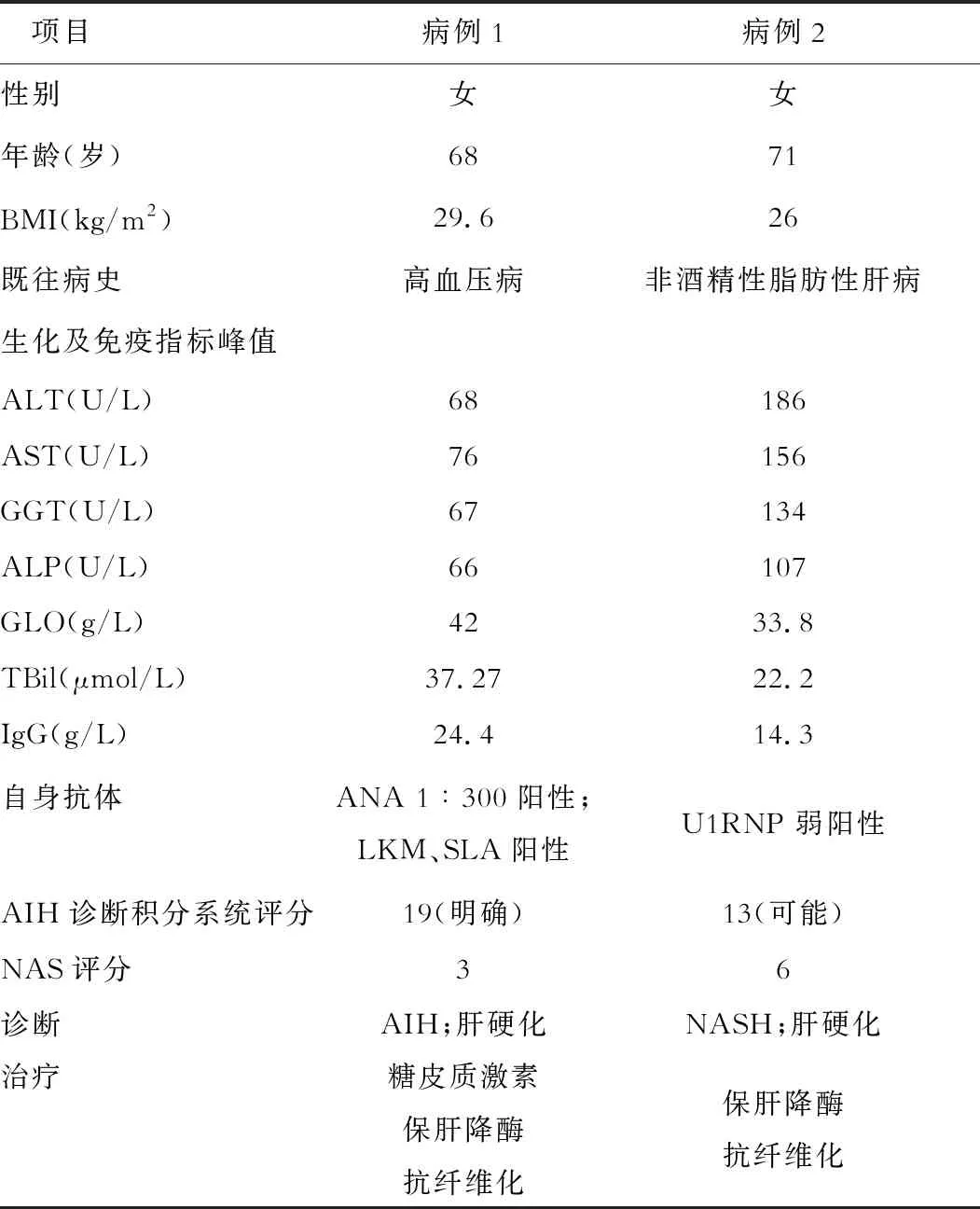
表1 2个病例的特点比较
讨论AIH与NASH均是临床常见慢性肝病,可引起肝硬化。因缺乏特异性诊断或排除指标,二者常易混淆。NASH患者中ANA阳性率为12%~35%[2],显著高于正常人群。自身抗体阳性的出现往往伴随肝纤维化程度较高、炎症坏死更严重及血清球蛋白水平更高[3]。以上情况合并出现可能会导致IAIHG评分升高,干扰临床医生诊断。此外诊断为AIH的患者在治疗过程中常使用糖皮质激素,而糖皮质激素可导致肝脂肪变性[4-5],甚至可能增加发生NAFLD或NASH的风险[6],为诊断与治疗增加难度。
二者所致纤维化的病理特征如何鉴别?
AIH的病变常以汇管区和肝界板处为主,且可深入肝腺泡,形成桥接坏死、融合灶状坏死,还可见玫瑰花结样排列的肝细胞。不同病程的AIH常可有其他病理表现,出现如气球样变性等肝细胞损伤。晚期以坏死性炎症为表现的AIH还可存在广泛的小叶性炎症和实质塌陷,其组织学特征可能与NASH相似,导致混淆[7]。AIH随病程进展出现不同程度的纤维化,其纤维化以汇管区周围多见,进而发展为肝硬化[8]。
病例1中病理改变可见汇管区炎症显著,以淋巴细胞浸润为主,轻度界面炎及肝细胞花环;Masson染色可见部分汇管区胶原纤维沉淀明显,假小叶形成。结合其病理表现、IgG水平升高,ANA、抗-LKM1及抗-SLA阳性,IAIHG评分19分,诊断为AIH肝硬化。
NASH组织学特征包括肝细胞脂肪变、气球样变伴/不伴Mallory小体,炎症主要位于小叶内(儿童NASH则以汇管区炎症为主),三者需同时存在方可诊断NASH。与AIH相比,NASH汇管区炎症轻且没有淋巴细胞、浆细胞性界面炎[9]。NASH所致肝纤维化的特点是以肝腺泡第3区为起始,沿窦周发展,呈“鸡丝样”(chicken wire)[10]。值得一提的是,当NASH进展至肝硬化阶段,早期肝细胞脂肪变、气球样变等特征性病理改变可以继续存在,也可能逐渐消失(burn out)[11],前者肝硬化病因不难诊断,后者则需要根据既往病史以及以腺泡3带为主的窦周纤维化以及多见中央静脉-中央静脉(Central-Central)、中央静脉-汇管区(Central-Portal)纤维间隔等病理特点作出判断。
本文病例2中病理可见肝细胞脂肪变性(约30%),以大泡性为主,部分气球样变,以肝腺泡3区为著;汇管区炎症较轻而小叶内炎症明显;窦周鸡丝样纤维化,可见假小叶形成。结合其BMI、肝功能、IgG水平、ANA阴性及NAS评分,诊断为NASH肝硬化。而病例1中患者肝脂肪变呈混合性,分布以肝腺泡1区、2区为主,结合病史,考虑其脂肪变可能与使用糖皮质激素及代谢综合征有关。
George[12]等认为鉴别NASH与AIH存在以下难点:(1)临床医生及病理医师对于常见病如NAFLD更为熟悉。当见到典型的脂肪变及气球样变性时,可能更倾向于临床常见诊断,而不是较为少见的情况如AIH合并NASH,或由糖皮质激素治疗后发生的肝细胞脂肪变。(2)目前尚缺乏诊断或排除NAFLD及AIH的可靠实验室检查。(3)指南中未明确提出IgG水平在区分AIH与NAFLD或NASH中的重要性。而近半数的NASH患者纤维化水平与IgA水平相关。
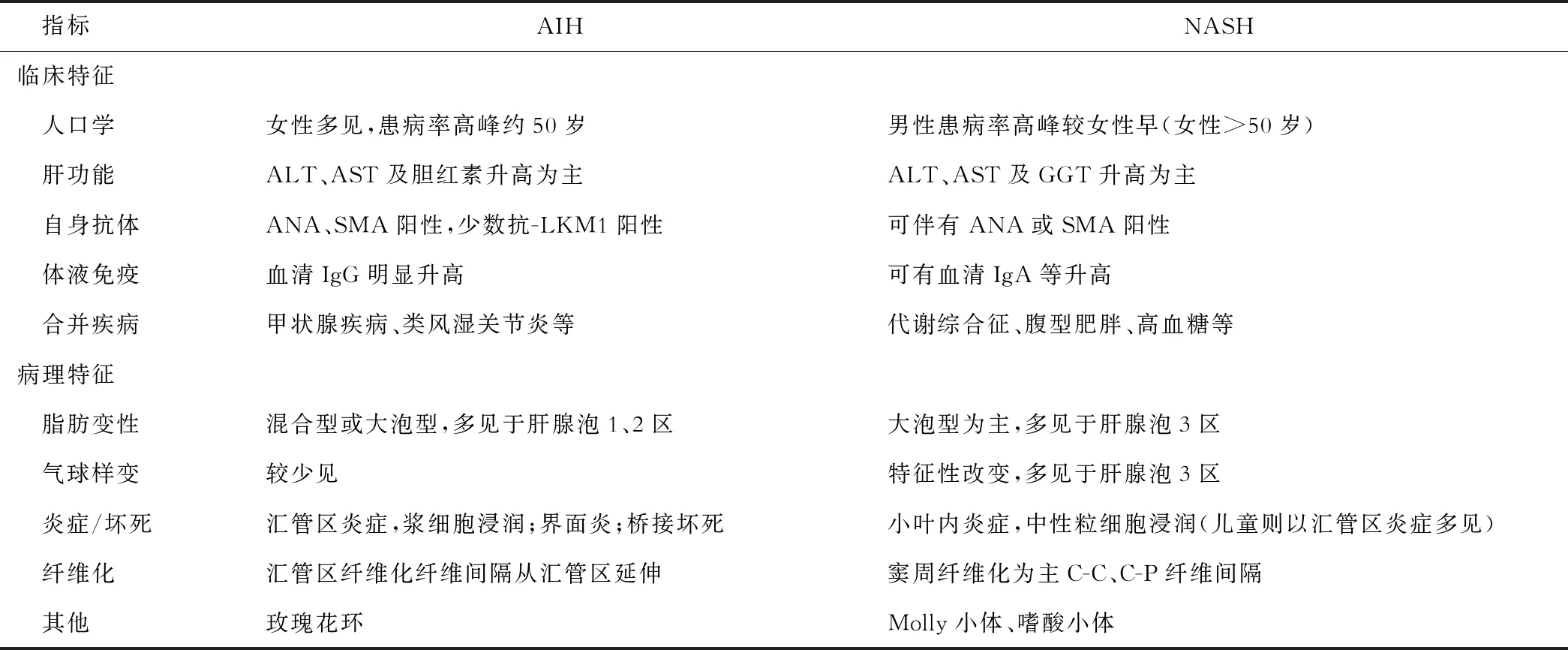
表2 AIH与NASH的主要异同点比较
本文中两例肝硬化患者临床表现及肝功能特征不典型,甚至与典型表现相反,正说明组织学诊断在二者鉴别诊断中的重要作用。AIH与NASH在发病机制、临床表现及病理表现均有关联,不论是生化、免疫指标还是组织学表现均需要我们仔细分辨其异同,以期为患者制定合理的治疗方案。

