MCL1激活MAPK-MEK信号通路促进食管癌细胞EC9706增殖
崔艳丽 何利珍
河南省焦作市第二人民医院检验科 454000
食管癌是一种常发的严重肿瘤,引起食管癌的因素较多,以不良饮食习惯、经济社会地位和常吃粗粮等相关性比较高[1]。临床上治疗食管癌多以手术、放化疗为主,且发生率和死亡率在国内均较高。为了提高癌症患者的生存率和存活时间,逐渐开始尝试一些分子靶向疗法,但在食管癌中还没有成熟的分子靶点,需要进一步揭示调控食管癌增殖的分子机制,找到好的分子治疗靶点。
髓样细胞白血病因子1(Myeloid cell leukemia-1,MCL1)最初被发现是细胞分化相关的一个基因,在白细胞分化过程中被发现其能够诱导单核/巨噬细胞分化途径。后来发现MCL1是一种肿瘤发生相关的蛋白,在多种消化道肿瘤中高表达,但是其在食管癌中表达情况及是否影响食管癌细胞增殖还不确定。本项目基于对临床病例材料进行检测,发现MCL1在食管癌组织中高表达,并通过构建MCL1的真核表达载体,探讨其对食管癌细胞增殖的影响。
1 材料与方法
1.1 组织样品收集 食管癌样本为2018年在本院手术切除癌组织样本(男9例,女3例,平均年龄68.3岁)。对照样本为对应的癌周组织。将癌组织样品及癌周组织碾磨,以Triol法提取RNA,然后用实时相对定量法(qRT-PCR)检测食管癌组织中MCL1基因转录情况,所用定量引物序列为:Q-MCL1-F:5’-GAC GAG TTG TAC CGG CA GTC-3’,Q-MCL1-R:5’-TTT GTT ACG CCG TCG CTGA-3’。产物大小为266bp。内参引物序列为:Q-β-actin-F:5’-GAG AAA ATC TGG CAC CAC ACC-3’,Q-β-actin-R:5’-GGA TAG CAC AGC CTG GAT AG CAA-3’。产物大小为177bp。
1.2 细胞培养 食管癌细胞EC9706在37℃恒温二氧化碳培养箱中培养,培养液为添加10%胎牛血清和1%青链霉素的RPMI1640培养基。其中,RPMI1640基础培养基购自Hyclone公司,胎牛血清购自依科赛生物科技有限公司,青链霉素购自碧云天生物技术有限公司。
1.3 载体构建 实验中用到的pCDNA3.1/myc-His载体购自Addgene公司,基因扩增自EC9706细胞。实验中所用的克隆引物为:MCL1-F: CGG GAT TCA TGT TTG GCC TCA AAA GAA ACG CGG,MCL1-R: GGA ATT CTC TTA TTA GAT ATG CCA AA CCA。产物大小为:1 068bp(含酶切位点及保护碱基)。引物由生工上海生物工程(上海)股份有限公司合成。构建的载体命名为:pCDNA3.1-MCL1-myc-His。
1.4 转染试验 EC9706细胞提前接种于12孔细胞培养板,次日细胞生长至80%铺满皿底时,实验组每孔转染pCDNA3.1-MCL1-myc-His质粒3μg,对照组转染pCDNA3.1/myc-His空质粒3μg。转染步骤按照Thermo Turbofect转染试剂说明书进行,在转染24h和48h后进行收样检测。
1.5 Western blot检测 上述1.4中细胞样品,弃去培养基,用添加蛋白酶抑制剂的RIPA裂解液100μl在冰上裂解细胞15min,然后添加6×loading buffer, 蛋白样品95℃煮样10min后备用。聚丙烯酰胺凝胶电泳(100V,1.5h)分散蛋白后,将胶上蛋白转膜(250mA,100min)转移至PVDF膜上,脱脂奶粉封闭2h后,以抗磷酸化MEK1(p-MEK1)抗体(1∶1 000,购自Abclone公司)、以抗MEK1抗体(1∶1 000,购自Abclone公司)、β-actin抗体(1∶5 000,购自Abclone)为一抗分别孵育PVDF膜4℃过夜;PBST溶液清洗PVDF膜3次后;以HRP标记的羊抗鼠/兔二抗(1∶5 000,购自Abclone公司)室温孵育1h;然后用PBST溶液清洗PVDF膜3次;ECL化学发光液(购自Millipore公司)显色,化学发光仪拍照。
1.6 细胞计数 将细胞接种至12孔板,待细胞生长至70%左右时转染MCL1真核表达载体和对照的空载体,分别在转染后0、24和48h,用胰酶消化细胞,以血球计数板计数,每组3个样品,每个样品重复计数3次。
1.7 细胞划痕试验 细胞生长至80%左右时转染超表达MCL1的质粒,并同期转染空质粒作为对照。在次日细胞长满皿底时,以无菌移液器吸头在细胞皿内划线,分别在划线后0、24和48h后拍照,检测细胞迁移能力变化情况。
1.8 细胞周期检测 上述1.4中细胞样品,以PBS清洗细胞后,胰酶消化后再次以PBS清洗细胞1遍,离心弃去PBS,以预冷的70%乙醇在4℃固定细胞48h,然后离心弃去乙醇,以PBS悬浮细胞,加入细胞周期用PI溶液,在37℃孵育30min,流式细胞仪检测细胞周期。
1.9 qRT-PCR检测 上述1.4中细胞样品,弃去培养基并以PBS清洗1遍后,每孔加入1ml Trizol试剂(购自Takara公司),提取细胞总RNA,然后以反转录试剂盒(购自天根生化科技有限公司)反转录获得cDNA,再以荧光定量试剂盒(天根生化科技北京有限公司)检测相关下游基因表达情况。Q-C-MYC-F:5’-CCG ACC AGC TGG AGA TGG TGA-3’,Q-C-MYC-R:5’-AGC CTG GTA GGA GGC CAG CTT-3’;Q-C-FOS-F:5’-CTA TGC AGC AGA CTG GG AGC-3’,Q-C-FOS-R:5’-AGA CGT GTA AGC AGT GC AGC-3’;Q-CCND1-F:5’-AGC TGT GCA TCT ACA CC GAC-3’,Q-CCND1-R:5’-GAA ATC GTG CGG GGT CA TTG-3’。
1.10 统计学方法 采用 Graphpad Prism5 统计软件进行分析。数据以均数±标准差表示,组间比较采用独立样本t检验;检验水准α=0.05。
2 结果
2.1 MCL1在食管癌组织中高表达 2018年1—12月在本院收集的12例手术切除的食管癌组织(Cancer tissue) 样品及其癌周组织(Control)样品,通过qRT-PCR检测,将对应的数据等比例换算后,发现在其中10份临床样品中,MCL1在食管癌组织中表达量高于对应的癌周组织,仅2例差异不显著,如图1所示。
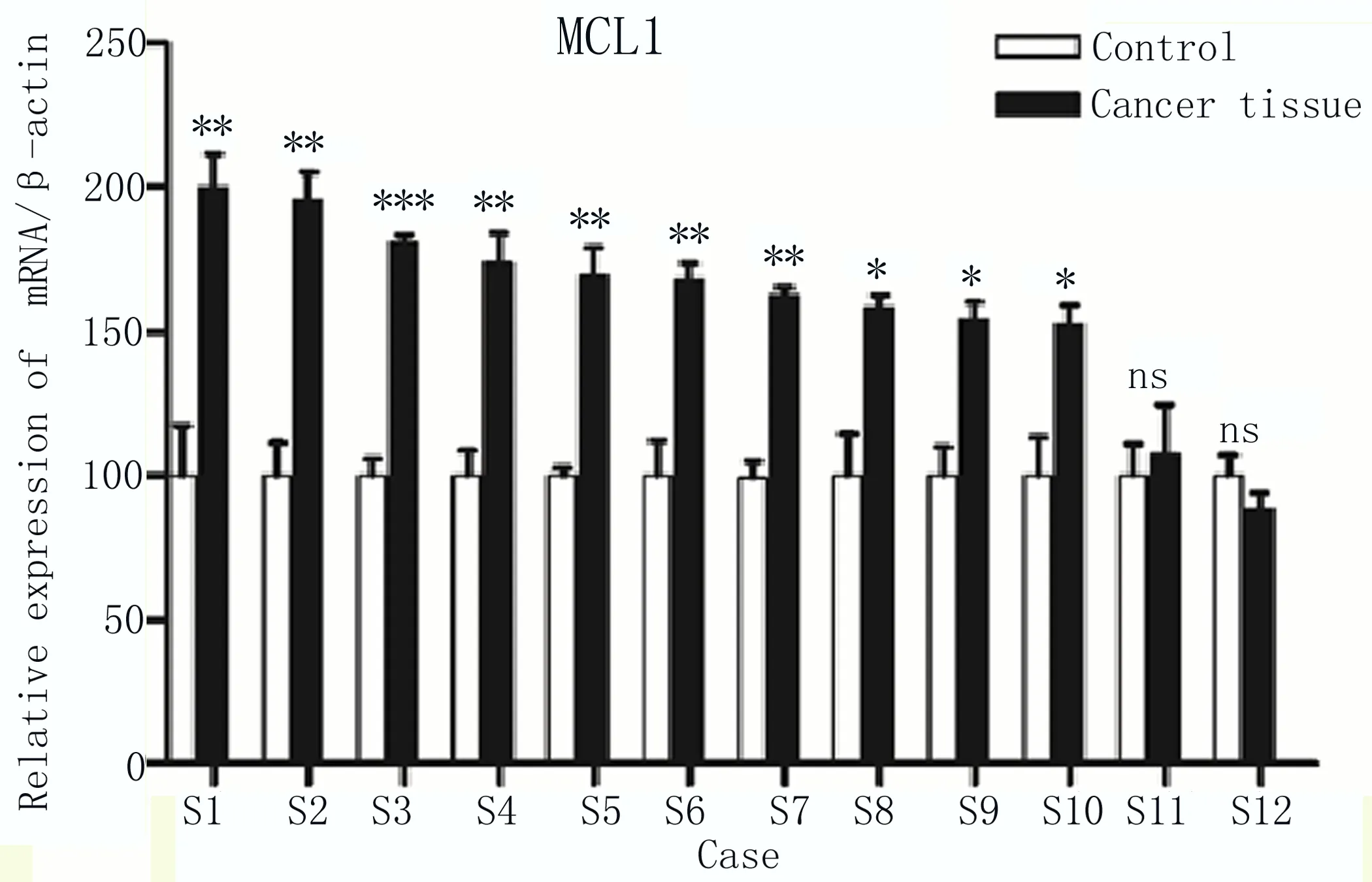
图1 相对定量PCR检测12例癌组织(Cancer tissue)和癌周组织(Control)中MCL1表达量 两组比较,*P≤0.05;**P≤0.01;***P≤0.001
2.2 构建表达MCL1的真核表达载体 通过PCR的方法,用保真酶将MCL1基因扩增出来(图2A);双酶切后装至pCDNA3.1/myc-His载体上,酶切验证构建的目的载体pCDNA3.1-MCL1-myc-His,结果显示获得和预期大小的条带(图2B),测序后序列无突变。这些结果提示载体pCDNA3.1-MCL1-myc-His构建成功。
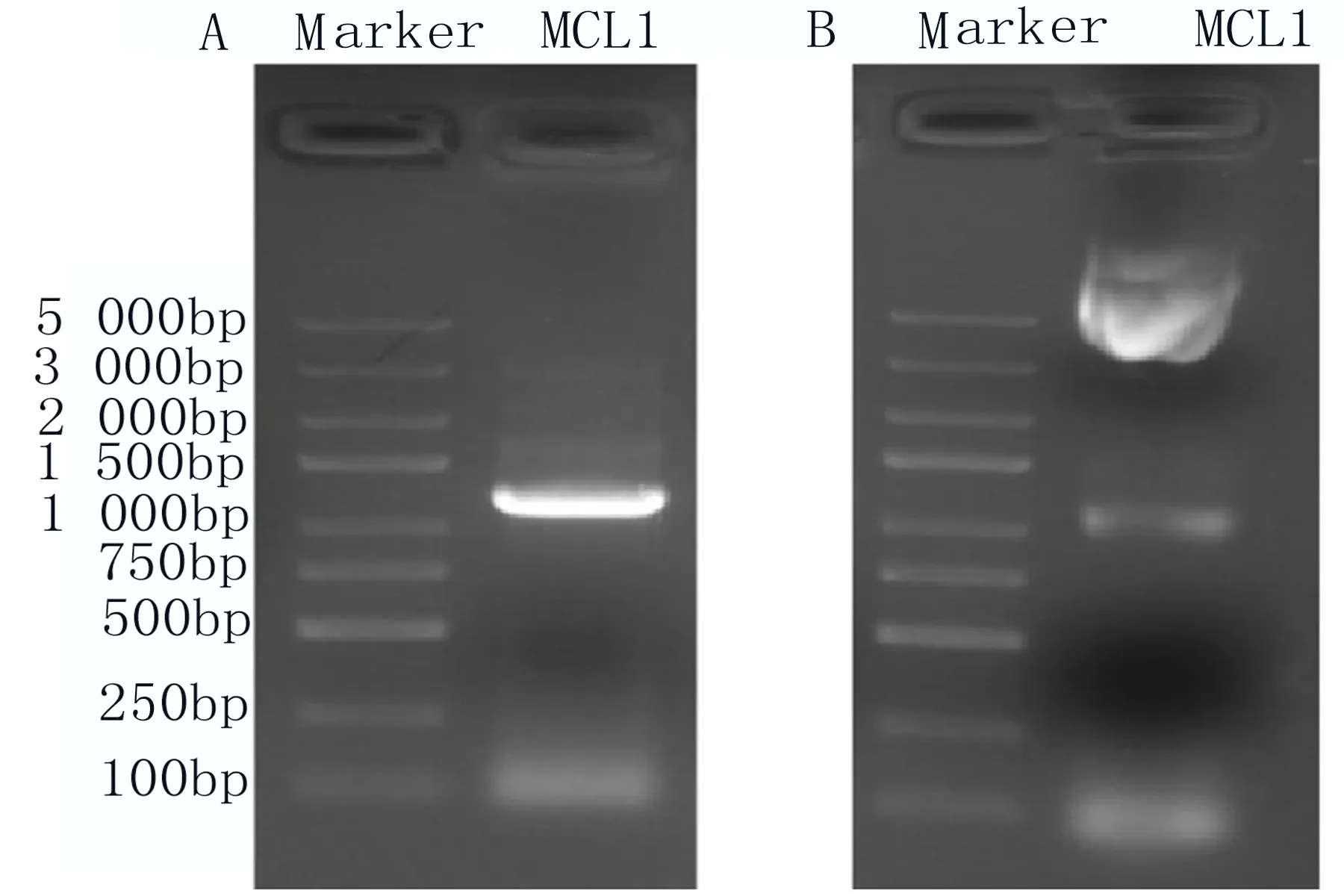
图2 核酸电泳结果
2.3 细胞计数检测超表达MCL1促进EC9706细胞增殖 将构建好的MCL1真核表达载体pCDNA3.1-MCL1-myc-His转染至EC9706细胞内,同时以转染pCDNA3.1/myc-His空质粒为对照组,在转染后24和48h分别检测两组的细胞数量,结果显示超表达MCL1组的细胞数量高于对照组,其中在转染48h,差异显著,如图3所示。
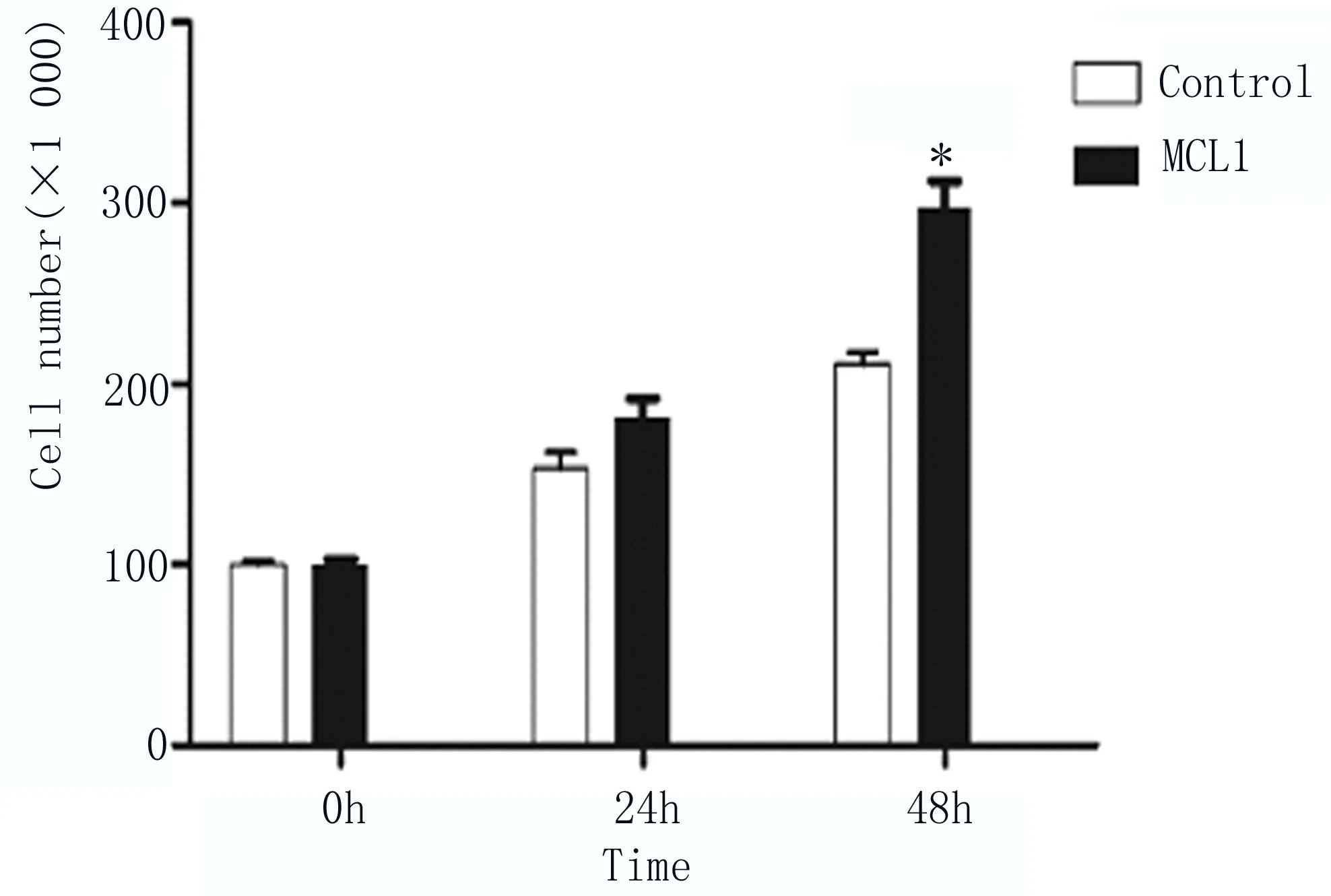
图3 细胞计数检测不同时间点细胞数量差异 两组比较,*P≤0.01
2.4 细胞周期检测超表达MCL1促进EC9706细胞增殖 以流式细胞仪检测细胞周期,结果显示,在转染24h后对照组(Control)和超表达MCL1组(MCL1)的G1期比例分别为(72.44±0.56)%、(70.05±1.05)%(P≤0.05);在转染质粒48h后G1期细胞比例分别为(73.95±0.05)%、(71.55±0.55)%(P≤0.01);对应的S+G2期细胞比例在超表达MCL1后高于超表达空质粒的对照组。以上结果提示超表达MCL1能够增加S+G2期细胞比例,提高了细胞增殖能力,如图4所示。
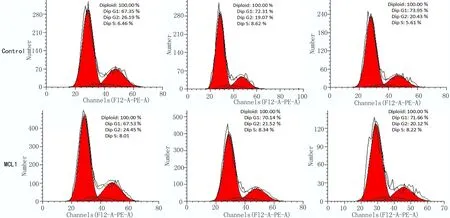
图4 流式检测超表达MCL1后细胞周期变化
2.5 超表达MCL1促进EC9706细胞迁移 细胞转染MCL1后,次日细胞将近铺满皿底,以移液器吸头划线,并将培养基换成无血清培养基,在划线后0、24和48h拍照。结果显示,超表达MCL1的细胞显示更好的迁徙能力,尤其在48h时差异较显著,如图5所示。
2.6 抑制MAPK信号通路能够抑制EC9706细胞增殖 用抑制剂U0126(100nM)处理细胞,Western blot检测MEK含量降低,磷酸化MEK含量增加(图6);细胞计数检测发现用U0126抑制剂处理细胞24和48h后,细胞数量较仅加溶剂的对照组(Control)明显减少,如图7所示。以上结果显示抑制MAPK-MEK信号通路能够抑制EC9706细胞增殖。
2.7 超表达MCL1激活MEK信号通路 在细胞内转染pCDNA3.1-MCL1-myc-His来超表达MCL1蛋白,以转染空载体pCDNA3.1/myc-His的细胞为对照组(Control),Western blot检测发现MCL1能够减少MEK含量,增加p-MEK含量(图8);qRT-PCR检测MEK下游靶基因C-MYC、C-FOS和CCND1,结果显示,EC9706细胞中超表达MCL1后能够激活MEK下游靶基因的转录, 差异显著有统计学意义,如图9所示。

图5 细胞划痕实验检测超表达MCL1后对细胞迁移的影响
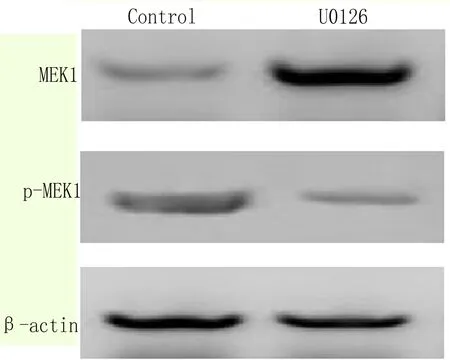
图6 Western blot 检测U0126处理细胞后细胞内MEK1含量变化
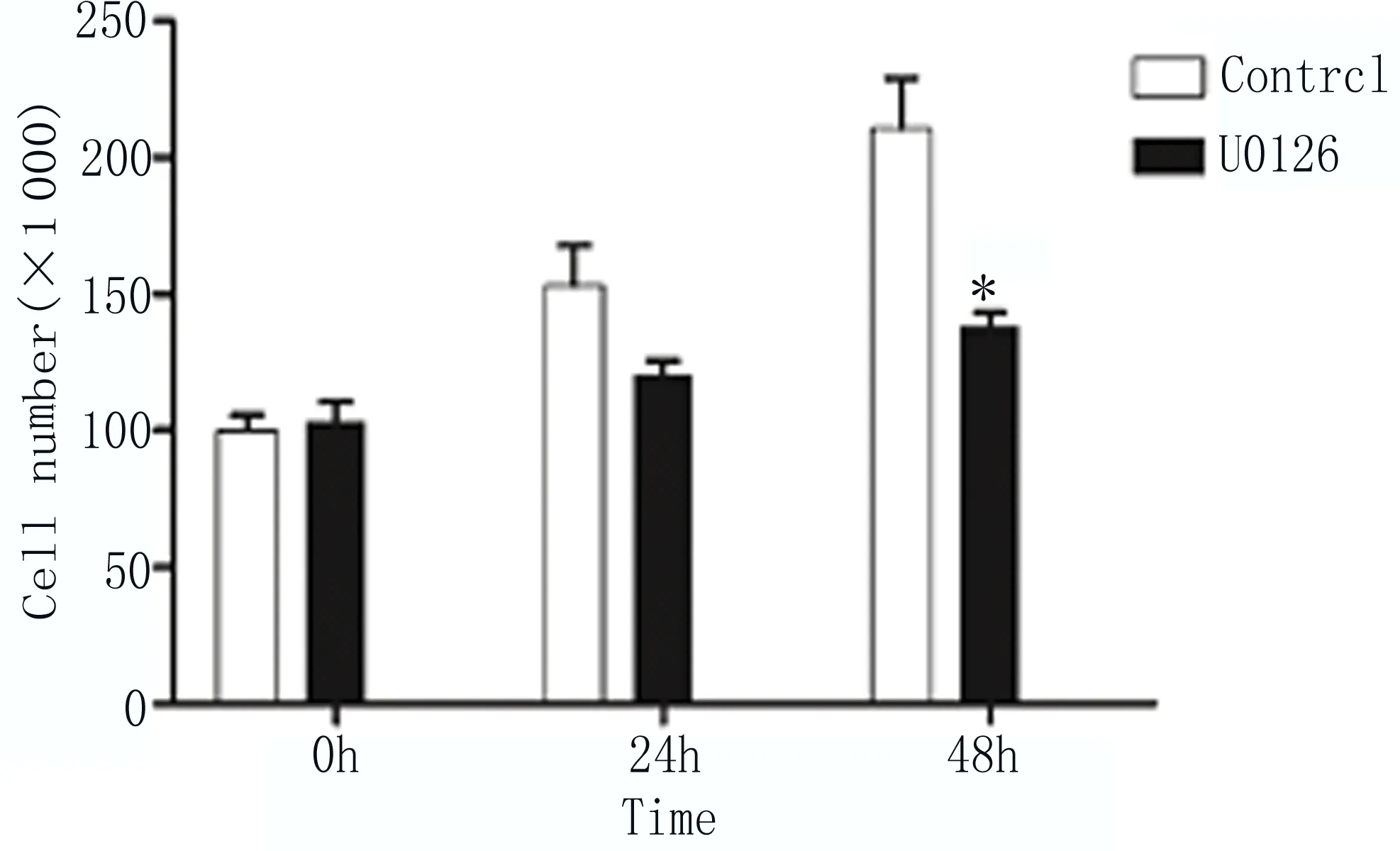
图7 细胞计数检测U0126处理细胞后细胞增殖情况 两组比较,*P≤0.05
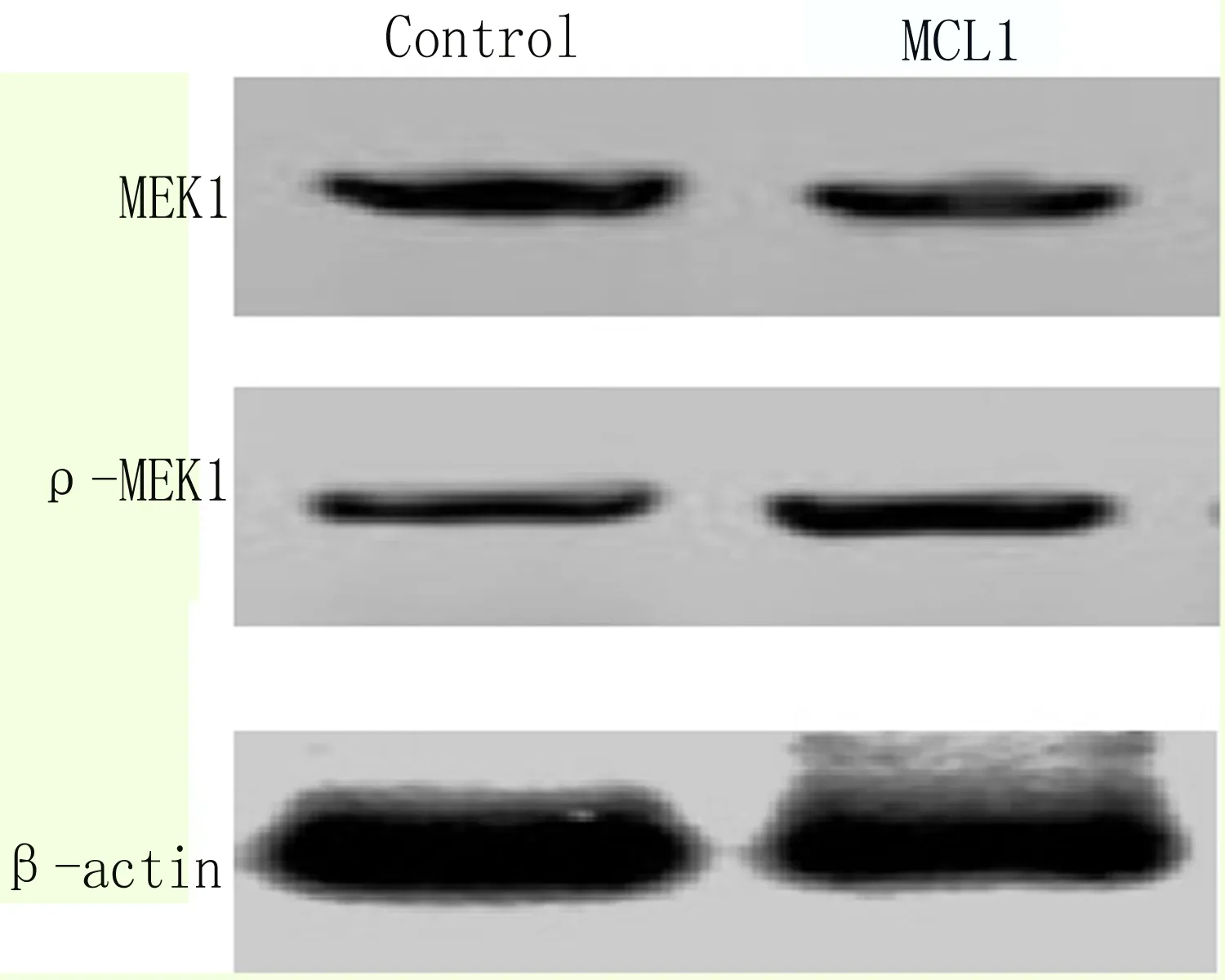
图8 Western blot 检测超表达MCL1后细胞内MEK含量变化
3 讨论
MCL1能够和Bcl2互作,在抗细胞凋亡方面发挥作用,癌细胞通常由正常细胞转化产生,因此,抗凋亡和调控细胞分化的BCL1基因可能和癌细胞的生成存在相关性。除了在骨髓瘤中检测其和癌症的预后相关外,在前列腺癌[2]、胃癌[3]等均和癌症的发生存在相关性。但是,MCL1是否可以作为食管癌的标记基因,在食管癌中的表达规律还不清楚。本研究通过对近期临床上收集的12份食管癌组织样品进行检测,发现大部分癌组织中均高表达MCL1基因。因此,笔者推测在食管癌发生中,MCL1也可能发挥重要作用。

图9 相对定量PCR检测超表达MCL1后EC9706细胞内 C-MYC、C-FOS和CCND1基因表达量变化 两组比较,*P≤0.05;**P≤0.01
癌细胞和正常细胞的一个差异是癌细胞能够持续增殖,前期研究表明,MCL1是维持T细胞存活重要的基因[4]。在前列腺癌细胞中,MCL1是一个治疗靶点,抑制MCL1的表达能够诱导前列腺癌细胞增殖[5]。这些结果表明MCL1在调控癌细胞增殖时发挥重要作用,为检测在食管癌中过表达MCL1是否影响细胞增殖和迁移,实验中通过构建表达MCL1的真核表达载体,验证了超表达的MCL1能够促进EC9706细胞增殖并促进其迁移。这些结果提示,MCL1对食管癌细胞EC9706的增殖也很重要。
能够调控EC9706细胞增殖的因素较多,一些中药有效成分如六君子汤,乙酸乙酯部位可以调控IL-6/STAT3信号通路进而调控EC9706增殖[6];壁虎活性肽[7]和兖州卷柏总黄酮[8]能够通过调节其线粒体凋亡通路相关蛋白促进EC9706细胞凋亡抑制其增殖。这些结果表明,有多种药物可以调控EC9706细胞增殖。而MCL1调控细胞增殖的机制研究也比较多,有研究显示,在黑色素瘤细胞中,同时靶向MCL1和ERK1/2信号通路能够改善患者的预后[9];在胶质瘤细胞中,沉默MCL1基因后能够导致PI3K/AKT信号通路的抑制,进而促进胶质瘤细胞的凋亡[10]。但是,对于MCL1调控EC9706细胞增殖的机制还不清楚。有研究显示靶向MCL1和MEK的抑制剂共同使用,利于非小细胞肺癌[11]、急性髓系白血病细胞[12]和胰腺癌细胞[13]凋亡,这些结果提示,MCL1可能和MEK共同发挥作用对癌细胞抑制明显,推测二者起协同互补作用,但是MCL1和MEK是否存在相互调节还没有研究。本实验中在EC9706细胞中超表达MCL1,检测到下游MEK蛋白磷酸化增加,这些结果提示MCL1不仅和MEK是两个协同互补的靶点,相互之间还存在调控关系。
MEK信号通路激活,除了本身磷酸化水平的增加,其下游靶分子也能被激活。MEK下游靶分子有C-FOS、cyclinD1和C-MYC等。C-FOS、C-MYC和 cyclinD1等是处于MEK下游调控细胞增殖的基因[14],实验中也发现这些MEK下游基因表达量提高,进一步证明MCL1能够激活MEK信号通路。
总之,实验证明MCL1促进细胞增殖能够通过靶向MAPK-MEK信号通路发挥作用,为MCL1调控癌细胞增殖机制提供新的理论依据。
——一道江苏高考题的奥秘解读和拓展

