传染性法氏囊病病毒的病毒样颗粒制备及免疫原性分析
黄建飞,申翰钦,张钰坤,巫秀红,黄松健,严专强,周庆丰*
(1. 温氏食品集团股份有限公司,广东 云浮 527400;2. 广东省畜禽健康养殖与环境控制企业重点实验室,广东 云浮 527400 3. 华南农业大学动物科学学院,广东 广州 510642;4. 华南农业大学兽医学院,广东 广州 510642)
鸡传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病病毒(infectious bursal disease virus,IBDV)引起的一种免疫抑制性传染病,发病率和死亡率高,具有急性、高度的传染性,3~12周龄的雏鸡和青年鸡易感,严重危害世界家禽业,对养鸡业造成了严重的经济损失[1-2]。IBDV基因组编码5种蛋白,分别为VP1、VP2、VP3、VP4和VP5蛋白,其中VP2和VP3是病毒的主要结构蛋白,是病毒核衣壳组成的主要成分。VP2蛋白能诱导中和抗体,与病毒毒力和抗原变异相关,是IBD防控中主要的抗原靶基因[3-5]。
目前市场上IBDV疫苗主要有载体疫苗、中等毒力的弱毒疫苗和灭活疫苗,其中基因工程苗也有相关报道。基因工程苗因其副作用小、免疫原性高等特点,成为生产应用上常见的禽病疫苗[6]。本研究采用原核表达系统,在大肠杆菌中表达IBDV的VP2蛋白。因相关文献报道,融合标签能促进重组蛋白的可溶性表达,本试验采用组氨酸(His)和麦芽糖(MBP)2种融合标签与VP2基因进行融合表达和纯化,烟草蚀纹病毒(tobacco etch virus, TEV)蛋白酶切除标签后形成病毒样颗粒(VLP),并通过动物试验评估VLP的免疫原性和保护效果,为IBDV基因工程疫苗的研制提供参考。
1 材料与方法
1.1 病毒
IBDV强毒株W2512G-61,由温氏食品集团股份有限公司研究院提供。
1.2 载体与菌株
pSYno-1载体购自常州基宇生物科技有限公司;His-TEV蛋白酶由本实验室制备;BL21(DE3)、TOP10感受态细胞购于TaKaRa公司。
1.3 主要试剂
病毒基因组提取试剂盒(RaPure Viral RNA/DNA Kits),购自美基生物公司;氨苄青霉素、琼脂糖,购自上海生工生物股份有限公司;Protein Marker,购自Thermo公司;Gold view I型核酸染色剂、DL2000 Marker、DL5000 Marker、一步法转录试剂盒(PrimeScriptTMOne Step RT-PCR Kit Ver.2)、反转录试剂盒(PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit)、PremixExTaqProbe qPCR,均购自TaKaRa公司。
1.4 实验动物
1日龄SPF鸡由大华农生物科技有限公司提供。
1.5 方法
1.5.1 VP2基因原核表达载体的构建
提取IBDV强毒株dsRNA,-20 ℃保存。根据参考文献[7]合成VP2基因的引物。上游引物F:5′-CGAGCTCGATGACAAACCTGCAAGATCAAC-3′(下划线部分为SacⅠ酶切位点),下游引物R :5′-CCGCTCGAGCGGCACCGGCACAGCTATCTCCTT-3′(下划线部分为XhoⅠ酶切位点),预期扩增产物大小为1 356 bp ,引物由广州生工生物科技有限公司合成。将VP2扩增的目的片段和原核表达载体pSYno-1分别用SacⅠ/XhoⅠ双酶切,凝胶电泳后,回收各自目的片段,连接后转化TOP10感受态细胞,重组质粒用SacⅠ和XhoⅠ双酶切鉴定,重组表达质粒命名为pSYno-1-VP2。
1.5.2 重组蛋白的表达与可溶性分析
重组质粒pSYno-1-VP2转化表达菌株BL21(DE3),挑取重组菌单菌落接种于含有Kana(50 μg/mL)的1 000 mL 的LB培养基,37 ℃ 220 r/min振荡培养至OD600 nm到0.6,加入IPTG(0.5 mmol/L),在22 ℃ 160 r/min过夜培养诱导蛋白表达,用缓冲液Binding Buffer(20 mmol/L Tris-HCl,300 mmol/L NaCL,pH=8.0)重悬菌体,超声波破碎仪进行破碎,破碎后的混合液 4 ℃、12 000 r/min离心30 min收集上清,通过SDS-PAGE分析,测定蛋白可溶性。
1.5.3 蛋白纯化
收集上述表达的上清加入含有NI-NTA填料的柱子,选用洗杂缓冲液(20 mmol/L Tris-HCl,300 mmol/L NaCl,50 mmol/L咪唑,pH =8.0)洗去非特异性杂带,最后用洗脱缓冲液(20 mmol/L Tris-HCl,300 mmol/L NaCl,400 mmol/L咪唑,pH=8.0)洗脱pSYno-1-VP2重组蛋白。通过TEV蛋白酶酶切纯化得到的His-MBP-VP2重组蛋白,4 ℃过夜反应,反应后继续用NI-NTA填料柱进行纯化,收集VP2蛋白,通过透析去除咪唑,浓缩后用BSA蛋白测定VP2蛋白的浓度。
1.5.4 电镜观察
将洗脱后的VP2蛋白用50 mmol/L Tris-HCl与300 mmol/L NaCl作为缓冲液,分析VLP的组装情况和外观,是否形成纳米颗粒,通过透射电镜(TEM)检测收集的蛋白。
1.5.5 VLP免疫原性试验
将纯化后的VP2蛋白与白油佐剂以2∶3体积比混合并乳化,通过颈部皮下免疫接种10只1日龄SPF鸡,免疫剂量为20 μg/只,免疫后7 d加强免疫1次,二免后14 d检测血清抗体并与对照组同时口服攻毒,攻毒剂量为104.0ELD50,攻毒后观察免疫攻毒组和对照攻毒组的临床症状,并在攻毒后3、5和7 d采集肛拭子和血清,攻毒后4和7 d采集组织样品进行相应的抗体和排毒检测。荧光定量PCR反应,引物参考文献[7],按TaKaRa PremixExTaqTM(Probe qPCR)试剂盒操作,其中20 μL反应体系包含PremixExTaq10 μL,上下游引物各0.4 μL,探针(Probe)0.8 μL,ROX Reference Dye Ⅱ 0.2 μL,模板2 μL,RNase Free dH2O 6.2 μL。反应程序为95 ℃ 5 min;95 ℃ 20 s,60 ℃ 30 s,共计45个循环。
1.5.6 统计与分析
用Graphpad prism 5.0 和SPSS 20.0 软件对试验数据进行作图和统计学分析。数据以“平均值±标准差”表示。
2 结果与分析
2.1 VP2基因的扩增
对分离株IBDV-20152010进行核酸提取,通过特异性引物对目的产物进行PCR扩增,得到目的条带长度约为1 356 bp,与预期扩增的基因片段大小相符(图1)。
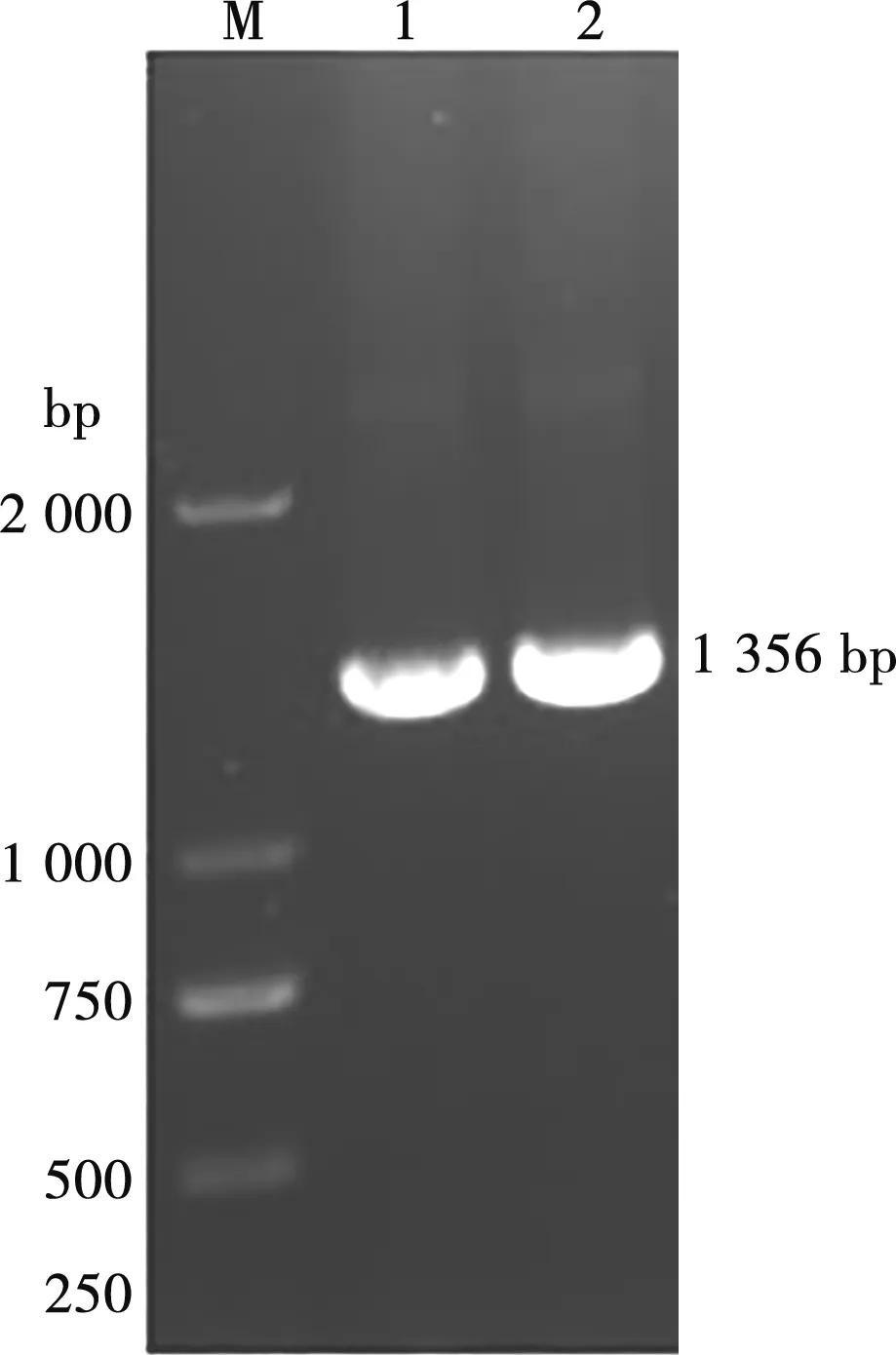
M. DL2000 Marker;1、2. VP2基因
2.2 重组质粒的酶切鉴定
重组质粒pSYno-1-VP2分别用SacⅠ/XhoⅠ进行双酶切鉴定,结果显示2条条带,其中目的基因片段约为1 300 bp,与预期条带大小相符(图2)。
2.3 重组蛋白的表达
将重组质粒pSYno-1 -VP2转化表达菌BL21(DE3)中,加入IPTG过夜诱导表达,通过SDS-PAGE分析,IPTG诱导后蛋白明显表达,分子量为105 ku,同时通过可溶性分析,上清和沉淀中均有表达(图3)。

M.DL5000 Marker;1. T-VP2双酶切产物;2. T-VP2质粒
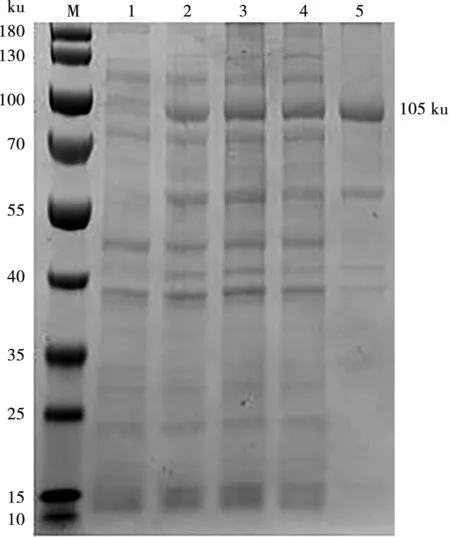
M.蛋白Marker;1. Psyno-1-VP2诱导前菌体蛋白;2. Psyno-1-VP2诱导后菌体蛋白;3. Psyno-1-VP2超声破碎后菌体;4. Psyno-1-VP2破碎后上清液;5. Psyno-1-VP2破碎后沉淀
2.4 重组蛋白TEV酶切
将上清中的蛋白加入含有NI-NTA填料的柱子进行纯化,用TEV酶进行酶切,酶切后的产物通过SDS-PAGE鉴定后,再用NI-NTA亲和层析纯化。结果显示,大约90%的VP2重组蛋白通过TEV蛋白酶被切开,得到不含His-MBP标签的VP2目的蛋白,由于二次纯化对目的蛋白损失较大,最终得到的蛋白浓度较低(约0.1 mg/mL)(图4)。
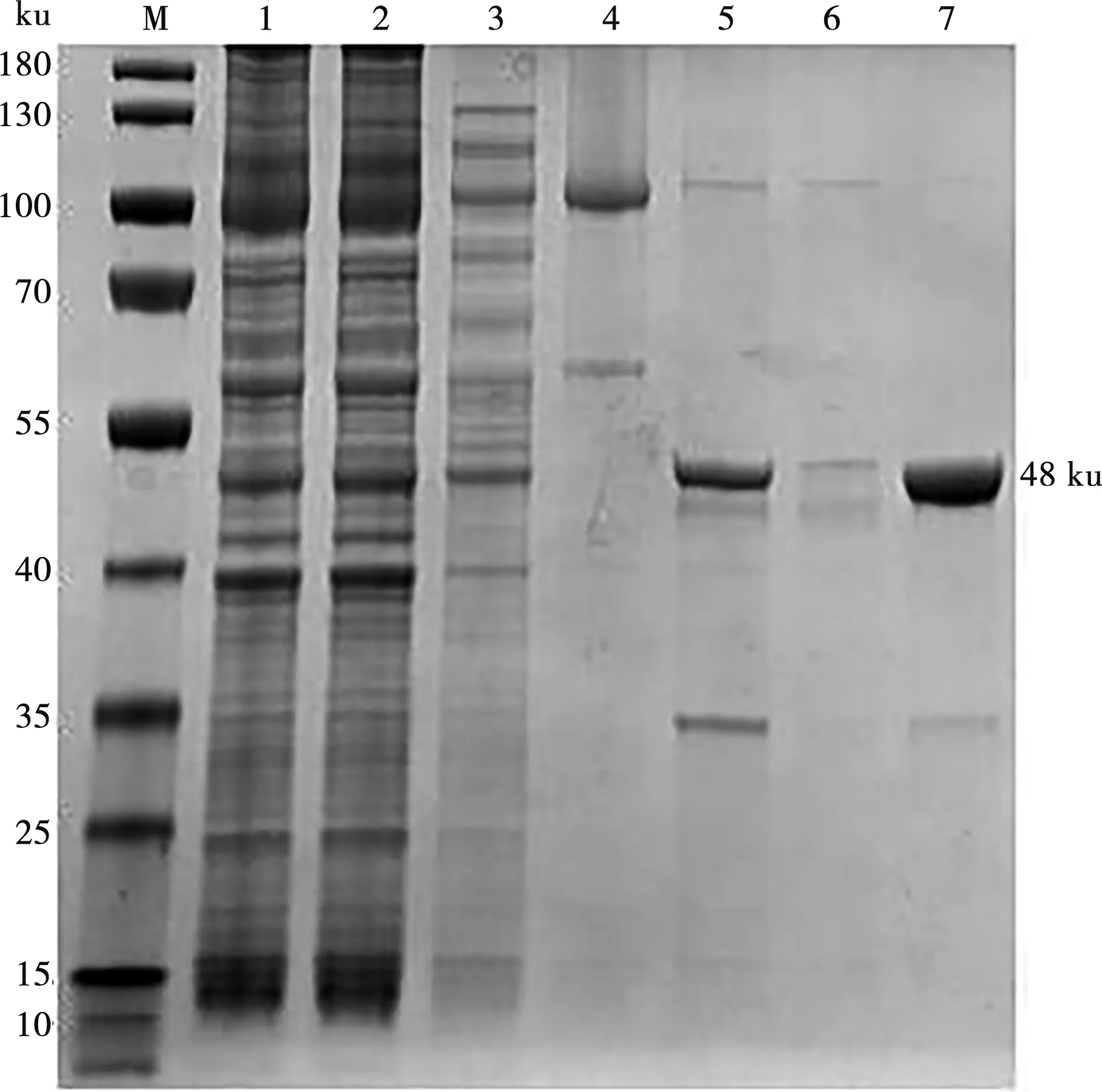
M.蛋白Marker;1.Psyno-1 -VP2镍柱纯化前菌体总蛋白;2.Psyno-1 -VP2过镍柱后菌体总蛋白;3.Psyno-1 -VP2过镍柱后菌体杂蛋白;4.Psyno-1-VP2过镍柱后目的蛋白;5.TEV酶切后的Psyno-1-VP2蛋白;6.VP2目的蛋白;7.浓缩后的VP2目的蛋白
2.5 电镜检测
对目的蛋白VP2进行浓缩,得到更高纯度(1.0 mg/mL)的蛋白,通过透射电镜观察,镜检结果显示形成了明显的病毒样结构以及纳米颗粒状,且结构、大小和形状与预期相符(图5)。
2.6 VLP免疫原性试验
免疫后21 d,免疫组抗体水平明显高于非免疫组(图6A)。攻毒后4 d,非免疫组死亡3只,剖检观察到腿部肌肉有出血点、脾脏肿大、胸腺出血、法氏囊出血等症状;免疫组无死亡,剖检观察腿肌和胸腺无明显临床症状。攻毒后4 d,非免疫组病理组织学观察到脾脏淋巴细胞缺失,内皮细胞裸露和严重坏死,法氏囊囊泡内几乎所有的淋巴细胞均坏死;免疫组病理组织学观察到脾和法氏囊组织结构接近正常,未见明显病理变化(图6B)。从拭子检测结果来看,攻毒后3 d,非免疫组阳性率100%(6/6),免疫组阳性率16.7%(1/6);攻毒后5 d,非免疫组阳性率16.7%(1/6),免疫组无排毒(0/6);攻毒后7 d,非免疫和免疫组均无排毒(0/6)。
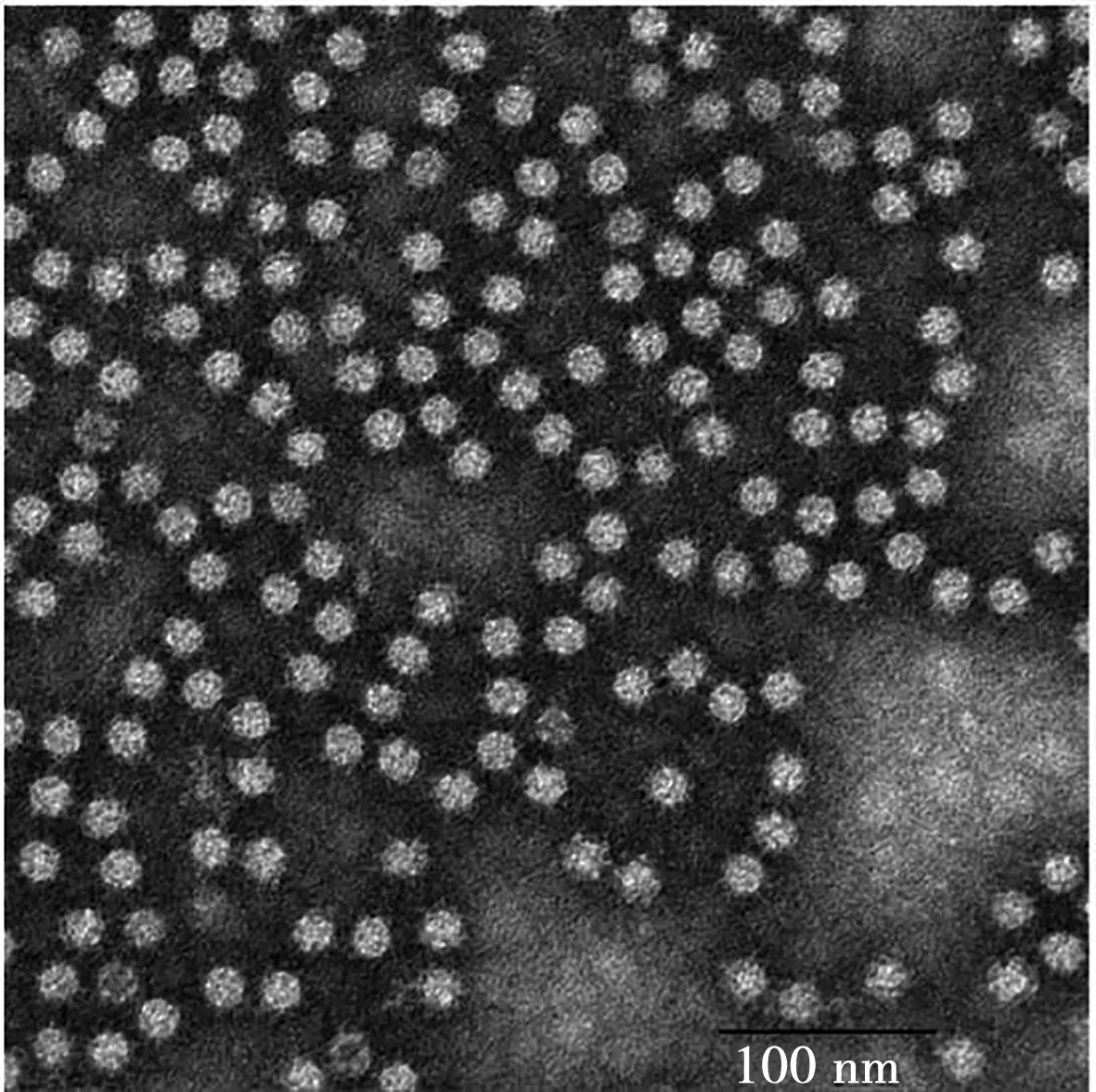
图5 VP2重组蛋白纳米颗粒透射型电子显微图像
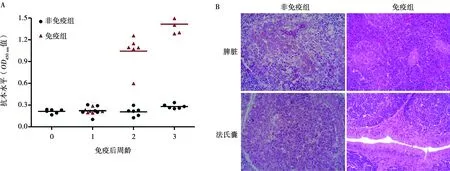
A.免疫后14 d抗体水平;B.攻毒后4 d病理学组织切片检测(200×)
攻毒后4 d,与免疫组相比,非免疫组脾体比和囊体比均高于免疫组,且差异显著(P<0.05)(图7A)。攻毒后7 d,与免疫组相比,非免疫组脾体比高于免疫组,且差异显著(P<0.05),囊体比低于免疫组,且差异极显著(P<0.01)(图7B);血清qPCR结果显示,攻毒后3 d,与非免疫组相比,免疫组血清病毒载量极显著降低(P<0.01)(图7C);从组织qPCR结果显示,攻毒后4 d,与非免疫组相比,免疫组脾脏和法氏囊病毒载量极显著降低(P<0.01)(图7D);攻毒后7 d,与非免疫组相比,免疫组法氏囊病毒载量极显著降低(P<0.01)(图7E)。
3 讨论
目前预防IBDV的主要措施有免疫载体疫苗、灭活疫苗、弱毒疫苗,但载体疫苗产生抗体较慢,灭活疫苗生产成本高,而弱毒疫苗生物安全风险较大。为了解决这一难题,开发了VLP疫苗,通过纯化后的蛋白自我组装成病毒样颗粒,同时具有与真正的病毒粒子相似的空间立体结构,这些VLP既可以诱导B细胞免疫蛋白受体的交联,还参与特异效应B细胞的活化和体液免疫,还可通过CD8+T细胞诱导机体的特异性细胞免疫。正是通过这种方式,使机体产生广泛而强烈的免疫反应,相较于传统疫苗具有更明显的优势,VLP已经成为一种很有前途的疫苗平台[8]。
基于VLP的疫苗已广泛用于疫苗研究,包括乙型肝炎病毒、人乳头瘤病毒和猪圆环病毒2型等等,IBDV VLP疫苗也有相关报道,Rogel等[9]将目的基因插入大肠杆菌表达载体pET-21a中,纯化后的蛋白电镜可观察到VLP,免疫后能够产生抗体;Kibenge等[10]通过杆状病毒表达IBDV目的蛋白,同样可以自动组装成VLP。VLP疫苗的生产、纯化和储存对开发基于VLP的疫苗具有重要意义[11]。本研究旨在评价IBDV VLP疫苗的免疫原性。
目前在蛋白表达系统中,有大肠杆菌、酵母和真核细胞等多种表达系统,其中大肠杆菌表达系统在目前蛋白表达中较为广泛,因其具有操作简便、转化利用率高和价格成本低等优点[12]。本研究使用pSYno-1载体通过原核表达系统对实验室分离的强毒株VP2蛋白进行表达,pSYno-1载体含有His和MBP标签,MBP标签对于蛋白在大肠杆菌中的可溶性表达有促进作用[6],同时在融合标签与VP2之间设有TEV蛋白酶切位点,可以特异性除去标签蛋白。
本研究构建了pSYno-1-VP2重组表达载体,转化到BL21(DE3)感受态细胞中,成功表达了融合蛋白,且可溶性蛋白表达量约为50%,通过TEV蛋白酶切后获得目的蛋白,分子质量约为48 ku,与预期蛋白大小一致。电镜结果显示,蛋白在电子显微成像中能够自我组装成病毒样颗粒。由于TEV蛋白酶切割后进行二次纯化中蛋白损失过大,我们选用TEV蛋白酶切开后的蛋白溶液对SPF鸡进行皮下免疫试验。结果表明,与非免疫组相比,免疫组在SPF鸡皮下接种21 d后产生高水平的抗体,初步证实VP2蛋白VLP疫苗具有很好的免疫原性。攻毒保护试验结果显示,攻毒后4和7 d,非免疫组脾体比大于免疫组,表明非免疫组脾脏组织已经发生肿大;攻毒后4 d,非免疫组囊体比大于免疫组,而攻毒后7 d,非免疫组囊体比小于免疫组,这可能是非免疫组在攻毒后4 d法氏囊受损导致成长停滞不前的原因。与非免疫组相比,免疫组拭子、血清和组织的排毒量显著低于非免疫组,从而进一步证明VP2蛋白VLP疫苗能有效刺激机体产生特异性免疫应答,这为研制新型的IBD基因工程疫苗奠定了良好的基础。

