NcFBPase通过激活小鼠巨噬细胞MAPK和AKT通路诱导炎性细胞因子表达
陈梦阁,李新,张旭,王晓岑,孙智超,张西臣,宫鹏涛,李建华
(吉林大学动物医学学院,吉林 长春 130062)
新孢子虫是近年来发现的一种在细胞内寄生的顶复门原虫,主要是犬新孢子虫(Neosporacaninum),其可感染多种动物,引起牛、羊等中间宿主的生殖障碍等疾病,以及犬科动物等终末宿主的神经紊乱,导致幼畜运动障碍、脑膜炎等疾病。新孢子虫病呈世界性分布,已有40多个国家发现了新孢子虫,美国、澳大利亚等国奶牛和肉牛新孢子虫感染率一般为10%~82%,我国奶牛新孢子虫感染率平均为20%~25%,据统计新孢子虫病每年给世界经济造成约5.5亿美金的损失,其中养牛业损失最大[1]。新孢子虫能够主动侵入包括免疫细胞在内的多种宿主细胞,具有激活宿主细胞模式识别受体和相应通路的保守成分,引起机体的免疫应答。因此,探究新孢子虫自身成分对宿主免疫系统的调节功能,有助于找到防控新孢子虫病的新靶点。
果糖-1,6-二磷酸酶(Fructose-1,6-biphosphatase, FBPase)是糖异生的关键调节酶,在生物的代谢及发育中起到重要的调控作用[2]。在寄生虫FBPase研究方面,曼氏血吸虫FBPase参与糖异生,为寄生虫的生长提供能量[3]。利什曼原虫FBPase通过参与还原型辅酶Ⅱ合成来保护大鼠视网膜免受活性氧的侵害[4]。利什曼原虫FBPase是虫体的毒力因子,FBPase缺失使利什曼原虫致病性降低[5]。华支睾吸虫FBPase聚集在人类肝星状细胞LX-2膜上,并促进LX-2细胞的增殖和活化,上调α-平滑肌肌动蛋白、I型胶原蛋白和III型胶原蛋白等关键纤维化因子,导致肝脏纤维化[6]。同时,FBPase在多种疾病发生中起关键作用,如在胰腺癌中,FBPase可以通过阻断IQ结构域三磷酸鸟苷合酶-激活蛋白1-丝裂原活化蛋白激酶(IQGAP1-MAPK)相互作用,抑制细胞外调节蛋白激酶(ERK)激活[7]。然而,关于新孢子虫FBPase蛋白的功能及其免疫调节作用的研究尚未见报道。
本研究利用原核表达系统获得NcFBPase重组蛋白(rNcFBPase),对NcFBPase蛋白进行了免疫调节研究,发现rNcFBPase通过激活小鼠腹腔巨噬细胞的丝裂原活化蛋白激酶(MAPK)和蛋白激酶B(AKT)信号通路诱导白细胞介素-6(IL-6)、白细胞介素-12(IL-12)和肿瘤坏死因子-α(TNF-α)细胞因子的分泌,为后续研究NcFBPase蛋白的免疫功能及宿主抗新孢子虫免疫机制奠定基础。
1 材料与方法
1.1 虫体、细胞和试验动物
新孢子虫速殖子Nc-1株、Vero细胞均由本实验室冻存。6~8周龄野生型C57BL/6雌鼠购自辽宁长生实验动物中心。
1.2 主要试剂
RPIM-1640培养基与胎牛血清,购自Biological公司;青链霉素、20×PBS、氨苄青霉素、IPTG诱导剂、PCR产物回收试剂盒,购自上海生物工程有限公司;巯基乙酸培养基,购自BD Biosciences公司;反转录试剂盒、Primer star Mix、T4连接酶、EcoRⅠ和XhoⅠ快切酶,购自TaKaRa公司;pGEX-4T-1表达载体为实验室冻存;大肠杆菌感受态DH-5α、BL21(DE3)和GST蛋白纯化填料,购自全式金公司;质粒小提取试剂盒、胶回收试剂盒,购自天根生物公司;Triton X-114、P38/ERK/AKT抑制剂,购自Sigma公司;内毒素检测试剂盒,购自GenScript公司;RIPA细胞裂解液,购自碧云天公司;BCA蛋白浓度检测试剂盒,购自Thermo公司;P-p38、p38、P-ERK1/2、ERK1/2、P-AKT、AKT和GAPDH抗体,购自Abcam公司;羊抗兔IgG-HRP,购自Proteintech公司;小鼠IL-6、IL-12、TNF-α细胞因子检测试剂盒,购自Thermo Scientific公司。
1.3 细胞及新孢子虫速殖子的培养
1.3.1 Vero细胞的培养
将冻存的Vero细胞放入37 ℃水浴锅中使其解冻,转移至细胞培养瓶内用含5%胎牛血清和1%青链霉素的RPIM-1640培养基置于37 ℃ 5% CO2细胞培养箱中进行培养,待其长满后进行传代。
1.3.2 新孢子虫速殖子的培养
将新孢子虫接种于Vero细胞中进行培养,所用培养基为含有2%胎牛血清和1%青链霉素的RPIM-1640培养基,于37 ℃ 5% CO2细胞培养箱中,每天更换培养基,待新孢子虫从细胞中完全逸出后,吸出1 mL进行传代培养,其余虫体用Percoll法纯化待用。
1.3.3 小鼠腹腔巨噬细胞(PMs)的分离及培养
用3 mL巯基乙酸培养基对小鼠进行腹腔注射,3~4 d后安乐处死小鼠,置于75%酒精中浸泡10 min,随后在无菌条件下进行PMs的分离。用10 mL的注射器将适量1×PBS注入小鼠腹腔内随后吸出放于50 mL离心管,2 000 r/min离心10 min,用1 mL培养基重悬PMs,计数后按照需要铺于细胞培养板,用添加10%胎牛血清和1%青链霉素的RPIM-1640培养基于37 ℃ 5% CO2细胞培养箱中培养。
1.4 NcFBPase的克隆、表达和纯化
根据NcFBPase基因序列和原核表达载体pGEX-4T-1的多克隆位点设计引物,NcFBPase-F:5′-GGAATTCATGGCGACAAATGCACAGC-3′和NcFBPase-R:5′-CCTCGAGCTACGCGTTGTTAGTACCCA-3′,引物由库美生物科技有限公司合成。以新孢子虫cDNA为模板,PCR扩增NcFBPase基因。PCR产物经1%琼脂糖凝胶电泳检测后,用PCR产物回收试剂盒对所扩增的NcFBPase基因进行纯化。将NcFBPase基因的纯化产物和pGEX-4T-1质粒用EcoRⅠ和XhoⅠ快切酶进行37 ℃酶切20 min,酶切产物经纯化回收后利用T4连接酶于4 ℃过夜连接;将连接产物转入大肠杆菌感受态DH-5α中,37 ℃摇床培养1 h后涂布于含有氨苄青霉素的LB固体培养基上,37 ℃倒置培养;挑取单菌落进行PCR验证,对阳性菌液扩大培养后提取质粒DNA,进行双酶切鉴定并送库美生物科技有限公司进行测序。将pGEX-4T-1空载质粒及pGEX-4T-1-NcFBPase重组质粒转入BL21感受态细胞,挑取单菌落于6 mL含有氨苄青霉素的LB液体培养中,37 ℃摇床过夜培养;菌液按1∶100的比例转接于300 mL含有氨苄青霉素的LB液体培养中,37 ℃摇床培养至OD600值约为0.6~0.8时,加入IPTG至终浓度为1 mmol/L,37 ℃ 140 r/min诱导表达5 h;随后将诱导表达的菌液8 000 r/min离心10 min,1×PBS重悬菌体,超声破碎,再次离心分离沉淀和上清,同时收集诱导表达的空载体、未诱导的菌液作为阴性对照,菌液经制样后通过SDS-PAGE和考马斯亮蓝染色进行可溶性分析,随后用GST蛋白纯化填料对目的蛋白进行纯化。
1.5 rNcFBPase蛋白内毒素的去除及含量检测
将终浓度为1%的Triton X-114加入到rNcFBPase蛋白液中,剧烈振荡,冰上放置10 min,随后37 ℃水浴锅中放置10 min;然后将样品12 000 r/min离心10 min,吸取上层水相。将上述过程重复3次,收集含有蛋白质的上层水相。
按照说明书步骤,使用ToxinSensorTM显色LAL内毒素检测试剂盒检测rNcFBPase蛋白中的内毒素含量。蛋白经0.22 μm滤器过滤除菌,取部分测蛋白浓度,剩余蛋白保存在-80 ℃的冰箱内。
1.6 小鼠腹腔巨噬细胞活力的检测
将小鼠PMs以1×104的密度铺于96孔板中培养6 h,分别用PBS和浓度为12.5、25、50、100、200 μg/mL的rNcFBPase刺激PMs 24 h,每孔加入10 μL CCK-8试剂,37 ℃ 5% CO2细胞培养箱中孵育2 h后在450 nm波长处测定吸光值。
1.7 Western blot检测
将小鼠PMs以3×106个细胞/孔的密度铺于6孔细胞培养板,待其贴壁后,用PBS、终浓度为50 μg/mL的GST和rNcFBPase孵育细胞0.5、1、2、4、6 h。收取全细胞裂解液,使用BCA试剂盒检测蛋白含量;每孔上样30 μg,SDS-PAGE进行蛋白分离,湿转法将蛋白转移至PVDF膜上;5%脱脂奶粉室温封闭2 h;分别4 ℃过夜孵育兔抗P-p38(1∶1 000)、兔抗总p38(1∶1 000)、兔抗P-ERK1/2(1∶1 000)、兔抗总ERK1/2(1∶1 000)、兔抗P-AKT(1∶1 000)、兔抗总AKT(1∶1 000)和兔抗GAPDH(1∶1 000);TBST洗膜4次,10 min/次;羊抗兔IgG-HRP抗体(1∶5 000)室温孵育1 h;TBST洗膜4次,10 min/次;膜通过增强化学发光液(ECL)显色后经Western blot检测系统进行蛋白检测,Image J进行灰度分析。
1.8 ELISA检测
将小鼠PMs以5×105细胞/孔的密度铺于24孔细胞培养板,待其贴壁后,用p38抑制剂(SB203580,30 mmol/L)、ERK抑制剂(PD98059,40 mmol/L)、AKT抑制剂(IV,10 mmol/L)或DMSO预处理PMs 1 h,再用rNcFBPase进行孵育细胞24 h,随后收集上清并用细胞因子ELISA检测试剂盒检测IL-6、IL-12和TNF-α水平。具体操作参照试剂盒中说明书。
1.9 数据统计与分析
所有试验进行3次重复,采用SPSS软件对组内数据进行单因素方差分析。数据使用“平均数±标准差”表示。
2 结果与分析
2.1 NcFBPase基因的扩增、重组质粒的构建及重组蛋白的表达
琼脂糖凝胶电泳结果显示NcFBPase基因扩增产物大小约为1 050 bp,与预期目的基因片段大小相一致(图1A)。重组质粒的双酶切鉴定结果表明,酶切产物大小与基因预期大小相符合(图1B)。以上结果表明成功构建了pGEX-4T-1-NcFBPase重组质粒。诱导表达后,考马斯亮蓝染色显示rNcFBPase在上清和沉淀均有表达(图1C),并用GST填料纯化rNcFBPase,成功获得大小为65 ku的rNcFBPase(图1D)。
2.2 rNcFBPase对小鼠腹腔巨噬细胞活力的影响
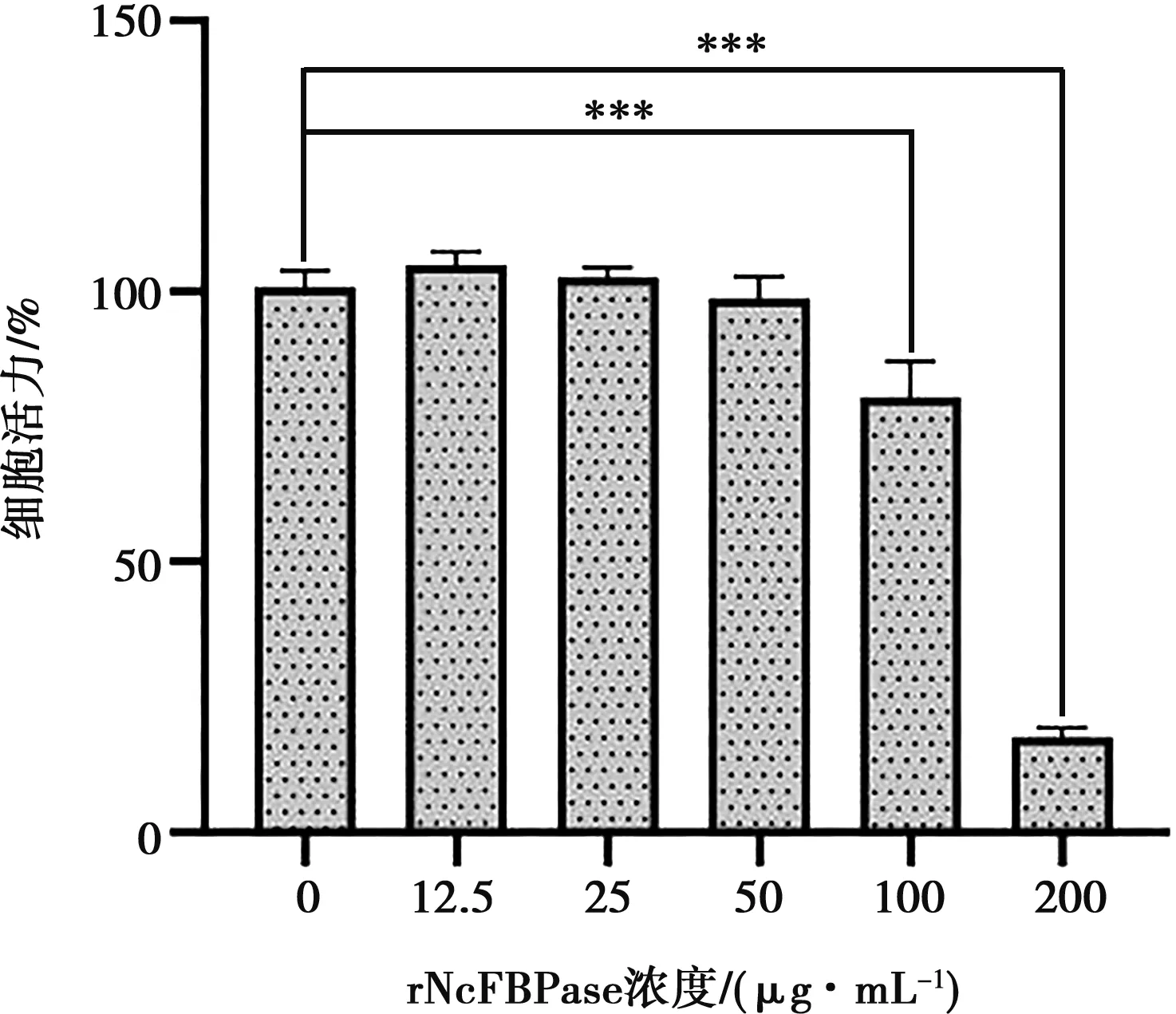
采用CCK-8法检测rNcFBPase对小鼠腹腔巨噬细胞活力的影响,确定其最适刺激浓度。与空白组相比,rNcFBPase组在低于50 μg/mL的浓度下对细胞活力无影响(P>0.05),而在100和200 μg/mL的浓度下,细胞活力极显著降低(P<0.01)。因此,rNcFBPase对小鼠腹腔巨噬细胞作用的适宜浓度为50 μg/mL(图2)。
2.3 rNcFBPase激活MAPK信号通路促进炎性细胞因子表达
为探讨NcFBPase能否激活MAPK信号通路,采用Western blot检测p38和ERK的磷酸化水平,并进行灰度分析。结果显示,与对照组相比,rNcFBPase刺激PMs引起p38和ERK的磷酸化,p38(2 h)和ERK(4 h)的磷酸化水平达到峰值,之后随时间的延长蛋白磷酸化水平恢复正常(图3A、3B、3C),表明rNcFBPase可以激活小鼠巨噬细胞MAPK信号通路。
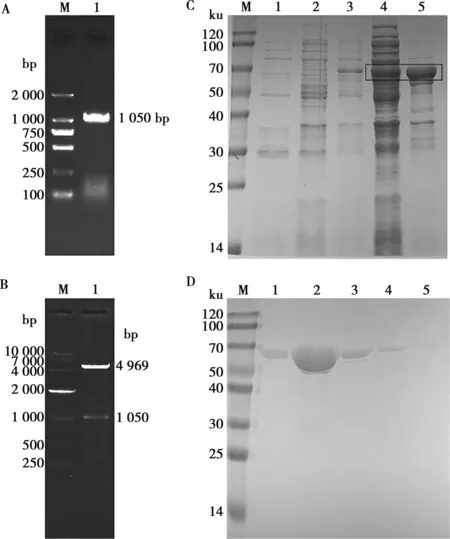
A.PCR产物电泳图:M.DNA分子量;1.NcFBPasePCR产物;
*表示P<0.05,**表示P<0.01,***表示P<0.001。下同
为了进一步研究rNcFBPase通过MAPK信号通路对细胞因子的影响,采用ELISA检测IL-6、IL-12和TNF-α细胞因子的分泌量。结果显示,与空白组及DMSO组相比,rNcFBPase组IL-6、IL-12和TNF-α细胞因子的分泌量显著升高。与rNcFBPase组相比,SB203580预处理组IL-6分泌量降低约1.5倍(P<0.01,图3D),IL-12的分泌量降低约2倍(P<0.01,图3E),TNF-α 的分泌量降低约1.7倍(P<0.001,图3F);PD98059预处理组IL-6分泌量降低约1.5倍(P<0.05,图3D),IL-12的分泌量降低约2.2倍(P<0.001,图3E),TNF-α的分泌量降低约1.7倍(P<0.001,图3F)。阻断MAPK信号通路后,rNcFBPase介导的细胞因子产生减少,表明rNcFBPase通过MAPK信号通路调控宿主细胞炎性细胞因子产生。
2.4 rNcFBPase激活AKT信号通路促进炎性细胞因子表达
为探讨NcFBPase是否激活AKT信号通路,采用Western blot检测rNcFBPase刺激小鼠PMs不同时间点时AKT蛋白的磷酸化水平。如图所示,AKT自1 h起磷酸化水平升高,4 h达到峰值,随后AKT蛋白磷酸化水平随时间增加逐渐降低,表明NcFBPase蛋白可以激活AKT信号通路(图4A、4B)。
为了探讨rNcFBPase诱导的细胞因子分泌是否与AKT相关。ELISA结果显示,与rNcFBPase组相比,IV预处理组IL-6分泌量降低约1.8倍(P<0.01,图4C),IL-12的分泌量降低约1.9倍(P<0.001,图4D),TNF-α的分泌量降低约1.6倍(P<0.001,图4E)。表明NcFBPase可通过激活AKT通路诱导炎性细胞因子的分泌。
3 讨论
FBPase参与多种细胞的代谢和发育,具有促进细胞生长、分化和抑制肿瘤细胞生长等多方面作用。在干细胞中,FBPase主要用于提供NADPH,对L-赖氨酸的产生具有重要作用,且外源FBPase的过表达能加速干细胞生长[8]。在心肌细胞、平滑肌细胞和卫星细胞中,FBPase存在于细胞核内,参与细胞分化。而在肝细胞中,FBPase通过调节钙离子参与糖异生[9]。在丝状真菌中,FBPase的磷酸酶结构域突变引起替代氧化酶的转录激活和糖异生途径[10]。对寄生虫FBPase研究发现,曼氏血吸虫FBPase参与糖异生,与虫体生长有关[3];利什曼原虫FBPase是虫体的毒力因子[5];华支睾吸虫FBPase是致宿主肝脏纤维化的分子[6]。最近研究发现FBPase在多种癌症发生中起作用,如在前列腺癌中,FBP1抑制癌细胞增殖、降低迁移速度和侵袭能力,且siRNA-FBP1通过提高波形蛋白的表达,激活MAPK信号通路,从而加速癌细胞的上皮细胞间质转型[11]。乳腺癌中FBPase调节Wnt/β-Catenin通路[12]。本实验室前期对新孢子虫胞外囊泡进行蛋白质组学分析发现新孢子虫胞外囊泡中存在FBPase[13],而关于NcFBPase的功能尚不清楚。本研究确定NcFBPase蛋白调控小鼠巨噬细胞信号通路和细胞因子分泌,表明该蛋白与虫体诱导宿主免疫应答有关。
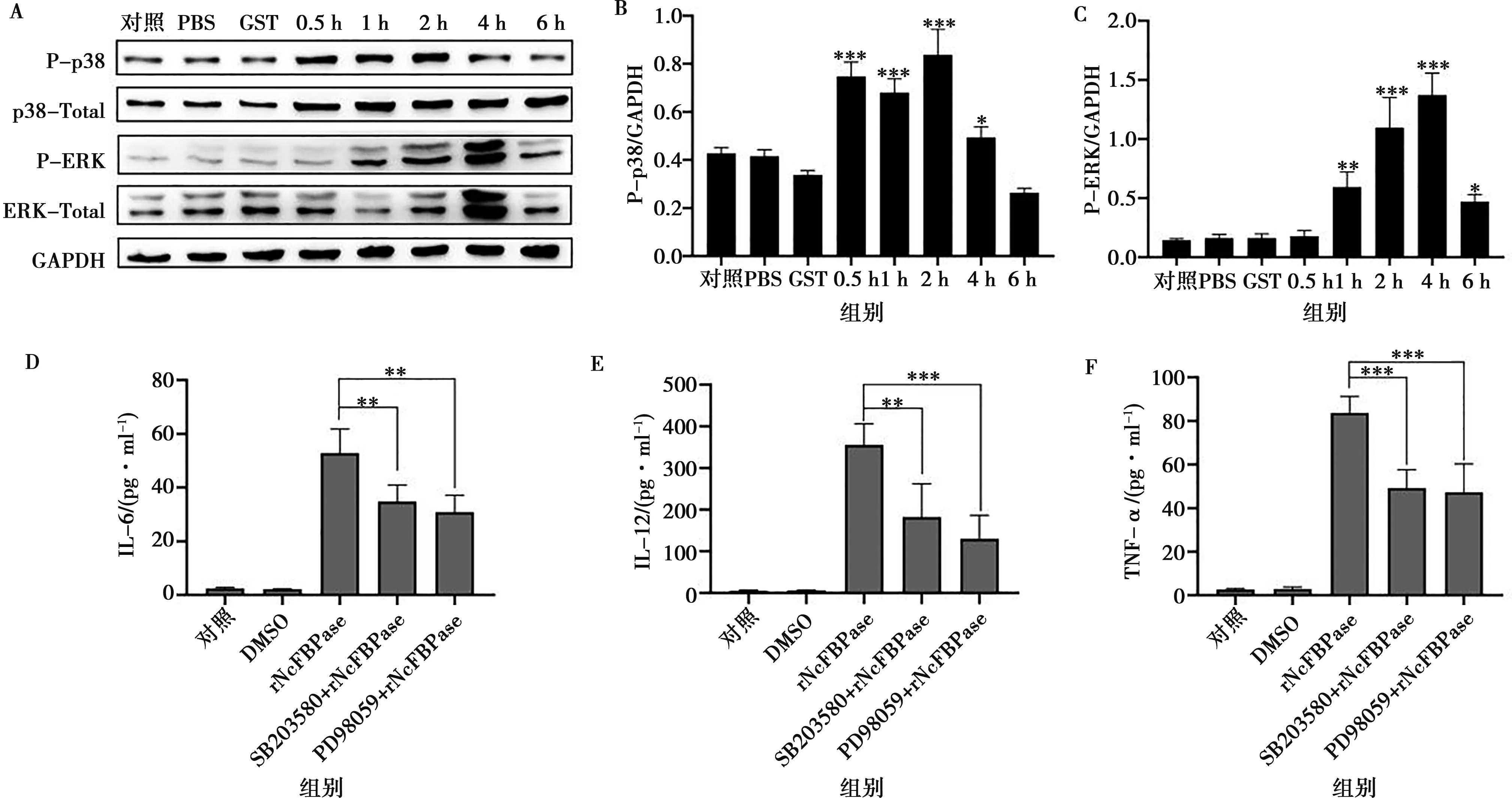
A.p38和ERK的磷酸化水平;B、C.灰度分析;D.IL-6表达;E.IL-12表达;F.TNF-α表达。B、C图中仅与对照组比较差异显著性
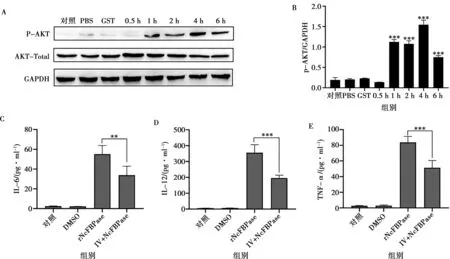
A.AKT的磷酸化水平;B.灰度分析;C.IL-6表达;D.IL-12表达;E.TNF-α表达。B图中仅与对照组比较差异显著性
目前研究发现,新孢子虫及虫体蛋白能够诱导宿主细胞产生多种细胞因子。新孢子虫感染导致了宿主Th细胞的分化,刺激宿主产生IL-6、IL-12、IFN-γ和INF-α等T淋巴细胞1(Th1)型细胞因子反应,同时引起氧自由基、一氧化氮及其代谢物的产生,这些细胞因子对新孢子虫均具有杀伤作用[14]。冷灭活的新孢子虫能够诱导强烈的IL-12、IFN-γ和INF-α的分泌,促使Th1型免疫应答,而热灭活的新孢子虫无此效应[15]。目前已报道新孢子虫虫体蛋白与宿主细胞因子的分泌相关。棒状体蛋白5、棒状体蛋白16和致密颗粒蛋白7参与调控宿主巨噬细胞IFN-γ的分泌及其下游细胞免疫因子GBP1的表达[16-17]。棒状体蛋白16促进新孢子虫对宿主细胞信号转导和转录激活因子3的激活[17]。14-3-3蛋白参与调控小鼠腹腔巨噬细胞IL-6、IL-12和INF-α的分泌[13]。新孢子虫表面蛋白(SRS2)和表面抗原1(SAG1)重组蛋白可激发机体产生Th1型和Th2型免疫反应,诱导宿主IFN-γ和IL-4的分泌[18]。本研究发现rNcFBPase可以促进小鼠巨噬细胞IL-6、IL-12和TNF-α的表达。
MAPK通路能被多种因子激活,调节细胞增殖、分化和发育,还能够调节Th1免疫反应相关的炎性细胞因子分泌,进而影响宿主对寄生虫感染的免疫应答[19]。在新孢子虫和弓形虫感染中,巨噬细胞通过激活p38 MAPK信号通路介导IL-12的产生,抑制虫体增殖[20]。弓形虫的GRA24蛋白从囊泡运输到宿主细胞核可触发宿主细胞p38 MAPK的磷酸化[21]。新孢子虫以及虫体蛋白(全虫蛋白、分泌抗原和胞外囊泡)能够激活小鼠PMs中MAPK和NF-κB通路[13]。已报道胰腺癌和前列腺癌细胞中的FBPase也参与调控MAPK信号通路[7.11]。但NcFBPase是否参与调控MAPK信号通路尚无报道。本研究用rNcFBPase刺激小鼠PMs,发现p38和ERK均发生磷酸化。而p38和ERK通路抑制剂预处理小鼠PMs,能显著抑制由rNcFBPase诱导的IL-6、IL-12和TNF-α分泌。以上这些结果说明NcFBPase通过激活MAPK信号通路调节巨噬细胞炎性细胞因子分泌。
最近研究发现新孢子虫的全虫蛋白以及胞外囊泡也能激活宿主细胞AKT信号通路,诱导IL-6和IL-12产生[13]。但FBPase是否与AKT通路的激活相关尚无报道。本研究发现rNcFBPase能诱导小鼠PMs中AKT蛋白的磷酸化。用AKT通路的抑制剂IV预处理细胞能显著降低由rNcFBPase诱导的IL-6、IL-12和TNF-α的分泌量。以上结果表明NcFBPase可通过激活AKT通路诱导细胞因子的分泌。
综上,本研究表达rNcFBPase蛋白,并探究rNcFBPase与宿主信号通路和细胞因子之间的关系,发现rNcFBPase可以激活小鼠腹腔巨噬细胞的MAPK和AKT信号通路,并诱导IL-6、IL-12和TNF-α的分泌,为进一步揭示宿主抗新孢子虫感染免疫应答机制提供依据。

