长链非编码RNA PVT1及人类抗原R的异常表达对胃癌发生发展的影响
张 伟,刘新权,张 军,赵 磊,李冬妹,张 蕾
长链非编码RNA(long non-coding RNA,lncRNA)从多水平调控基因表达,作为肿瘤标志物被广泛关注。人浆细胞瘤转化迁移基因1( plasmacytoma variant translocation 1, PVT1 )是近年来新发现的lncRNA,定位于人类染色体8q24.21,被发现在肿瘤中表达或序列异常,可能成为肿瘤标志物,但其机制需要明确。通过全基因组关联分析(genome-wide association study,GWAS)、UCSC与GENCODE的注释信息分析发现PVT1与人类抗原R(human antigen R, HuR)存在相关性。为进一步研究PVT1和HuR基因在胃癌中的表达,课题组分析其与临床特征的相关性和对胃癌细胞的影响。
1 材料与方法
1.1 样本采集
采集石河子大学第一附属医院及新疆生产建设兵团第五师医院经手术切除的胃癌石蜡标本40例作为胃癌实验组,同时收集距离患者癌灶边缘3~5 cm的癌旁组织39例作为对照组。患者术前未进行放化疗,标本由2位病理专家诊断。所用标本经石河子大学第一附属医院伦理委员会批准,由患者及其家属签署知情同意书。1.2 试剂
PVT1探针购自天津赛尔生物公司,HuR抗体购自英国abcam公司,枸橼酸盐缓冲液购自北京中杉金桥生物公司,免疫组化所用试剂、DAB显色液等购自丹麦DAKO公司。引物及质粒于广州赛诚生物科技有限公司合成;Lip2000购自美国Invitrogen 公司;YBR Green PCR kit 购自德国QIAGEN 公司;β-actin抗体购自美国sigma公司;MTT购于美国Solarbio公司。1.3 组织芯片制作
根据HE切片镜下读片结果,标记相应蜡块位置。根据需要将组织芯片排版,记录在纸上。采用Minicore组织芯片仪确认孔针位置和蜡块边界,在空白蜡块上打孔,并在蜡块标记的位置取材,将组织样本蜡芯取出,注入空白蜡块的孔中,循环往复操作,最终组织芯片制作完成。每个样本3个复孔。1.4 原位杂交(in situ hybridization, ISH)检测lncRNA PVT1的表达水平
组织芯片切片后于80 ℃干烤2 h,随后用二甲苯脱蜡,分别浸于100%、85%、75%乙醇。3% HO37 ℃浸泡。滴加0.1 mol/L HCl,孵育;滴加0.5% TritonX-100,孵育30 min,滴加蛋白酶K溶液, 37 ℃孵育30 min,随后采用4%多聚甲醛固定。取100 μl RNA杂交液,均匀的滴在组织芯片上,预杂交1 h,温度为55 ℃。同时将探针变性,将PVT1探针与杂交液以1 ∶100的比例进行稀释,孵育85 ℃,5 min,随后孵育37 ℃,3 min。滴加100 μl探针,37 ℃杂交过夜。次日取片,1×PBS洗涤后,采用3%的BSA封闭,30 min。HRP标记的抗地高辛抗体以1% BSA稀释,滴加后37 ℃孵育2 h。滴加DAB孵育3 min,苏木精染色,梯度置于酒精、二甲苯中,封片观察。1.5 免疫组化(immunohistochemistry, IHC)检测HuR的表达情况
将组织切片于80 ℃干烤,2 h后用脱蜡并水化,采用枸橼酸缓冲液高压修复抗原8 min,置于3% HO溶液,以阻断内源性过氧化物酶,用牛奶封闭1 h,37 ℃,随后加HuR一抗(1 ∶200), 置于4 ℃冰箱 孵育过夜。次日,将片盒取出至室温2 h,加二抗孵育30 min,37 ℃,滴加DAB工作液显色,1.5 min,浸入水中以终止反应,随后采用自来水冲洗;苏木精染色,酒精脱水,放入二甲苯中,封片,自然晾干后,镜下观察结果。1.6 ISH与IHC判读标准
根据着色强度和面积判读结果。据强度计分:未染色计0;染色较弱计1+,染色适中计2+,染色强计3+。据着色面积占的比例计分:未着色计0;<20%计1+;20%~50%计2+;>50%计3+。将强度乘以面积比例,乘积<1的为阴性,2~4的为1+,5~7为2+,8~9的为3+。1.7 细胞培养
胃癌SGC7901细胞采用10% FBS和1%青链霉素的DMEM培养基于含5% CO的37 ℃恒温箱内培养。1.8 采用PVT1真核表达载体转染胃癌细胞SGC7901
根据NR_003367提供的序列,利用pcDNA3.1(+) 质粒,于广州赛诚生物科技有限公司构建PVT1真核表达载体。采用Lip2000将PVT1质粒转染胃癌细胞SGC7901,将过表达PVT1的细胞作为PVT1实验组,以空载体vector转染的细胞作为对照组。1.9 采用real time PCR检测PVT1的表达水平
转染48 h后,采用TRIzol提取细胞RNA,以SYBR Green PCR kit做real time PCR以检测PVT1过表达效率,PVT1引物序列为, F:5′-GGAAGGTGGAG CGTAAGGA-3′, R:5′- CAATGCCGCCAATCTTGTA -3′。扩增片段长度为92 bp。 以β-actin为内参,引物序列为F:5′-CCCAGCACAATGAAG ATCAAGATCAT-3′, R:5′-ATCTGCTGGAAGGTGGACAGCGA-3′。扩增长度为102 bp,条件为95 ℃、5 min, 95 ℃、30 s,55 ℃、30 s,72 ℃、1 min,40个循环。以2来计算确定扩增效率。1.10 Western blot检测HuR的表达
取细胞加入适量的RIPA裂解液,冰上孵育30 min, 4 ℃,12 000 r/min离心15 min,收集上清液,电泳转膜后,以5%脱脂奶粉的1×TBST封闭2 h,加入一抗(HuR 1 ∶100,β-actin 1 ∶1 000),4 ℃ 孵育过夜,二抗(1 ∶10 000)室温孵育2 h,用1×TBST洗膜3遍,5 min,发光试剂显色压片显影。1.11 MTT检测细胞增殖
收集状态良好的不同组的SGC7901细胞,采用96孔板,每孔接种2 000个细胞,每个样品4个复孔。MTT比色法检测转染后1~5 d细胞的增殖情况。每孔加入10 μl的MTT,浓度为 5 mg/ml,培养箱内孵育4 h。于490 nm测吸光度。1.12 统计学处理
采用 SPSS 19.0软件进行统计分析。计数资料采用χ检验分析,计量资料采用t
检验。其中MTT采用t
检验针对每一个时间点的PVT1过表达组和对照组进行两两比较,以P
<0.05为差异有统计学意义。2 结果
2.1 lncRNA PVT1在胃癌组织中的表达情况
将胃癌与癌旁组织进行ISH,显微镜下观察,可以看到胃癌组织中lncRNA PVT1表达增高,PVT1在胃癌中的表达阳性率为72.5%(29/40),高于对照组,38.46%(15/39),差异有统计学意义(P
=0.002),见表1,其中可以看到着色阳性的细胞胞核、胞质着色较深,呈棕褐色颗粒,见图1。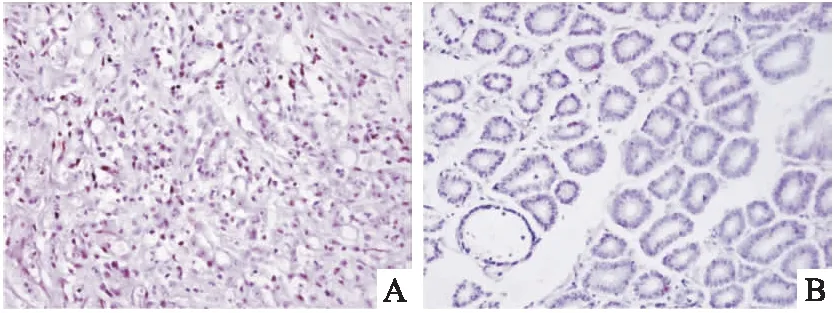
图1 lncRNA PVT1的ISH检测 DAB×200A:胃癌组织;B:癌旁对照组织
2.2 lncRNA PVT1的表达与胃癌患者临床病理因素的关系
lncRNAPVT1在组织中的表达水平与胃癌患者性别、年龄、肿瘤大小、淋巴转移、肿瘤分期等特点的相关性分析可知,lncRNA PVT1在胃癌肿瘤组织中的表达与淋巴结转移(P
=0.001)和肿瘤分期相关(P
=0.004)。见表2。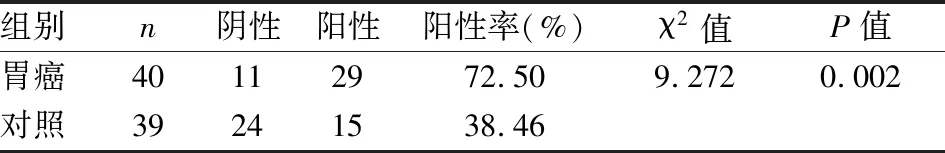
表1 lncRNA PVT1在胃癌组织与癌旁正常组织中ISH结果
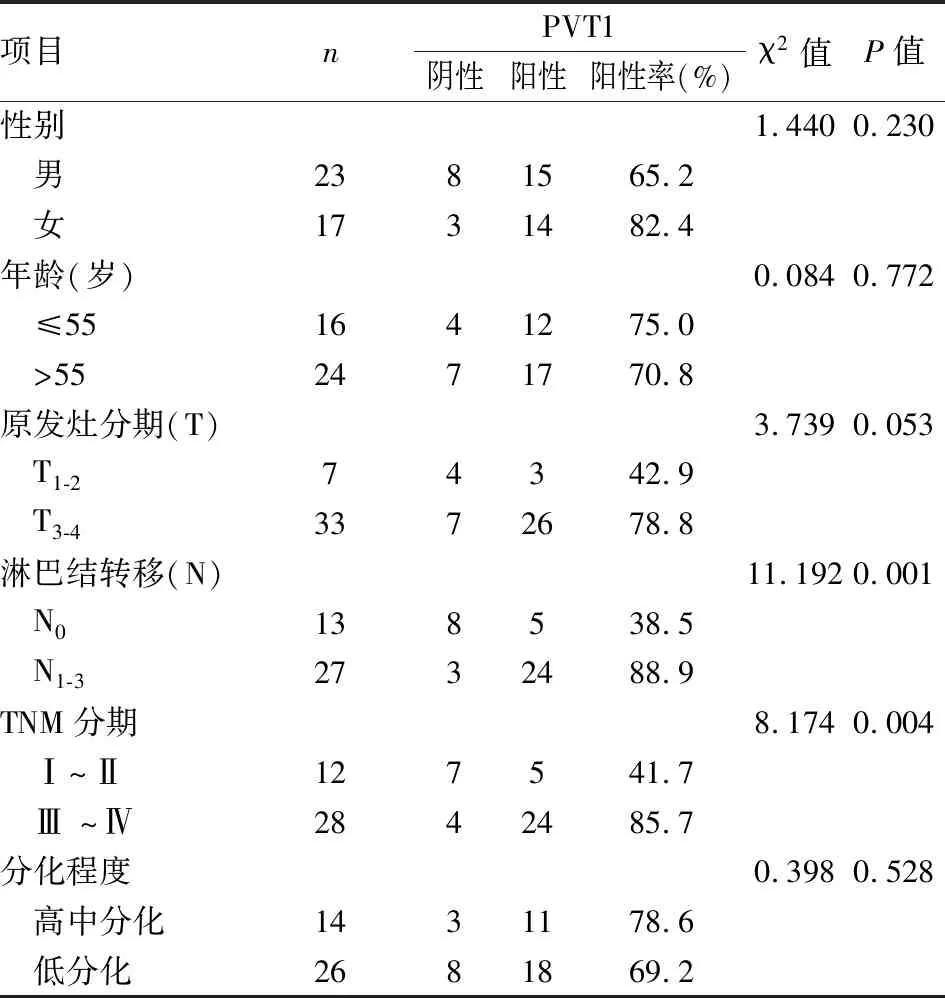
表2 lncRNAPVT1在胃癌组织中的表达与病理特点的相关性分析
2.3 HuR在胃癌组织中的表达情况检测
利用与ISH相同的组织芯片进行切片,采用免疫组织化学检测HuR蛋白的表达情况,结果提示HuR蛋白在胃癌组织中细胞核与细胞质均有着色,呈褐色颗粒状,见图2。HuR蛋白在胃癌中的表达阳性率为67.5%(27/40)高于正常胃黏膜组织中的表达28.2%(11/39),差异有统计学意义(P
<0.001),见表3。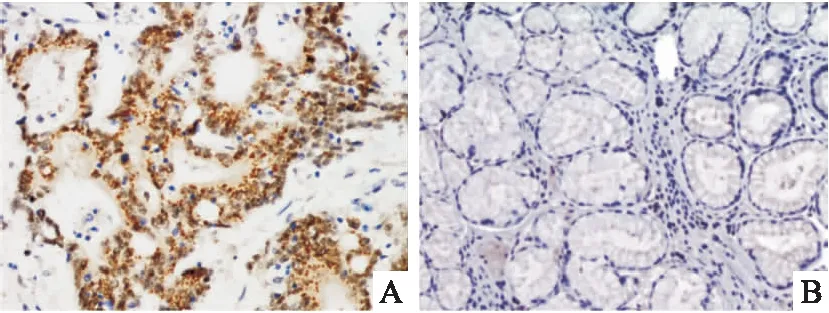
图2 IHC)检测HuR在胃癌和癌旁对照组织中的表达 HE×200
2.4 HuR的表达水平与胃癌患者临床病理因素的关系
HuR的表达与胃癌临床病理特点的分析结果提示,HuR在胃癌中的表达与淋巴结转移(P
=0.007)、分期(P
=0.022)和分化(P
=0.015)密切相关,但是与患者年龄、性别、淋巴结转移等因素无关。见表4。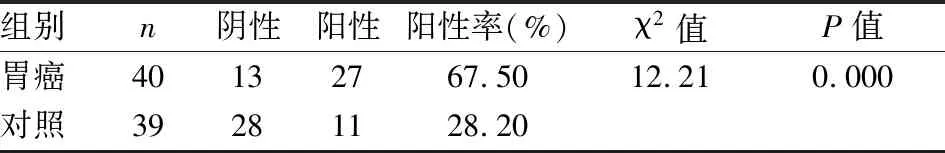
表3 HuR基因在胃癌组织和癌旁对照组织中的表达分析
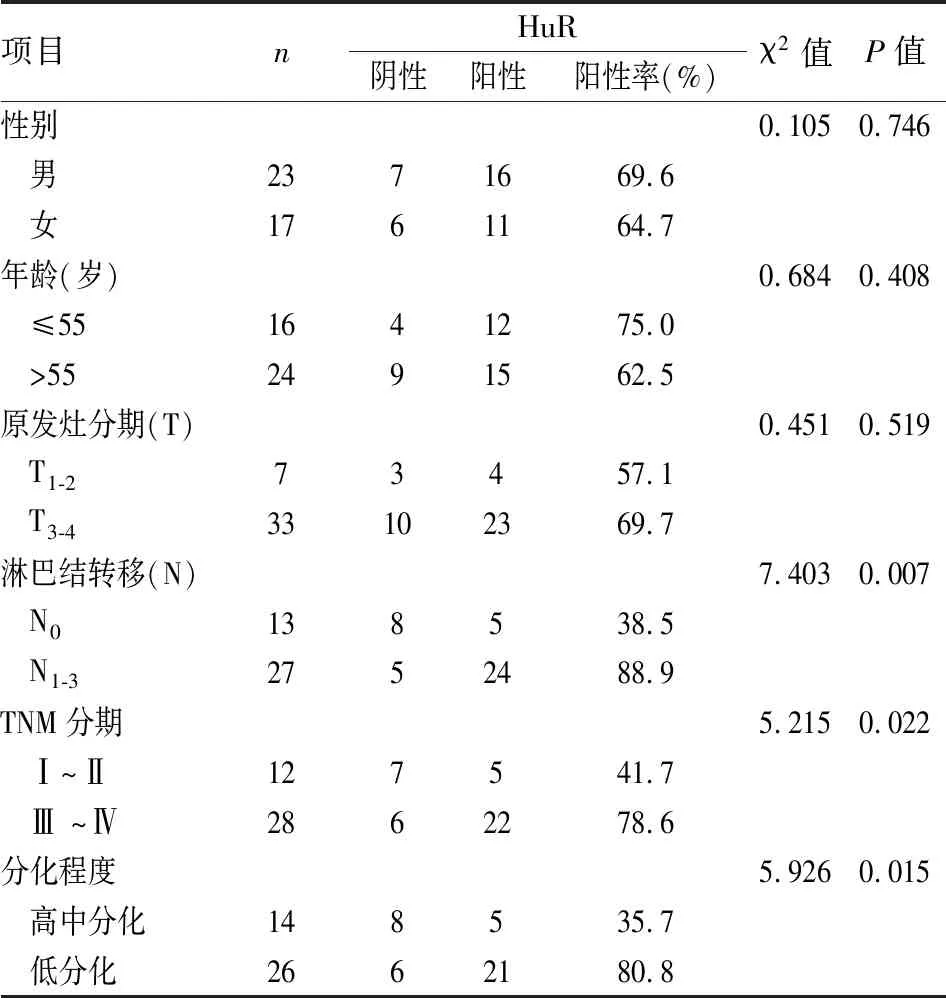
表4 胃癌组织中HuR的表达水平与病理特点的分析
2.5 lncRNA PVT1与HuR的表达相关性分析
进一步分析PVT1与HuR表达的相关性,将同一蜡块组织中,既检测到lncRNA PVT1又检测到原癌基因HuR的表达情况进行统计,联合分析,结果显示PVT1与HuR的表达具有相似的趋势,在24例胃癌组织PVT1表达增高的组织中,HuR的表达也增高了,其相关性具有统计学意义(P
<0.01)。见表5。
表5 lncRNA PVT1与HuR的表达分析
2.6 在胃癌细胞中过表达lncRNA PVT1并检测HuR的表达水平
将PVT1过表达质粒和空载体分别转染到SGC7901胃癌细胞中,转染48 h后,提取细胞RNA,real time PCR检测PVT1的表达情况,确认PVT1表达上调后(P
=0.004,t
=8.573), 采用Western blot技术检测过表达PVT1和空载体转染组中HuR蛋白的表达情况,结果发现过表达PVT1后,胃癌细胞SGC7901中HuR蛋白的表达水平也有所增加。见图3。
图3 Western blot检测过表达PVT1和空载体组 HuR蛋白表达水平a:对照组;b:PVT1过表达组
2.7 MTT实验检测PVT1过表达胃癌细胞的增殖情况
采用MTT法比较PVT1过表达与空载体转染组细胞的增殖能力,由增殖曲线可见过表达PVT1后,胃癌细胞SGC7901的增殖水平增加(P
<0.05),表明过表达PVT1表达可促进胃癌细胞的增殖。见图4。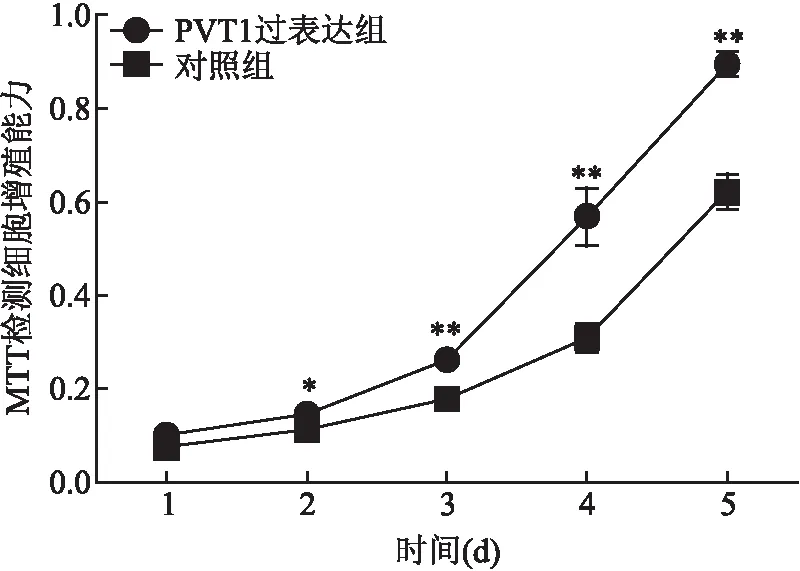
图4 MTT检测PVT1过表达胃癌细胞增殖情况 与对照组比较:*P<0.05,**P<0.01
3 讨论
lncRNA是长度大于200个核苷酸的非编码RNA分子,有证据表明,他们是一类功能特殊的有调节性的生物分子。lncRNA的表达具有组织特异性及发育阶段特异性,可从多个角度调节基因的表达,其功能已涉及到转录调控、翻译调控、表观遗传调控以及基因印迹等,其异常表达能够影响细胞的增殖、迁移侵袭等过程。lncRNA结合转录因子或聚合酶调节临近基因的表达是其重要作用机制之一。
lncRNA的异常变化发生在肿瘤器质性病变之前。因此监测此类有特异性的lncRNA对于肿瘤的早期诊断意义重大。例如在乳腺癌的早期诊断中,lncRNA H19被发现在早期的癌组织中表达增高,并在循环系统中,血清水平也异常增高,因此被认为是此类癌症早期诊段的分子标志物。lncRNA NKILA的低表达能够加速结肠癌的进程,已经被认为是结肠癌早诊的潜在分子标志物。Lnc RNA HOTAIR在食管鳞状细胞癌中表达异常增高,可能作为诊疗的分子标志物。但目前胃癌相关的lncRNA分子标志物还尚未确定。
LncRNA PVT1基因所在的区域是染色体8q24.21,该区域的变异和异常表达被认为与肿瘤相关,在结肠癌、肺癌、卵巢癌等患者中均发现表达增高级拷贝数增加。在胃癌相关lncRNA的研究中,Cao et al采用了lncRNA芯片比较了胃癌与癌旁组织的lncRNA,发现 PVT1 在胃癌组织中表达增加。Li et al通过生物信息学方法,分析了PVT1相关的蛋白,发现HuR是与PVT1非常相关的蛋白质。HuR属于胚胎致死性异常视觉蛋白ELAV家族,可以通过与RNA 3′-非翻译区中富含-U或者-AU的腺苷酸和尿苷酸富集元件结合而增加RNA的稳定性,已被证明与多种肿瘤的发生发展相关 。Zhang et al发现在肺癌中HuR可以通过影响CDK3的表达的方式影响肿瘤的演进。在结肠癌中,Jun/miR-22/HuR轴也被发现是潜在的治疗靶点。
在本研究结果中,本课题组发现在胃癌组织中,PVT1表达上调,且与胃癌患者的淋巴结转移和肿瘤分期密切相关。在同一组织检测的HuR表达与PVT1呈现了共同的趋势,经过统计分析,发现二者表达具有相关性,这证明了在胃癌的发生发展中,PVT1和HuR的异常表达发挥了一定的作用。在进一步的胃癌细胞的研究中,当上调PVT1时,HuR蛋白被检测到表达增加,且细胞的增殖能力增强了,说明PVT1在胃癌细胞中发挥作用的机制有可能涉及HuR的异常表达,其可能是通过HuR稳定一些癌基因的表达水平,从而达到促进肿瘤进展的目的。
LncRNA也是一种分子海绵,可通过吸附miRNA的方式,降低miRNA的水平,从而促进了一些基因的表达,PVT1是否是通过PVT1/miRNA/HuR轴的方式来调控影响胃癌细胞的恶性进展,有待于进一步验证,其中的miRNA究竟是什么,也需要进一步探究。本研究证实了PVT1和HuR的异常表达在胃癌的发生发展中起到了作用,是胃癌治疗的候选靶点。

