足细胞损伤中JAK2/STAT3通路与TRPC6相互作用的机制探讨
吴 慢,王先鹤,高 慧,邓 芳
过敏性紫癜性肾炎(henoch-schnlein purpura nephritis,HSPN)是儿童常见的继发性肾小球疾病,可进展至终末期肾脏病,其确切的发病机制尚不明确。足细胞被覆于肾小球基底膜外侧,是肾小球滤过膜,最终也是肾小球最重要的屏障,HSPN的发生与足细胞的损伤有着密切的关系。瞬时受体电位非选择性阳离子通道蛋白(transient receptor potential canonical,TRPC)6位于肾小球足细胞,是裂隙膜的重要组成部分,TRPC6主要介导Ca内流发挥作用。有研究发现,HSPN患儿肾内存在肾素-血管紧张素系统(renin-angiotensin system,RAS)的异常活化,血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)作为RAS中主要效应分子,可诱导肾小球细胞损伤,刺激JAK2/STAT3信号通路的过表达引起肾脏炎性。在此过程中,TRPC6也会过度表达。另外有研究表明,Ca能够参与调节JAK2/STAT3信号通路。因此,猜测在Ang Ⅱ损伤足细胞过程中,TRPC6与JAK2/STAT3信号通路存在一定的相互作用关系。该研究以此为出发点来探讨在足细胞中TRPC6通道蛋白与JAK2/STAT3信号通路的相互作用及其机制,为肾脏炎症性疾病防治提供新的药物靶点。
1 材料与方法
1.1 主要试剂
Ⅳ型胶原酶、胰蛋白酶及转铁蛋白、Ang Ⅱ(美国Sigma公司);DMEM低糖培养基(美国HyClone公司);胎牛血清(fetal bovine serum,FBS)(以色列BI公司); TRPC6受体抑制剂 (SKF96365)、Ang Ⅱ受体抑制剂氯沙坦(ab120997)、JAK2/STAT3通路抑制剂(AG490)(上海abcam公司);反转录试剂盒、实时荧光定量PCR 试剂盒(日本 Takara公司);实时荧光PCR引物[生工生物工程(上海)股份有限公司];兔抗TRPC6、p-JAK2、JAK2、p-STAT3、STAT3抗体(美国CST公司);兔抗β-actin单克隆抗体、辣根过氧化物酶标记的羊抗兔IgG(武汉三鹰公司);增强化学发光(enhanced chemiluminescent, ECL)试剂盒(上海Tanon公司);小鼠肿瘤坏死因子(tumor necrosis factor, TNF)-α、小鼠白细胞介素(interleukin,IL)-6、ELISA (enzyme-linked immuno sorbent assay, ELISA)试剂盒(美国R&D公司)。1.2 方法
1.2.1
小鼠足细胞(mousepodocyte clone,MPC)的分离和培养 MPC细胞株(购自北京北纳创联生物技术研究院,中国医学科学院基础医学研究所系用于全部实)将复苏的足细胞放入 33 ℃、5% CO孵箱中进行传代培养,培养液成分为DMEM低糖培养基、10%胎牛血清以及补充剂(胰岛素、转铁蛋白和亚硒酸钠)。当细胞生长至70%~80%融合时,转至37 ℃、5% CO孵箱中使用相同的培养液继续培养10~14 d,至细胞分化完全,选择第5~15代分化完全的足细胞用于实验研究。1.2.2
实验分组 待足细胞长到70%~80% 融合时,接种到6孔板中,使每孔细胞浓度达到80%后用于实验。将实验进行分组:① 对照组(NC组);② Ang Ⅱ损伤组:加入Ang Ⅱ,使其浓度保持在1 μmol/L;③ Ang Ⅱ+氯沙坦组:加入Ang Ⅱ和氯沙坦,使其浓度分别保持在1 μmol/L和20 μmol/L;④ Ang Ⅱ+AG490组:加入Ang Ⅱ和AG490,使其浓度分别保持在1 μmol/L和40 μmol/L;⑤ Ang Ⅱ+SKF96365组:加入Ang Ⅱ和SKF96365,使其浓度分别保持在1 μmol/L和40 μmol/L。将上述分组在培养箱中继续培养24 h后进行实验。1.2.3
Western blot检测 取足细胞置于冰上,PBS清洗3遍后,用干净的细胞刷将细胞刮下并搜集,分别提取各组细胞的总蛋白,低温离心后取上清液,用BCA试剂盒测定各组蛋白浓度,加入上样缓冲液煮沸10 min后,每组蛋白取20 μg上样,用10% SDS-PAGE凝胶进行电泳,湿电转至NC膜上,5%脱脂牛奶-PBST溶液室温封闭2 h,再用PBS清洗3遍,分别加入一抗JAK2(1 ∶2 000);P-JAK2(1 ∶2 000);STAT3(1 ∶2 000);P-STAT3(1 ∶2 000);TRPC6(1 ∶5 000);β-actin(1 ∶35 000),于4 ℃孵育过夜后,洗膜,显影,采用β-actin 作为内参,系统软件 Image-J 进行灰度分析。1.2.4
qRT-PCR检测细胞因子mRNA表达水平 收集各组细胞,采用TRIzol法提取各组细胞 mRNA,并以提取的RNA样品为模板反转录为cDNA。根据SYBR Green试剂盒说明书对cDNA样品进行实时荧光定量PCR。引物序列见表1。反应条件为:95 ℃预变性10 min后进入循环;95 ℃、10 s,60 ℃、30 s,扩增40个循环;每组设3个复孔,采用2法分析相对表达量。1.2.5
ELISA法检测各组培养上清液细胞因子含量 收取各组细胞上清液,按照ELISA试剂盒说明书用ELISA 方法检测各组细胞TNF-α和IL-6表达水平。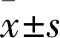

表1 PCR引物列表
2 结果
2.1 Ang Ⅱ对足细胞JAK2/STAT3通路蛋白与TRPC6蛋白表达的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+氯沙坦组的p-JAK2表达相对量差异有统计学意义(F
=23.55、P
=0.001 4);3组间的p-STAT3表达相对量差异有统计学意义(F
=23.40、P
=0.001 5);3组间的TRPC6表达相对量差异有统计学意义(F
=9.73、P
=0.013 1)。两两比较结果提示,与对照组相比,Ang Ⅱ损伤组的p-JAK2、p-STAT3与TRPC6蛋白表达水平较高(P
均<0.05);与Ang Ⅱ损伤组相比,Ang Ⅱ+氯沙坦组p-JAK2、p-STAT3与TRPC6蛋白表达水平较低(P
均<0.05)。见图1。因此,在足细胞受到Ang Ⅱ刺激时,JAK2/STAT3通路蛋白磷酸化水平与TRPC6蛋白表达量升高。2.2 AG490对足细胞JAK2/STAT3通路蛋白与TRPC6蛋白表达的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+AG490组的p-JAK2表达相对量差异有统计学意义(F
=20.83、P
=0.002);3组间的p-STAT3表达相对量差异有统计学意义(F
=12.35、P
=0.008);3组间的TRPC6表达相对量差异有统计学意义(F
=6.546、P
=0.031)。两两比较结果提示,与Ang Ⅱ损伤组相比,Ang Ⅱ+AG490组的p-JAK2、p-STAT3与TRPC6蛋白表达水平较低(P
均<0.05)。见图2。因此,在AG490对JAK2/STAT3通路的阻断下,不仅JAK2/STAT3通路蛋白磷酸化水平降低,TRPC6蛋白表达量也随着降低。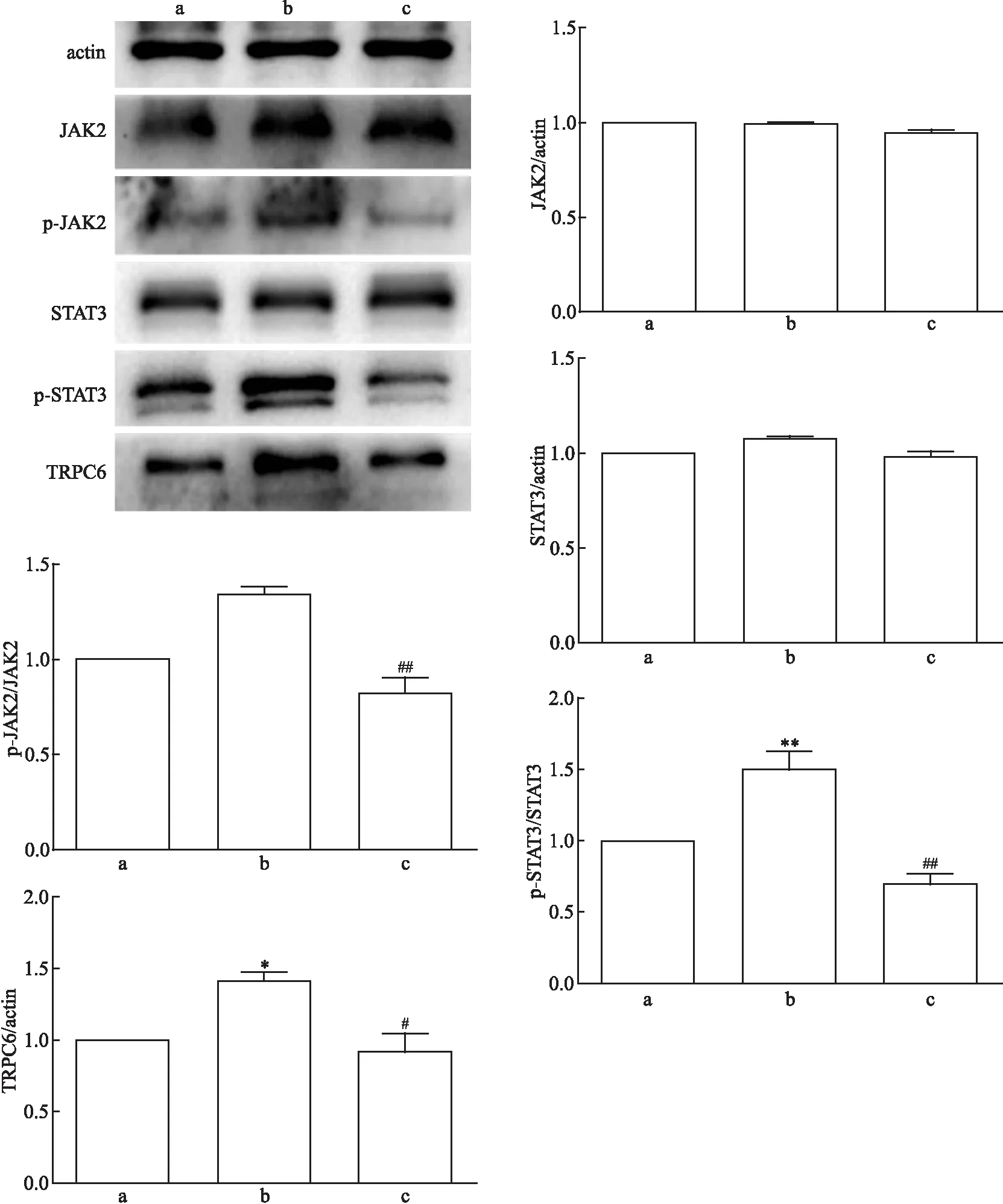
图1 Ang Ⅱ作用下JAK2/STAT3通路蛋白
2.3 SKF96365对足细胞JAK2/STAT3通路蛋白与TRPC6蛋白的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+SKF96365组的p-JAK2表达相对量差异有统计学意义(F
=13.03、P
=0.007);3组间的p-STAT3表达相对量差异有统计学意义(F
=9.351、P
=0.014);3组间的TRPC6表达相对量差异有统计学意义(F
=26.47、P
=0.001)。两两比较结果提示,与Ang Ⅱ损伤组相比,Ang Ⅱ+SKF96365组的p-JAK2、p-STAT3与TRPC6蛋白表达水平较低(P
均<0.05)。详见图3。因此,在SKF96365对TRPC6的阻断下,不仅TRPC6蛋白表达量降低,JAK2/STAT3通路蛋白磷酸化水平也随着降低。2.4 Ang Ⅱ及各蛋白阻滞剂对足细胞TRPC6 mRNA表达的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+氯沙坦组的TRPC6 mRNA表达相对量差异有统计学意义(F
=39.18、P
<0.001);对照组、Ang Ⅱ损伤组、Ang Ⅱ+AG490组的TRPC6 mRNA表达相对量差异有统计学意义(F
=39.61、P
<0.001);对照组、Ang Ⅱ损伤组、Ang Ⅱ+SKF96365组的TRPC6 mRNA表达相对量差异有统计学意义(F
=37.15、P
<0.001)。两两比较结果提示,与对照组相比,Ang Ⅱ损伤组的TRPC6 mRNA表达水平较高(P
<0.05)。与Ang Ⅱ损伤组相比,Ang Ⅱ+氯沙坦组、Ang Ⅱ+AG490组和Ang Ⅱ+SKF96365组的 TRPC6 mRNA表达水平较低(P
均<0.05)。详见图4。因此,对Ang Ⅱ、JAK2/STAT3和TRPC6的抑制均能降低TRPC6 mRNA的表达。
图2 AG490作用下JAK2/STAT3通路蛋白与TRPC6蛋白表达量 a:对照组;b:Ang Ⅱ损伤组;d: Ang Ⅱ+AG490组;与对照组比较:*P<0.05,***P<0.001;与Ang Ⅱ损伤组比较:#P<0.05,##P<0.01,###P<0.001
2.5
Ang
Ⅱ及各蛋白阻滞剂对足细胞TNF
-α、IL
-6mRNA表达的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+氯沙坦组的TNF-α mRNA表达相对量差异有统计学意义(F
=21.27、P
=0.002);对照组、Ang Ⅱ损伤组、Ang Ⅱ+AG490组的TNF-α mRNA表达相对量差异有统计学意义(F
=23.62、P
=0.001);对照组、Ang Ⅱ损伤组、Ang Ⅱ+SKF96365组的TNF-α mRNA表达相对量差异有统计学意义(F
=32.21、P
<0.001)。两两比较结果提示,与对照组相比,Ang Ⅱ损伤组的TNF-α表达水平较高(P
<0.05);与Ang Ⅱ损伤组相比,Ang Ⅱ+氯沙坦组、Ang Ⅱ+AG490组和Ang Ⅱ+SKF96365组的TNF-α mRNA表达水平较低(P
均<0.05)。对照组、Ang Ⅱ损伤组、Ang Ⅱ+氯沙坦组的IL-6 mRNA表达相对量差异有统计学意义(F
=29.30、P
<0.001);对照组、Ang Ⅱ损伤组、Ang Ⅱ+AG490组的IL-6 mRNA表达相对量差异有统计学意义(F
=23.17、P
=0.002);对照组、Ang Ⅱ损伤组、Ang Ⅱ+SKF96365组的IL-6 mRNA表达相对量差异有统计学意义(F
=23.91、P
=0.001)。两两比较结果提示,与对照组相比,Ang Ⅱ损伤组的IL-6 mRNA表达水平较高(P
<0.05);与Ang Ⅱ损伤组相比,Ang Ⅱ+氯沙坦组、Ang Ⅱ+AG490组和Ang Ⅱ+SKF96365组的IL-6 mRNA表达水平较低(P
均<0.05)。详见图5。
图3 SKF96365作用下JAK2/STAT3通路蛋白与TRPC6蛋白表达量
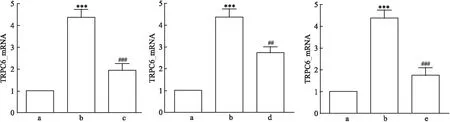
图4 Ang Ⅱ刺激及各蛋白阻滞剂处理mpc后TRPC6 mRNA表达量
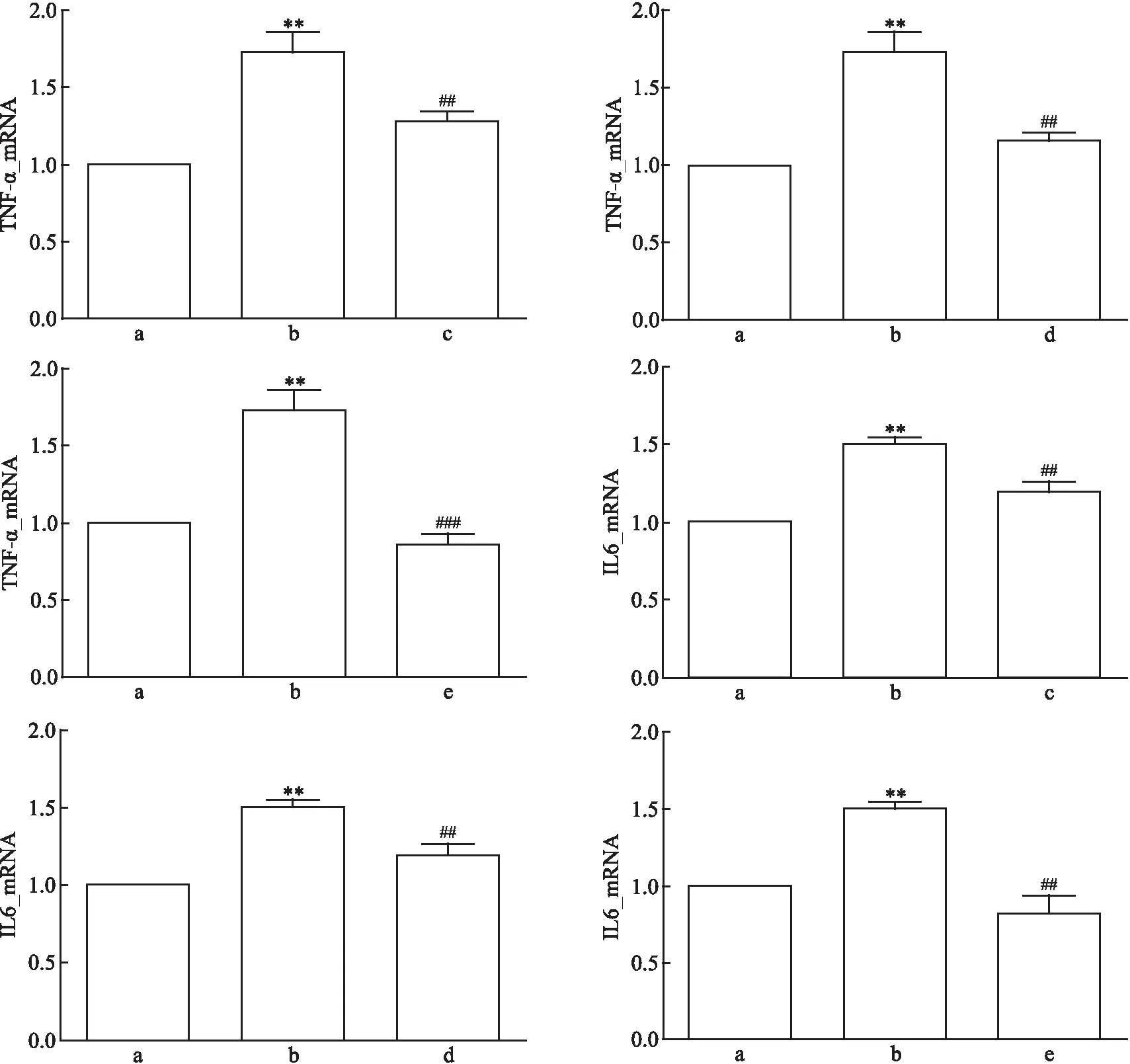
图5 Ang Ⅱ刺激及各蛋白阻滞剂处理mpc后TNF-α、IL-6 mRNA表达量
因此,对Ang Ⅱ、JAK2/STAT3和TRPC6的阻断均能降低炎症因子TNF-α、IL-6mRNA的表达。
2.6 Ang Ⅱ及各蛋白阻滞剂对足细胞TNF-α、IL-6表达的影响
对照组、Ang Ⅱ损伤组、Ang Ⅱ+氯沙坦组、Ang Ⅱ+AG490组、Ang Ⅱ+SKF96365组的TNF-α的表达量差异有统计学意义(F
=78.35、P
<0.001);各组间IL-6的表达量差异有统计学意义(F
=46.30、P
<0.001)。两两比较结果提示,与对照组相比,Ang Ⅱ损伤组的TNF-α、IL-6表达量较高(P
均<0.05);与Ang Ⅱ损伤组相比,Ang Ⅱ+氯沙坦组、Ang Ⅱ+AG490组和Ang Ⅱ+SKF96365组的TNF-α、IL-6表达量较低(P
均<0.05)。详见图6。因此,对Ang Ⅱ、JAK2/STAT3和TRPC6的阻断均能降低炎症因子TNF-α、IL-6的表达,与mRNA水平变化趋势与之一致。3 讨论
HSPN患儿的肾脏损害是影响其预后的重要因素,其发病机制尚未明确。近年来研究发现肾内 RAS 在肾小球滤过率的调节中发挥着重要作用,HSPN患儿肾内存在RAS的异常活化,而Ang Ⅱ作为该系统中主要效应分子参与了肾脏病理炎症改变。本研究通过Ang Ⅱ刺激足细胞,模拟足细胞在炎症中受到的刺激,并通过TRPC6和JAK2/STAT3阻断剂分别抑制TRPC6和JAK2/STAT3的表达,来研究TRPC6离子通道蛋白与JAK2/STAT3信号通路的相互作用与机制。本研究实验结果:① Ang Ⅱ通过上调TRPC6通道蛋白以及JAK2/ATAT3信号通路产生炎症因子,使足细胞损伤:② 通过抑制剂抑制TRPC6通道蛋白能够下调JAK2/STAT3信号通路的表达;③ 通过抑制剂抑制JAK2/STAT3信号通路能够下调TRPC6通道蛋白的表达;④ 分别使用抑制剂抑制JAK2/STAT3信号通路以及TRPC6通道蛋白的同时,炎症因子也在减少,足细胞损伤得到控制。
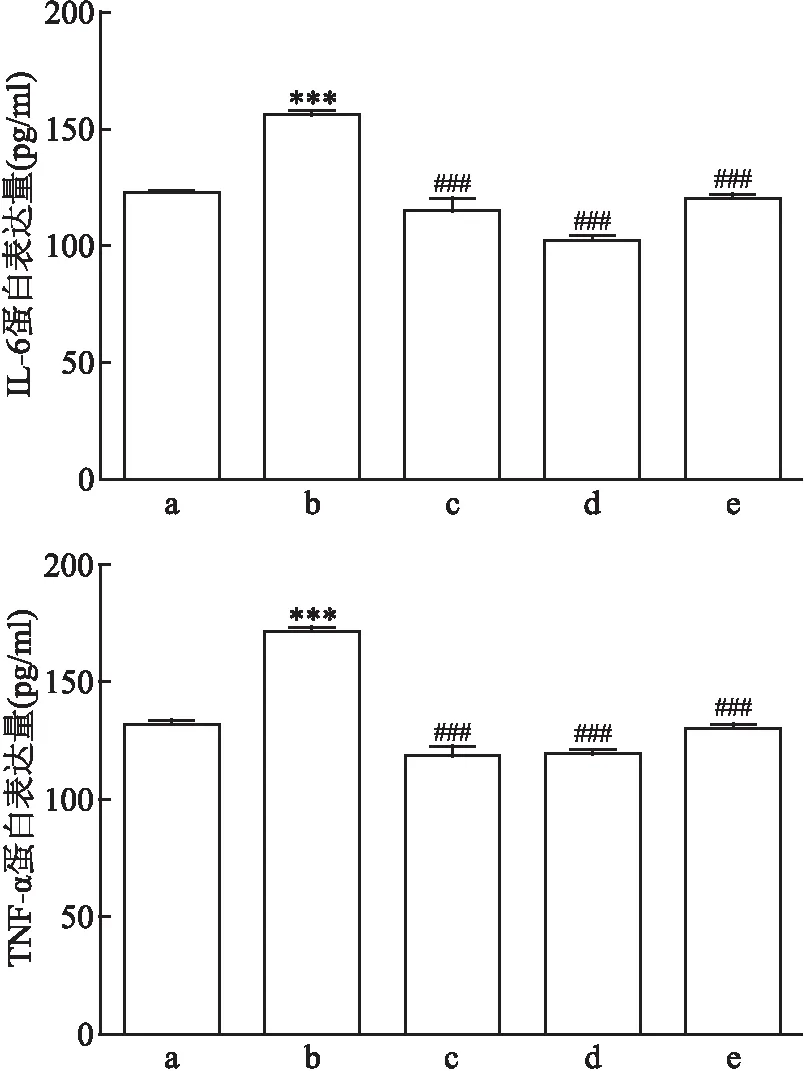
图6 不同刺激条件下的TNF-α和IL6蛋白表达量
小儿HSPN常常伴有大量蛋白尿,具体机制尚不明确,足细胞作为肾小球滤过膜的重要结构,在蛋白尿中发挥着重要作用。Ang Ⅱ作为炎症递质能够作用于足细胞上足突AT1受体损伤足细胞产生炎症因子,破坏肾小球滤过屏障从而产生大量蛋白尿。TRPC6通道是足突细胞钙转运的重要递质,并参与调节肾小球滤过,其过表达或功能增强可导致足细胞足突消失,使小鼠肾脏受到损伤而诱发蛋白尿。TRPC6的表达与多种细胞因子有关,包括nephrin、 podocin、CD 2AP等这些足细胞骨架蛋白,并且TRPC6能够结合并激活Calpain调节足突细胞骨架、参与细胞黏附和运动。有研究已经发现,Ang Ⅱ能够导致TRPC6启动子活性增加,TRPC6通道过度表达,从而诱导足细胞损伤,本实验一通过Ang Ⅱ刺激足细胞, TRPC6蛋白及mRNA表达量升高,炎症因子TNF-α和IL-6随之增加,从而使足细胞损伤加重;当给予氯沙坦时,TRPC6及TNF-α和IL-6表达量下降,足细胞损伤减轻,从而证实Ang II能够介导足细胞损伤影响TRPC6的表达。
JAK2/STAT3信号通路在炎症中起着重要的作用,能够参与细胞增殖、分化、生长和凋亡。JAK2/STAT3通路对心血管系统的影响也很重要,越来越多的证据表明,JAK2/STAT3通路参与刺激诱导各种心血管并发症,包括凋亡、网状应激、ROS、收缩功能障碍和炎症。有研究表明,Ang Ⅱ能够在多种疾病中激活JAK2/STAT3通路,损伤靶细胞,产生炎症因子,本实验通过Ang Ⅱ刺激足细胞,p-JAK2、p-STAT3蛋白表达增高,炎症因子TNF-α和IL-6也随之增加,足细胞受到损伤;当给予氯沙坦时,p-JAK2、p-STAT3及TNF-α和IL-6表达量下降,足细胞损伤减少,从而证实Ang II能够介导足细胞损伤影响JAK2/STAT3通路的表达同时,TRPC6也能够与多种信号通路发生作用。TRPC6作为一种非选择性的阳离子通道蛋白,主要介导Ca内流发挥作用,并且Ca能够参与调节JAK2/STAT3信号通路。因此,猜测在Ang Ⅱ损伤足细胞过程中,TRPC6与JAK2/STAT3信号通路存在一定的相互作用关系。本研究以此为出发点来探讨在足细胞中TRPC6通道蛋白与JAK2/STAT3信号通路的相互作用及其机制。通过分别加入TRPC6通道蛋白与JAK2/STAT3通路蛋白抑制剂,用Western blot、q-PCR、ELISA等实验方法检测两者蛋白、mRNA、及细胞炎症因子的表达量来验证两者的关系。结果显示,当加入SKF96365时能够下调JAK2/STAT3信号通路蛋白磷酸化的表达,肾脏炎症因子随之减少,足细胞损伤得以减轻;当加入AG490时,TRPC6通道蛋白以及mRNA的表达也在减少,其肾脏炎症因子TNF-α和IL-6也随之减少,足细胞损伤得到改善。但两者的具体联系是否通过Ca介导有待进一步实验验证。
综上所述, Ang Ⅱ能够介导TRPC6通道蛋白激活JAK2/STAT3信号通路,抑制JAK2/STAT3信号通路也能下调TRPC6通道蛋白的表达,为肾脏疾病的研究提供了一个新的方向。

