不同浓度七氟烷对人胚胎干细胞自我更新和分化为神经细胞的影响
王肖肖,王 胜
七氟烷是临床上广泛使用的一种麻醉药物,常被用于孕妇和婴幼儿的全身麻醉。七氟烷发挥功能时对机体的神经发育有何影响,现已成为临床上研究的热点和难点之一。小鼠和大鼠的体内研究表明,七氟烷的长时间处理会导致脑内神经干/前体细胞凋亡,同时损害神经再生的能力,从而对小鼠的认知产生消极影响。但是在动物体内进行研究难以实时观察实验结果,而且啮齿类动物的生理特征与人差异较大。人胚胎干细胞(human embryonic stem cells, hESCs)在体外不仅可以自我更新,还能够分化成不同类型的细胞。相较于人神经干/前体细胞,hESCs是研究神经系统发育完整周期的绝佳体外模型之一。但是hESCs的体外培养条件较为苛刻,导致以hESCs作为体外模型的相关研究进展较慢。该研究检测了不同剂量七氟烷对hESCs的干性维持和神经定向分化的影响,并初步探讨了下游的分子机制,为未来在临床上安全使用麻醉药物提供了理论依据。
1 材料与方法
1.1 试剂与仪器
HES2hESCs由安徽大学干细胞及转化医学研究中心友情提供;细胞培养基DMEM/F12、Neurobasal Medium、N2、B27、L-谷氨酰胺、非必需氨基酸、血清替代物购自美国Invitrogen公司;逆转录试剂和荧光实时定量PCR试剂盒购自上海翊圣生物科技有限公司;GAPDH、OCT4、GATA4、TUJ1、SMAD、ERK、CASPASE 3 (CASP3) 和PAX6 等抗体购自美国ProteinTech、Cell Signaling Technology和Santa Cruz等公司;Activin A和bFGF等细胞因子购自美国Peprotech公司;荧光实时定量PCR仪、生物安全柜和细胞培养箱等购自美国Thermo Scientific公司;普通倒置显微镜和荧光倒置显微镜购买自德国莱卡公司;蛋白分析设备购自北京六一生物科技有限公司。1.2 方法
1.2.1
hESCs的培养与传代培养皿用Matrigel稀释液过夜包被,PBS洗1遍,加入hESCs完全培养基。培养基的组成为:24 ml DMEM/F12、24 ml Neurobasal Medium、0.25 ml N2、0.5 ml B27、10% 血清替代物、1×非必需氨基酸、1×丙酮酸钠、2 mmol/L L-谷氨酰胺、0.1 mmol/L β-巯基乙醇。同时添加终浓度为10 ng/ml Activin A、10 ng/ml bFGF以及2 μmol/L IWR1。当细胞生长密度达80%~90%时,用胶原酶Ⅳ消化,按照1 ∶3或1 ∶5比例进行传代培养。
1.2.2
七氟烷处理细胞 将hESCs分成分为3组,在37 ℃条件下,其中2组细胞置于含2.1%或4.1%七氟烷、5% CO和21% O混合气体的密封盒中,处理6 h。即低剂量组和高剂量组,而未经七氟烷处理的细胞(即对照组)则仅暴露于5% CO和 21% O的环境中。实验期间,用Drager Vamos监测气体浓度。处理结束,取出细胞放入37 ℃,含5% CO的细胞培养箱中继续培养,进行后续观察分析。1.2.3
hESCs神经分化 hESCs向神经细胞定向分化主要参照James A Thomson研究团队的方法。步骤稍作改进:hESCs在不含自我更新因子的培养基中进行悬浮培养,形成拟胚体(embryoid bodies, EBs),4 d后将悬浮的EBs进行贴壁培养,10 d后会形成类似神经球结构,将此神经球用Accutase进行消化,贴壁培养,不久会长出神经元细胞。1.2.4
荧光实时定量PCR(quantitative real-time PCR,qRT-PCR) 用杭州倍沃医学科技有限公司的RNA提取试剂盒抽提细胞总RNA,利用上海翊圣生物科技有限公司的cDNA Synthesis SuperMix预混试剂合成第一链cDNA,接着按照该公司的SYBR Green Mix荧光定量检测试剂盒的说明书进行qRT-PCR操作。基因引物序列见表1。
表1 引物序列
1.2.5
Western blot检测 待细胞生长密度达到70%以上,弃培养基,预冷PBS洗1遍,加入200 μl已添加了蛋白酶抑制剂的RIPA裂解液,裂解细胞,BCA法测定总蛋白浓度。经10%的SDS-PAGE胶分离各蛋白组分、湿转系统转移蛋白至0.45 μm PVDF膜上、5%脱脂牛奶室温封闭2 h、一抗稀释液(1 ∶1 000)4 ℃孵育过夜、TBST洗涤3遍、HRP标记的二抗室温孵育1 h、TBST再次洗涤膜等步骤后,使用上海天能科技有限公司的ECL发光液进行发光。最后,使用Image J软件统计各条带灰度值,并与内参比较分析。1.2.6
免疫荧光 弃去培养液,加入4%多聚甲醛室温固定20 min,PBS洗2遍,加入含有5% BSA和0.2% Triton X-100的PBS溶液在37 ℃孵育2 h,进行封闭和细胞膜穿孔。弃封闭液,加入含有一抗的稀释液(1 ∶100)4 ℃过夜,次日用PBS洗3遍,每次5 min。最后加入含有绿色荧光基团488的二抗(稀释比例均为1 ∶1 000)以及Hoechst染料(稀释比例均为1 ∶5 000),37 ℃避光孵育1 h,用PBS漂洗3遍后在荧光显微镜下观察拍照。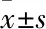
2 结果
2.1 不同浓度七氟烷处理对hESCs凋亡的影响
3组hESCs生长于正常的干细胞培养基中,待细胞的生长密度达到50%~60%时,给予七氟烷气体处理6 h。2 d后,对照组和低剂量组中的hESCs克隆表面亮泽,形态正常,而高剂量组内的hESCs表面粗糙、出现较多的空泡结构(图1A),表明细胞可能发生了凋亡。接下来检测了细胞凋亡的标志物CASP3的表达情况。相比于对照组和低剂量组细胞,高剂量组细胞含有较高的CASP3蛋白(0.827±0.051,F
=23.87,P
<0.05),差异有统计学意义(图1B、C)。说明高剂量七氟烷处理会诱导hESCs发生凋亡。2.2 不同浓度七氟烷处理对hESCs未分化状态的影响
hESCs在体外能够以自我复制的方式进行无限增殖,满足了基础研究和临床应用对细胞数量的要求。本课题组接下来延长观察时间,以明确七氟烷对hESCs自我更新的影响。细胞传了2代之后,部分高剂量组内的hESCs的克隆边缘出现了分化表型(图2A)。未分化的hESCs具有很高的碱性磷酸酶活性,且高表达OCT
4、SOX
2和NANOG
等标志基因,而低表达分化基因。检测结果显示:与对照组和低剂量组细胞相比,高剂量组中的hESCs具有较低的碱性磷酸酶活性(图2B),自我更新的标志基因OCT
4、SOX
2、NANOG
和PRDM
14表达下降,而分化相关基因GATA
4和GATA
6的表达水平较高(F
=82.34、60.02,P
<0.01),差异有统计学意义(图2C)。在蛋白水平上,Western blot检测OCT4和GATA4的蛋白水平与转录组水平上的检测结果一致(F
=16.70、107.80,P
<0.01)(图2D、E),差异有统计学意义。以上结果表明高剂量的七氟烷不利于hESCs未分化状态的维持。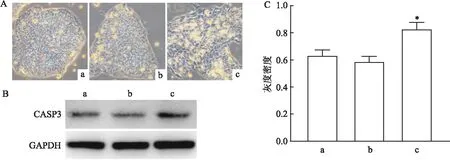
图1 细胞凋亡检测
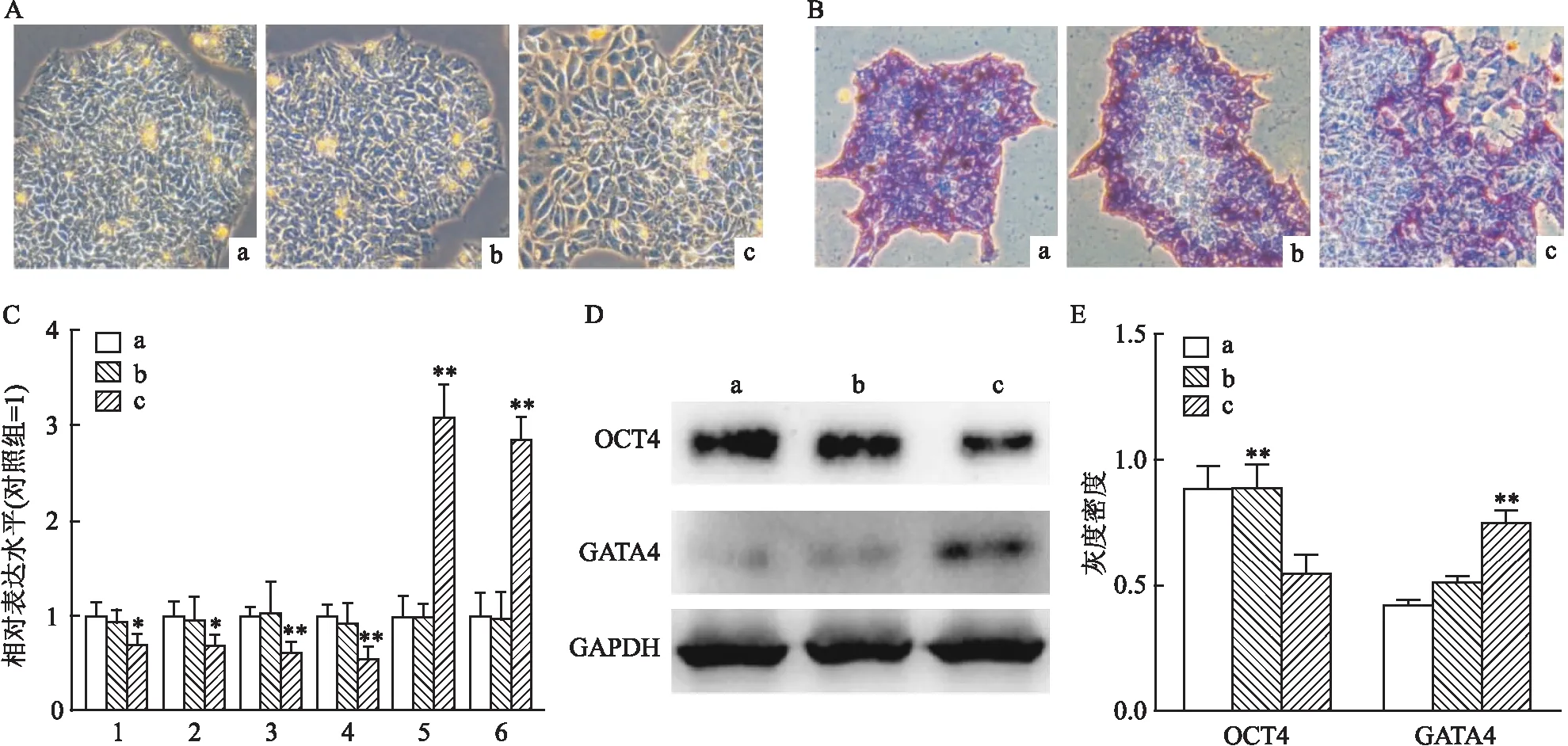
图2 hESCs自我更新的变化
2.3 不同浓度七氟烷对hESCs向神经细胞定向分化的影响
七氟烷主要通过人体的神经系统发挥麻醉功能,为了检测七氟烷是否影响神经系统发生,本研究将对照组和实验组的hESCs向神经细胞分化(图3A)。图3B显示,hESCs成功地分化成了神经元细胞,神经元的标志基因TUJ
1免疫染色显示为阳性。但相比较于对照组和低剂量组,高剂量组处理中的hESCs分化出的神经元细胞较少,神经细胞的标志基因TUJ
1、ASCL
1和MAP
2的mRNA表达较低(图3B、C),差异有统计学意义(F
=7.636、6.975、5.511,P
<0.05)。蛋白水平检测也显示神经细胞标志蛋白PAX6和TUJ
1的水平下降(F
=7.224,P
<0.05;F
=37.8,P
<0.01)(图3D、E),所以高剂量七氟烷处理会降低hESCs向神经细胞分化的效率。2.4 七氟烷调控hESCs自我更新和神经定向分
化的下游机制
hESCs维持多能性依赖细胞因子Activin A和bFGF,前者主要通过TGFβ/SMAD信号通路,后者主要通过FGF/MEK/ERK信号通路。为了检测不同浓度的七氟烷是否影响TGFβ/SMAD和FGF/MEK/ERK信号通路的活性,本研究分别检测了这2个通路中的关键蛋白,即磷酸化和非磷酸化的SMAD和ERK蛋白。相比较于对照组和低剂量组hESCs,高剂量处理组细胞中的SMAD2的总蛋白和磷酸化水平均无明显变化(图4A、B),差异无统计学意义。同样,ERK1的蛋白水平也未发生变化,而ERK的磷酸化水平出现下调(F
=10.39,P
<0.05)(图4C、D),差异有统计学意义。说明高剂量的七氟烷会抑制细胞内ERK信号的活性。
图3 hESCs向神经分化的效率检测
3 讨论
胚胎干细胞 (embryonic stem cells, ESCs)为在体外研究七氟烷对胚胎早期发育的影响提供了良好的模型,前期以小鼠ESCs为研究对象显示:4.1%七氟烷处理会抑制小鼠ESCs自我更新能力,主要涉及的机制可能与非编码RNA密切相关。如七氟烷会上调非编码RNAlet
-7b
的水平,从而抑制体内Lin
28基因的表达,导致小鼠ESCs的增殖以及神经定向分化均出现了降低。Wang et al研究也报道4.1%七氟烷会诱导小鼠ESCs中非编码RNA miR-7a和miR-7b的表达,进而通过降低多能性基因Klf
4的转录水平来抑制小鼠ESCs的自我更新能力。这些研究观察到的细胞表型与课题组在hESCs中观察到的表型一致(图2、3B~E),即高浓度七氟烷会损害hESCs的自我更新和神经定向分化的能力,但涉及的下游机制存在区别。虽然Let
-7在hESCs中负性调控Lin
28的表达水平,但是Lin
28发挥功能的主要方式是促进体细胞重编程为人诱导多能性干细胞,Klf
4在hESCs中表达量也很低。此外,随着ESCs向神经细胞分化,let
-7家族的表达水平会上升,所以过表达let
-7b
有利于神经细胞分化形成,说明在hESCs中七氟烷可能不是通过诱导let
-7家族的水平来发挥功能。这些差异结果可以理解,因为小鼠和人ESCs的生物学特征存在很多不同点。例如,激活ERK信号诱导小鼠ESCs分化,但是促进hESCs多能性的维持。本研究观察到七氟烷会抑制ERK磷酸化水平(图4C、D),所以七氟烷调控hESCs自我更新可能与ERK的活性降低有关,进而降低神经细胞分化形成的效率。虽然降低ERK活性有利于hESCs进入分化状态。但是,ERK信号的激活有利于神经干细胞分化为成熟的神经细胞,而hESCs分化为成熟的神经细胞经历多个阶段,包括神经干/前体细胞的形成,七氟烷是否影响hESCs分化为神经干细胞值得进行进一步研究。此外,七氟烷调控小鼠ESCs自我更新以及导致神经毒性的分子机制多样,除了Let
-7调控信号轴之外,还可能通过抑制长链非编码RNA LncRNARik-203的水平,从而提高miR-466l-3p的表达,导致脑源性神经营养因子表达降低。未来需要深入地在hESCs中挖掘高浓度七氟烷产生毒性的详细分子机制。
图4 SMAD和ERK信号蛋白的测定
虽然在多个人成体干细胞中检测了七氟烷对神经细胞早期发育的影响,但是hESCs分离自人类早期的囊胚,更接近胚胎在母体内早期的发育过程,所以为人类早期发育研究、药物筛选、机体修复等提供了绝佳的体外研究模型和原料。本项目基于hESCs揭示了不同浓度七氟烷对早期胚胎增殖以及神经发育的影响,明确了七氟烷发挥毒性作用的剂量浓度和潜在模式。当前,临床上麻醉人体时七氟烷使用的浓度一般低于2%,未显示对人体造成不好的影响,与本研究在细胞水平上观察到的结果一致。本项目的研究成果将为未来在特殊情况下使用高剂量的七氟烷提供一定的参考。另外,临床上麻醉用药除了七氟烷之外,还有丙泊酚、恩氟烷、米那索龙和普鲁泊福等,将来需要详细地检测它们在体外对hESCs自我更新和分化的影响以及在体内对组织器官发育的调控,结果将为未来在临床上考虑如何组合使用麻醉药物提供有用的参考依据。

