晚期糖基化产物通过RAGE/TLR4/STAT1信号通路诱导巨噬细胞M1型极化
汤祥瑞,张 勇,祝 领,崔倩卫,刘仲伟,石 爽
细胞iNOS表达,分泌炎症因子浓度(P
均<0.001)、细胞p-STAT1表达水平及STAT1核转位水平(P
均<0.001)。FPS-ZM1预处理可显著抑制AGEs诱导的巨噬细胞内ROS水平(P
<0.001)、分泌炎症因子浓度(P
均<0.001)、细胞TLR4及p-STAT1表达水平(P
均<0.001)以及STAT1核转位水平(P
<0.001)。结论
AGEs可通过RAGE/ROS/TLR4/STAT1信号通路诱导巨噬细胞向M1型极化。2型糖尿病(type 2 diabetes mellitus,T2DM)促进动脉粥样硬化( atherosclerosis, AS)。M1型巨噬细胞通过参与局部炎症反应、泡沫细胞生成、血栓形成以及斑块破裂等过程,促进AS的发生发展。由于糖代谢紊乱,T2DM患者体内产生大量的晚期糖基化产物(advanced glycation end products, AGEs),与细胞表面AGEs受体(receptors for AGEs, RAGE)结合后,通过激活NADPH氧化酶使细胞内活性氧簇(reactive oxygen species, ROS)增加。课题组前期研究表明,糖尿病时细胞内ROS水平升高,导致其下游的Toll样受体4(toll like receptor 4, TLR4)信号通路激活。信号转导与转录激活因子1 ( signal transducers and activators of transcription 1, STAT1)是TLR4下游的核因子,激活后发生核转位,启动靶基因转录诱导巨噬细胞发生M1型极化。该研究拟对AGEs可通过巨噬细胞ROS/TLR4/STAT1信号通路激活诱导巨噬细胞发生M1型极化这一科学假说进行验证,进一步阐明T2DM相关AS的发病分子机制。
1 材料与方法
1.1 主要试剂
RPMI 1640培养液、D-Hanks培养液及胎牛血清(fetal bovine serum, FBS)购自美国Hyclone公司;FPS-ZM1购自美国MCE公司,TAK-242购自美国Abmole公司,DCFH-DA活性氧检测试剂盒购自上海Beyotime公司,诱导型一氧化氮合酶(iNOS)抗体、Alexa Fluor 555荧光标记二抗、DAPI、TLR4抗体、GAPDH抗体、Histone H3抗体以及HRP标记二抗均购自美国Abcam公司;STAT1抗体以及磷酸化STAT1(phosphorylated STAT1, p-STAT1)抗体购自美国CST公司。1.2 AGEs的制备
AGEs的制备方法及步骤参考本课题组及既往文献中的描述进行。即在无菌条件下,将牛血清白蛋白(bovine serum albumin, BSA)与0.1 mmol/L甘油醛在0.2 mmol/L的磷酸钠缓冲液(pH=7.4)中充分混合,37 ℃孵育7 d。使用PD-10脱盐柱层析法去除未形成基团的糖类。将未与甘油醛混合的BSA作为对照。1.3 M0型巨噬细胞的分离与培养
原代M0型巨噬细胞的分离与培养步骤均按照既往文献中的描述进行。C57BL/6小鼠颈椎脱臼法处死后以75%酒精充分消毒,在无菌条件下取出小鼠的股骨及胫骨。去除骨周围组织,剪去骨两端,注射器获取骨髓。1 500 r/min离心8 min后,弃去上清液,以红细胞裂解液处理。RPMI 1640培养液重悬细胞后以40 μm滤网过滤。以含20 ng/ml的M-CSF及20% FBS的RPMI 1640培养基在37 ℃条件下进行培养。F4/80染色鉴定获得的M0型巨噬细胞。上述动物实验方案经陕西省人民医院医学研究伦理委员会批准。1.4 细胞处理
根据处理方式不同,将细胞分为以下几组,分别为:① 对照(control)组;② 低浓度AGEs(L-AGEs)组:以终浓度为2.5 μmol/L的AGEs-BSA培养细胞48 h;③ 中浓度AGEs(M-AGEs)组:以终浓度为5 μmol/L的AGEs培养细胞48 h;④ 高浓度AGEs(H-AGEs)组:以终浓度为10 μmol/L的AGEs培养细胞48 h;⑤ RAGE抑制[RAGE(-)]组:以终浓度为0.25 μmol/L的RAGE阻断剂FPS-ZM1对巨噬细胞进行2 h预处理后,以终浓度为10 μmol/L的AGEs培养细胞48 h;⑥ TLR4抑制[TLR4(-)]组:以终浓度为0.04 μmol/L的TLR4抑制剂TAK-242对巨噬细胞进行2 h预处理后,以终浓度为10 μmol/L的AGEs培养细胞48 h。1.5 细胞内ROS水平检测
巨噬细胞内ROS水平使用流式细胞术进行检测。以磷酸盐缓冲液(phosphate buffered saline, PBS)对各组细胞进行漂洗2遍后,在暗盒中将各组细胞在37 ℃条件下与终浓度为10 μmol/L的2′,7′-二氯荧光黄双乙酸盐(2′,7′-Dichlorodi -hydrofluorescein diacetate, DCFH-DA)共培育30 min。使用FACS流式细胞仪(美国BD公司)在529 nm对DCFH-DA荧光信号进行检测。1.6 免疫荧光染色
将各组巨噬细胞制成细胞爬片,PBS漂洗3次后以4%多聚甲醛进行固定。0.2% Triton X-100处理10 min,PBS漂洗3遍后,以封闭缓冲液处理30 min。使用M1巨噬细胞表面标记物iNOS抗体(1 ∶500) 在4 ℃条件下孵育10 h,PBS漂洗后,以Alexa Fluor555标记的IgG第二抗体在37 ℃条件下孵育2 h。DAPI复染。最后在倒置荧光显微镜下观察并使用image J软件(ver1.38)对捕捉的荧光图像进行分析。1.7 Western blot检测
离心收集各组巨噬细胞并以胰酶进行消化后,使用配制好的含苯甲基磺酰氟的RIPA蛋白裂解液(上海Beyotime公司)进行处理。4 ℃条件下14 000 r/min离心10 min后,留取上清液并使用总蛋白抽提试剂盒、细胞质蛋白提取试剂盒以及核蛋白提取试剂盒分别对总蛋白、浆蛋白以及核蛋白进行提取。BCA法对蛋白浓度进行检测,SDS-PAGE对蛋白样本进行分离后,电转印法转印至PVDF膜。封闭缓冲液在4 ℃条件下对裁剪的PVDF膜封闭8 h。4 ℃条件下分别使用TLR4抗体、STAT1抗体、p-STAT1、GAPDH抗体以及Histone H3抗体对PVDF膜孵育8 h。TBST漂洗后,室温下以相应第二抗体孵育30 min,ECL法对Western blot进行显色,使用image J软件对捕捉的图像进行分析。1.8 酶联免疫吸附试验(ELISA)
收集各组细胞上清液,4 ℃条件下3 000 r/min离心20 min。分别使用白细胞介素(interleukin,IL)-6、IL -12以及肿瘤坏死因子α (tumor necrosis factor α, TNFα) ELISA试剂盒对样本相应细胞因子水平浓度进行检测。操作步骤均参照相应ELISA试剂盒说明书进行。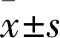
2 结果
2.1 RAGE及TLR4特异性阻断可抑制AGEs诱导的巨噬细胞M0型向M1型转化
如图1免疫荧光染色显示,与control组相比,L-AGEs组iNOS平均荧光强度(mean fluorescent intensity, MFI)较control组显著升高(P
<0.001);M-AGEs组较L-AGEs组显著升高(P
<0.001);H-AGEs组较M-AGEs组显著升高(P
<0.001)。TAK-242预处理可使TLR4(-)组iNOS荧光强度显著下降,较H-AGEs组显著降低(P
<0.001);FPS-ZM1预处理可使RAGE(-)组iNOS荧光强度显著下降,较H-AGEs组显著降低[F
(5,25)=557.9,P
<0.000 1]。2.2 RAGE及TLR4特异性阻断可抑制AGEs诱导的巨噬细胞炎性细胞因子分泌
如图2所示, L-AGEs组IL-6、TNFα以及IL-12的浓度较control组均显著升高(P
<0.001);M-AGEs组IL-6、TNFα以及IL-12的浓度较L-AGEs组显著升高(P
<0.001);H-AGEs组IL-6、TNFα以及IL-12的浓度较H-AGEs组均显著升高(P
<0.001)。TAK-242预处理可使TLR4(-)组的IL-6、TNFα以及IL-12的浓度较H-AGEs组显著降低(P
<0.001);FPS-ZM1预处理可使RAGE(-)组IL-6、TNFα以及IL-12的浓度较H-AGEs均显著降低[F
(5,25)=1 445,P
<0.000 1;F
(5,25)=80.12,P
<0.000 1;F
(5,25)=273,P
<0.000 1]。2.3 RAGE特异性阻断可抑制AGEs诱导的巨噬细胞氧化应激反应
流式细胞术对DCFH-DA水平进行检测的结果如图3所示。L-AGEs DCFH-DA组平均荧光强度较control组显著升高(P
<0.001);M-AGEs组DCFH-DA MFI较L-AGEs组显著升高(P
<0.001);H-AGEs组DCFH-DA MFI较M-AGEs显著升高(P
<0.001)。TAK-242预处理的TLR4(-)组巨噬细胞DCFH-DA MFI较H-AGEs组差异无显著意义(P
>0.05);FPS-ZM1预处理的RAGE(-)组DCFH-DA MFI较H-AGEs组显著下降(P
<0.01),[F
(5,25)=453.2,P
<0.000 1]。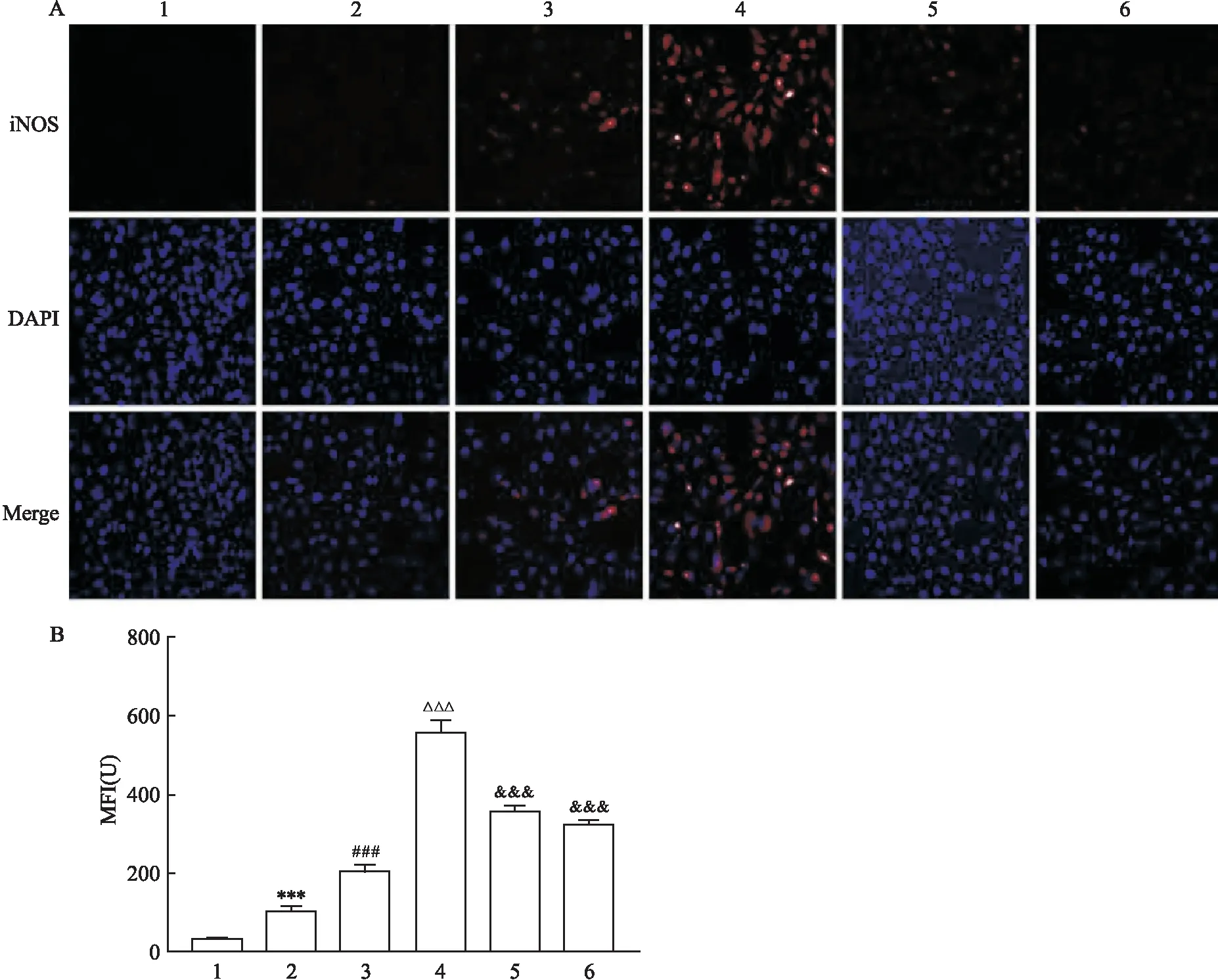
图1 免疫荧光检测细胞iNOS表达
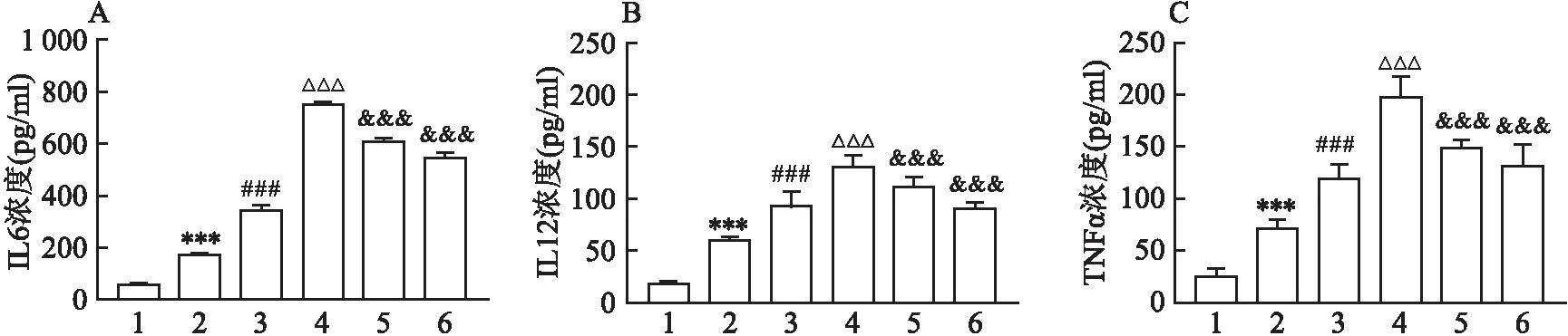
图2 ELISA法检测细胞培养上清液炎症细胞浓度
图3 流式细胞术检测细胞内ROS水平
2.4 RAGE及TLR4特异性阻断可抑制AGEs诱导的巨噬细胞TLR4/STAT1信号通路激
如图4(A~C)所示,与control组相比,L-AGEs、M-AGEs及H-AGEs组巨噬细胞质蛋白TLR4及p-STAT1相对表达水平均升高(P
<0.001)且具有AGEs的浓度依赖性(P
<0.001)。FPS-ZM1预处理可使H-AGEs组TLR4及p-STAT1相对表达水平降低(P
<0.001);TAK-242预处理可使H-AGEs组p-STAT1相对表达水平降低(P
<0.001),而对TLR4相对表达水平差异无显著意义。如图4(D、E)所示,与control组相比,L-AGEs、M-AGEs以及H-AGEs组巨噬细胞核蛋白STAT1水平升高(P
<0.001),且具有显著的AGEs的浓度依赖性(P
<0.001)。TAK-242及FPS-ZM1预处理均可使H-AGEs巨噬细胞核蛋白内STAT1相对表达水平降低(P
<0.001)。[F
(5,25)=124,P
<0.0001;F
(5,25)=188.8,P
<0.000 1;F
(5,25)=100.6,P
<0.000 1]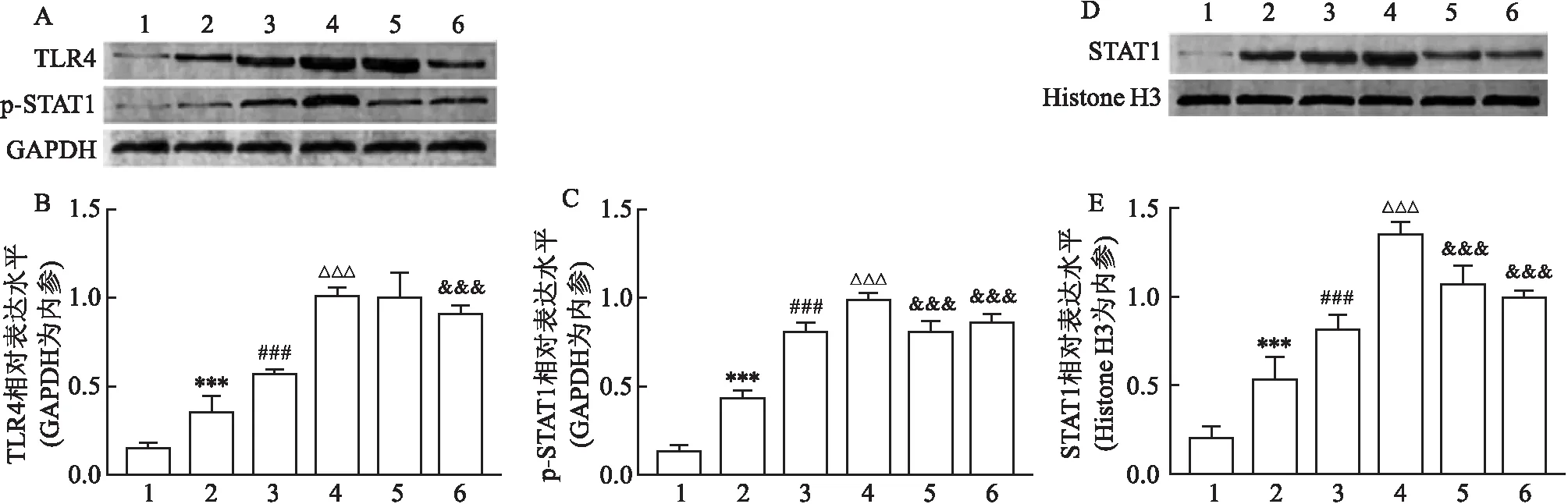
图4 Western blot法检测蛋白水平
3 讨论
当T2DM患者持续高血糖状态控制不佳,其体内的蛋白质、脂类以及核酸相互作用发生Maillard反应,形成的Schiff碱通过Amadori反应形成具有病理作用的产物AGEs,是T2DM患者体内异常代谢产物的典型代表。T2DM患者的主要心血管事件发生率与其体内的AGEs水平有关。本课题组的前期研究表明,AGEs通过影响不同的细胞参与了AS的发生发展。AS可以被视为动脉壁的慢性炎症,血液循环中的单核细胞被趋化并募集至血管壁内分化为巨噬细胞。巨噬细胞有M1及M2 2种亚型,其中M1型巨噬细胞通过诱发炎症反应具有促进AS的作用。
AGEs与细胞表面的RAGE结合后,可激活细胞内NADPH氧化酶导致细胞氧化应激,表现为细胞内ROS的大量聚集。本研究显示,随着外源性AGEs浓度的不断升高,巨噬细胞内ROS水平升高。TLR4是巨噬细胞表面识别病原相关分子模式的识别受体之一。TLR4信号通路的激活被证实与AS的发生发展有关。本研究结果表明,巨噬细胞内ROS水平的升高导致了TLR4信号通路的激活,表现为TLR4表达水平的增加,这与本课题组的前期研究结果相符。FPS-ZM1是RAGE的拮抗剂,可通过阻断AGEs与RAGE的结合进而抑制其下游信号的激活。结果表明,对RAGE的特异性阻断可使AGEs诱导的巨噬细胞内ROS含量及TLR4表达水平降低。上述结果表明在巨噬细胞内,RAGE/ROS/TLR4可构成信号通路并可由AGEs激活。
本研究显示,AGEs作用后,巨噬细胞表面M1型标记物iNOS表达水平升高,表明AGEs可使巨噬细胞发生M0型向M1型的极化。STAT通路在哺乳动物细胞高度保守,对诸如细胞生长、凋亡以及免疫应答等均具有调控作用。STAT1是TLR4的下游效应因子,TLR4信号通路激活后,可指导STAT1在胞质内发生磷酸化,形成二聚体后发生核转位,作用于例如iNOS等靶基因的启动子。既往研究表明,STAT1是巨噬细胞发生M1型极化的关键通路之一。TAK-242通过结合TLR4胞内结构域,抑制TLR4信号转导。本研究还表明,以TAK-242及FPS-ZM1分别对TLR4和RAGE的特异性阻断均可显著抑制巨噬细胞内STAT1的磷酸化及核转位,抑制AGEs诱导的巨噬细胞M1型极化。

