Glut 1基因沉默对人结肠癌HT-29细胞株增殖、分化及凋亡的影响及机制研究
郭圣超,武雪亮,薛 军,韩 磊,孙光源,杨东东,屈 明
葡萄糖转运蛋白在向代谢活性细胞提供能量的过程中发挥着关键作用,葡萄糖转运蛋白-1(glucose transporter-1,Glut
1)在真核生物和原核生物中均有发现,其表达升高或激活已被证明是诸多恶性肿瘤发生的主要原因。转化生长因子(transforming growth factor,TGF)-β是与肿瘤发生、进展和转移调控密切相关的分泌型配体。TGF-β信号通路在控制细胞增殖和结肠直肠癌的分化中具有重要作用。现已证实磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶标(phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin,PI3K-AKTmTOR)信号通路与细胞凋亡、增殖、血管生成和转移密切相关,也是导致结直肠癌变的重要机制。因此,该研究旨在探讨Glut
1基因沉默介导的TGF-β/PI3K-AKT-mTOR信号通路对结肠直肠癌细胞的作用,为结直肠癌的靶向诊疗提供科学参考。1 材料与方法
1.1 材料与主要试剂
人结肠癌细胞株HT-29细胞(上海生物工程研究所);10%胎牛血清RPMI 1640、DMEM(美国Gibco公司);siRNA干扰序列(上海生工生物工程技术服务有限公司),载体pSIREN(北京华奥正生科技有限公司),Lipofectamine 2000(美国Invitrogen公司),DAPI(上海碧云天生物技术有限公司),TRIzol试剂 (美国Invitrogen公司),PrimeScriptTM RT reagent Kit (北京智杰方远科技有限公司),引物(北京擎科新业生物技术有限公司),BCA检测试剂盒(上海碧云天生物技术有限公司),酶抑制剂(北京嘉美纽诺生物科技有限公司),MTT溶液(美国Sigma-aldrich公司)、PI染液(上海前尘生物科技有限公司)。1.2 细胞培养
将H-29细胞培养于含有10%胎牛血清的RPMI 1640培养基中,以1×10个/孔的密度将细胞分种于6孔培养板,并置于37 ℃、5% CO及饱和湿度的孵箱中培养。1.3 构建质粒
siRNA序列设计根据Genbank中的Glut 1的mRNA全序列(005983)从Glut 1编码区中寻找符合设计原则的靶序列,通过BLAST软件确定与其他非相关基因无同源性,按照Pg-PU 6/Neo载体的要求设计能编码siRNA的寡核苷酸链 (正:5′-CACCGGGAGTGACAAAGACTTTGTTCAAG CA-3′;反:5′-GATCCAAAAAAGGGAGTGACAAAGA CTTCTC-3′),对所有的寡核苷酸片段进行合成。1.4 细胞分组与转染
选对数生长期细胞,接种于6孔板,每孔5×10个细胞,给予新鲜完全培养基培养至细胞融合度接近50%~80%时进行转染。依据Lipofectamine 2000转染,将细胞分为3组:Blank组(人结肠癌HT 29细胞)、NC组(转染非干扰序列的HT-29细胞)和shGlut 1组(转染siRNA序列的HT-29细胞)组。lipo溶液:240 μl无血清培养基+10 μl lipo溶液,总体积250 μl,温育5 min。质粒溶液:20 μl无血清培养基+4 μg质粒总体积24 μl。分别将lipo溶液和质粒溶液混合,室温下放置20 min,混合液逐滴加入孔中,摇动培养板,轻轻混匀。在37 ℃,5%CO中保温,5~6 h后,换完全培养基,继续培养24~48 h,进行后续实验。1.5 免疫荧光法
将细胞接种于6孔板中,加入2 ml完全培养基,置CO孵箱中37 ℃培养过夜。待细胞长到50%~ 80%时,在灭菌的离心管中配制如下溶液。溶液A:将4 μg待转染的纯DNA稀释到250 ml无血清培养基中,静置5 min;溶液B:将2~25 ml LipofectAMINE稀释到250 ml无血清培养基中,静置5 min。混合溶液A和B,室温放置15~45 min。用2 ml无血清培养基洗净细胞,加入0.8 ml无血清培养基/孔,将脂质体复合物滴加在孔中混匀,置CO孵箱中37 ℃孵育20~24 h。DAPI避光孵育30 min。用完全培养基替换转染液,继续培养。24 h后在荧光显微镜下观察蛋白表达情况,取2个表达区域保存,取均值,转染效率=转染细胞数目/总细胞数目。1.6 qRT-PCR法
取结直肠癌组织和癌旁正常组织各30 mg,加入1 ml的TRIzol试剂,在冰浴中粉碎,提取组织中总RNA,采用紫外分光光度法检测RNA的纯度及浓度,将纯度为A260/280=1.8~2.0的所有样品浓度调整为0.1 ng/μl,用逆转录试剂盒PrimeScriptRT reagent Ki将RNA逆转录成cDNA (50 ng/μl),逆转录体系10 μl,参照说明书进行,设定反应条件为:37 ℃、15 min × 3次 (逆转录反应)、85 ℃、5 s (逆转录酶失活反应)、-80 ℃冻存、备用。通过Premier 5.0 软件自行设计引物,按两步法在ABI 7900 HT实时定量PCR仪上进行,以GAPDH为内参照。反应条件:95 ℃预变性30 s;95 ℃变性5 s;58 ℃退火30 s;72 ℃延伸15 s;40个循环。采用2法计算mRNA的相对表达水平,每个样品的每个基因设3个复孔。实验重复3次。1.7 Western blot法
取组织样品30 g,检测总蛋白浓度。取对数生长期细胞,以3 000 r/min、4 ℃离心20 min,弃上清液,估计细胞压积(packed cell volume,PCV),按每20 μl细胞压积加入裂解液100 μl和酶抑制剂1 μl的比例冰上裂解30 min,低温12 000 r/min离心10 min,取上清液蛋白定量检测。取50 μg蛋白溶于2×SDS上样缓冲液中,将样本100 ℃煮沸5 min后,将上述各样品经质量浓度10% SDS-PAGE凝胶,转移至PVDF膜,用质量浓度5%脱脂奶粉室温封闭1 h,孵育兔抗人一抗 (Glut
1:1 ∶1 000、TGF-β 1:1 ∶1 000、PI3K:1 ∶2 000、AKT:1 ∶500、p-PI3K:1 ∶800、p-S 308-AKT:1 ∶1 000、p-S 473-AKT:1 ∶1 000、p-T 389-S6K1:1 ∶500、p-T 70-4 EBP1:1 ∶500、PTEN:1 ∶600、mTOR:1 ∶500、Bax:1 ∶800、Bcl-2:1 ∶1 000、Cleaved Caspase-3:1 ∶1 000、Cleaved-PARP:1 ∶1 000),用TBST洗3遍后将膜与1 ∶5 000稀释的HRP标记二抗羊抗孵育1 h。TBST漂洗后,ECL显色,X片曝光、照相。使用凝胶成像分析系统对显色条带进行吸光度分析。样本蛋白的相对含量=样本的平均吸光度/内参照的平均吸光度,并做统计分析图。重复3次。1.8 MTT法
转染24 h后,取对数生长期的细胞,用含10%胎牛血清的RPMI 1640培养基制备成2.5×10个/ml 的细胞悬液,接种到96孔培养板,根据实验分组,每组各设8孔,每孔100 μl,置于37 ℃、5% CO细胞培养箱中培养,分别于培养24、48、72 h时取出培养板,每孔加入5 mg/ml MTT溶液10 μl继续培养4 h,终止培养后,弃上清液,每孔加150 μl DMSO,充分溶解,自动酶标读数仪490 nm处测定各孔吸光度(optical density,OD)值。重复3次。1.9 流式细胞术
细胞转染48 h后,0.25%胰蛋白酶消化,使细胞数调整为1×10/ml,取1 ml细胞1 500 r/min离心10 min,弃上清液,加2 ml PBS,离心弃上清液,加入预冷的70%乙醇固定细胞,4 ℃过夜。用PBS洗涤细胞2遍,取100 μl细胞悬液,加入50 μg含RNAase的PI染液,避光30 min后用100目的尼龙网过滤,流式细胞仪记录激发波长在488 nm处红色荧光检测细胞周期。Annexin V-FITC/PI双标染色检测细胞凋亡,将处理好的细胞置于37 ℃、5% CO培养箱中培养48 h,收集细胞,PBS洗涤2遍后离心将细胞重悬于200 μl结合缓冲液中,加入10 μl Annexin V-FITC和5 μl PI混匀,避光室温反应15 min,加入300 μl结合缓冲液,用流式细胞仪检测细胞凋亡情况,重复3次。1.10 平板克隆形成实验
用胰蛋白酶消化各组细胞,血清终止后重悬并计数,按照每孔1 000个细胞的密度接种于6孔板中,37 ℃、5% CO培养于半固培养基中,2周后用结晶紫染色,观察细胞集落数量和大小的变化。重复3次。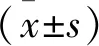
2 结果
2.1 癌组织及癌旁正常组织中TGF-β、PI 3 K-AKT-mTOR信号通路及凋亡蛋白的表达
qRT-PCR和Western blot结果显示,和癌旁正常组织比较,结直肠癌组织中Glut 1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA和蛋白的表达上调(t
=19.91、42.55、28.96、26.63、17.39,P
均<0.05);PTEN、Bax的mRNA和蛋白的表达明显下调(t
=54.01、28.21),p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白的表达明显上调(t
=23.17、34.81、31.25、27.84),Cleaved Caspase-3、Cleaved-PARP蛋白的表达明显下调(t
=27.62、16.61,P
均<0.05),p-T 308-AKT蛋白则差异无显著意义,见图1。2.2 转染效率检测
细胞转染72 h后,在荧光显微镜下可见明显荧光。计算视野中NC组的平均转染效率为 (75.2±3.1) %,shGlut 1组的平均转染效率为 (92.5±4.2) %,符合实验要求,见图2。2.3 各组细胞中中TGF-β、PI3K-AKT-mTOR信号通路及凋亡蛋白的表达
qRT-PCR与Western blot结果显示,与Control组比较,其余各组细胞Glut
1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA(F
=26.00、26.41、20.57、31.18、27.96)和蛋白(F
=21.29、22.76、23.97、26.15、37.64)的表达明显上调(P
均<0.05),PTEN、Bax的mRNA(F
=84.94、96.18)和蛋白(F
=26.87、22.01)的表达明显下调,p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白(F
=62.52、87.08、37.73、34.31)的表达明显上调,Cleaved caspase-3、Cleaved-PARP蛋白(F
=74.98、104.8)的表达明显下调(P
均<0.05),与Blank组和NC组比较,shGlut1-1组Glut 1、TGF-β 1、AKT、mTOR、Bcl-2 mRNA和蛋白的表达明显下调(P
均<0.05),PTEN、Bax的mRNA和蛋白的表达明显上调,p-PI3K、p-S 473-AKT、p-S 389-S6K1和p-T 70-4 EBP1蛋白的表达明显下调,Cleaved Caspase-3、Cleaved-PARP蛋白的表达明显上调(P
均<0.05),各组p-T 308 -AKT蛋白则差异无显著意义,见图3。
图1 癌组织和癌旁正常组织相关mRNA和蛋白表达水平比较

图2 荧光显微镜下观察转染效率 ×200 A:明场;B:暗场

图3 转染后各组细胞中mRNA和蛋白表达水平比较
2.4 各组细胞增殖能力变化
MTT结果表明,与24 h(F
=0.65)比较,各组细胞在48、72 h (F
=24.87、36.66)后细胞OD值升高,差异有统计学意义(P
均<0.05),和Control组比较,其余各组细胞OD值较高(P
均<0.05),与Blank组和NC组比较,shGlut 1组OD值较低(P
均<0.05),见图4。
图4 各组细胞增殖能力变化
2.5 各组细胞周期及凋亡情况
PI单染法显示:和Control组比较,其余各组细胞G/G期较少而S期较多(F
=18.82,P
均<0.05);与Blank组和NC组比较,shGlut1组G/G期较多而S期较少,凋亡率较高(F
=798.8,P
均<0.05);各组细胞G/M期差异无显著意义,见图5。和Control组比较,其余各组凋亡率较低 (P
均<0.05),与Blank组和NC组比较,shGlut 1组凋亡率较高(F
=49.39,P
均<0.05),见图6。
图5 各组细胞周期检测
2.6 平板克隆形成实验结果
和Control组比较其余各组细胞克隆细胞形成数显著较多(F
=77.91,P
均<0.05),Blank组和NC组克隆细胞形成数差异无显著意义;与Blank组和NC组比较,shGlut 1组克隆形成数明显小于Blank组和NC组,肿瘤增长速度最慢,差异有统计学意义(P
均<0.05),见图7。3 讨论
恶性肿瘤的高消耗、高代谢病理特征客观上要求摄取较普通细胞成倍的能量,但在正常情况下,葡萄糖无法独立通过细胞膜的双分子层结构,必须依赖跨膜分布的葡萄糖转运蛋白作为载体,因而这类载体的活性及表达量对肿瘤细胞的恶性增殖具有非常重要的意义。Glut
1是葡萄糖转运蛋白最重要的成员,内含492个氨基酸,由12个疏水性的跨膜α螺旋结构域、2个电荷的膜内区及膜外区构成,这即是其转运的基础框架。Zhao et al通过临床荟萃分析证实高表达Glut
1可作为诸多癌症一个独立的预后指标,可用于监测癌患者的生存预后情况;Kurahara et al证实在胰腺导管癌组织中Glut
1表达明显上调,且Glut
1表达水平越高的患者预后越差;Seleit et al报道Glut
1在非黑色素瘤皮肤癌中高表达,考虑为该病变的潜在风险因子。但Glut
1在结直肠癌中的研究较少,其致癌机制尚不明确,基于此,本研究通过TGF-β/PI3K-AKT-mTOR信号通路探究Glut
1基因对结肠癌细胞生物学行径的影响。
图6 各组细胞凋亡率检测

图7 平板克隆形成实验
本研究通过qRT-PCR法和Western blot法检测表明,与Control组比较,结直肠癌组织中Glut1、TGF-β1、PI3K、AKT、mTOR、Bcl- 2 mRNA和蛋白的表达上调,差异显著,因而证实Glut
1表达升高满足了结肠癌细胞对能量的大幅度需求,促进癌细胞的生长。Yang et al纳入2 077例结直肠癌患者行Meta分析证实Glut
1的表达与结直肠癌的总生存期和无病生存期相关,同时也是结直肠癌的侵袭性临床特征的指标,本研究结果与之一致。既往研究表明PI3K/AKT信号传导与结直肠癌的发生、发展相关。由于上游致癌基因(PI3K,AKT)的激活和(或)肿瘤抑制因子(PTEN,LKB1)的失活,诸多恶性肿瘤中均检测到mTORC 1活性升高,而作为PI3K/AKT信号转导的下游效应因子,mTOR调节结肠直肠癌的肿瘤发生,因而考虑抑制PI3K-AKT-mTOR信号传导过程可能拮抗结直肠癌的进一步发展。TGF-β随着多细胞生物体的进化而出现,在胚胎发生中起关键作用,对于组织稳态至关重要。据报道,TGF-β可通过激活PI 3K-Akt-mTOR信号通路介导对葡萄糖的反应。本实验研究结果显示shGlut 1组较NC组和Blank组Glut 1-AKT-mTOR和TGF-β 1的mRNA和蛋白表达均明显下降;且shGlut 1组结肠直肠癌细胞增殖能力显著下降,而细胞凋亡增加,从而证实Glut 1表达降低/沉默通过抑制TGF-β-PI3K-AKT-mTOR信号通路来抑制细胞生长,促进细胞凋亡。

