成骨诱导剂缓释系统对拔牙创骨改建的影响
刘旭琳,张潇月,田 欣,陈俊良,2,何 芸,2
牙拔除术后牙槽骨因缺乏牙齿的支持和功能性刺激会发生骨吸收,从而给后续修复治疗带来不利影响,尤其是对剩余牙槽骨骨质和骨量要求颇高的骨支持式修复方式—种植修复。研究表明70%~80%骨吸收发生在拔牙后的最初3个月,且水平向骨丧失量多于垂直向。如果能在拔牙同时采取措施,有效促进成骨,能对牙槽嵴形态的维持起到重要作用。虽然,很多学者尝试将生物材料局部应用于拔牙窝,期望能促进成骨;但是目前尚没有公认理想的生物材料。前期研究显示将由地塞米松、β-甘油磷酸钠和维生素C组成的成骨诱导剂(osteogenic inducer,OI)局部应用于兔拔牙窝,影像学和组织学分析显示OI可促进拔牙创周围早期骨改建,减少牙槽骨高度的吸收。但同时也发现一个问题:牙槽骨宽度(alveolar bone width, ABW)吸收与对照相比无明显差异。由此推测,这可能与药物不均匀释放以及局部药物浓度难以长期维持有关。因此,该研究以聚乳酸-羟基乙酸共聚物 (poly (lactic-co-glycolic acid),PLGA)为缓释载体,OI为有效药物成分,研制出了黏度适宜,凝结良好,能够缓慢、稳定释放药物的OI缓释系统。且已通过体外实验, 证实了其对成骨细胞增殖、分化的的促进作用。该研究在此基础上,进行动物水平的体内研究,将OI缓释系统局部应用于兔下前牙拔牙窝,观察其对拔牙创骨改建的影响,为临床上寻求一种操作方便、价格合理、释放可控的生物材料以促进拔牙创骨改建奠定基础。
1 材料与方法
1.1 实验动物
3月龄雄性新西兰大白兔27只,体质量2.5~3.0 kg,由西南医科大学动物实验中心提供,所有动物均独立笼养于西南医科大学动物实验中心,自由进食,观察2周后用于实验。动物实验程序按照赫尔辛基伦理标准执行,并获得本院伦理委员会批准(审批号:20160034)。1.2 实验材料
OI成分:β-甘油磷酸钠(美国Sigma公司)、维生素C、地塞米松(北京索莱宝科技有限公司);PLGA 75/25(大连美仑生物技术有限公司),有机溶剂N-甲基-2吡咯烷酮(N-methyl-2-pyrrolidone, NMP)、反应性增溶剂三乙酸甘油酯(Glycerol triacetate , GTA),上海麦克林生物科技有限公司。NMP与GTA体积比为5 ∶5,PLGA质量分数为40%,OI体积分数为15%。1.3 仪器设备
正置相差显微镜BX50(日本Olympus公司),旋转式石蜡切片机RM2235(德国Leica公司),KODAK 9500锥形束CT(cone beam CT, CBCT) ( 美国Care stream Health公司),Mimics Research软件(比利时Materialise公司),Image-Pro Plus图像分析软件(美国Media Cybernetic公司)。1.4 实验方法
将27只新西兰大白兔随机分为PLGA+OI组、PLGA组和空白组,每组各9只。用3%戊巴比妥钠经耳缘静脉注射对实验兔进行全身麻醉,麻醉剂量30 mg/kg。角膜反射消失后取仰卧位固定于手术台,手术区消毒,碘伏消毒口腔,牙周探针分离牙龈,微创拔牙挺配合牙钳微创拔除双侧下颌前牙,搔刮冲洗牙槽窝,清除残余骨屑等。PLGA+OI组拔牙创内注入OI缓释系统1.0 ml,使其填塞整个拔牙窝(图1);PLGA组注入空载PLGA凝胶1.0 ml;空白组不作处理,用可吸收线拉拢缝合牙龈。术后连续3 d肌肉注射青霉素(每天3次,每次80万单位)。术后1周,喂流质食物,每周调磨上颌前牙,避免其过度生长而导致咬合创伤。密切观察伤口愈合情况及实验兔的精神和活动情况。分别于术后2、4、8周时,每组随机处死3只实验动物,取下前牙区牙槽骨标本,拍摄CBCT后立即用10%多聚甲醛固定,EDTA脱钙,制作组织切片备用。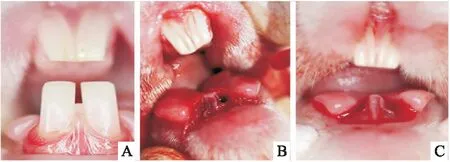
图1 微创拔除新西兰大白兔双侧下前牙
1.5 影像学检查
CBCT拍摄参数:5.0 mA ,120 kV曝光9.6秒,层厚0.2 mm。每张CBCT均选择3个切面进行测量,每个切面随机测3次。骨密度值(bone mineral density, BMD)用Mimics Research软件的密度测量工具进行测量,测量位置为高于下颌骨下缘 4、6、8 mm的3 个水平切面,切面厚度1 mm,每个切面随机选择拔牙窝内5 mm 周径的矩形区域进行分析(图2),以测量的平均CT值记录为该样本的密度。ABW和牙槽骨高度(alveolar bone height, ABH)变化值以8周组动物的拔牙前CBCT测量值(CBCT Ⅰ)减去处死后CBCT测量值(CBCT Ⅱ)表示。宽度的测量位置同BMD,测量各平面上的最大宽度。高度测量在3个矢状面切面上进行,分别是:拔牙窝颊侧切平面,舌侧切平面,以及前2 个平面的中间平面,以下颌骨下缘到牙槽骨顶点的最大值作为高度值(图3)。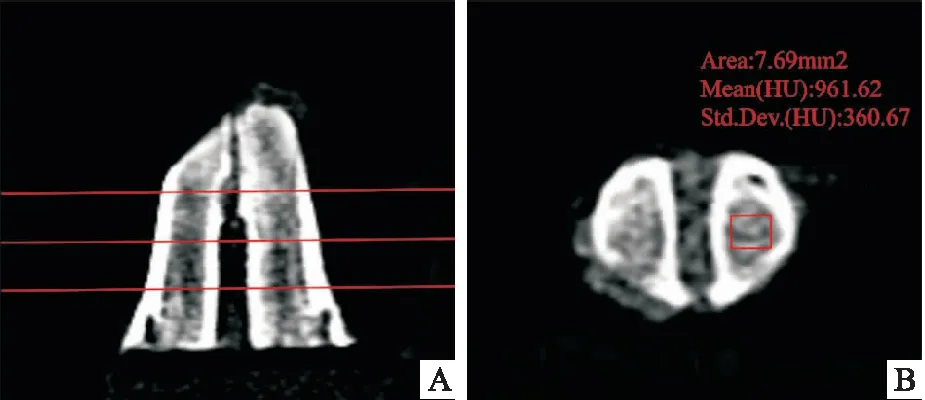
图2 测量BMD值 A:测量位置; B:测量区域
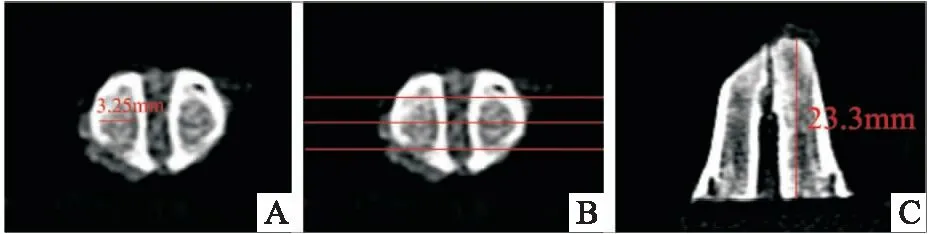
图3 测量ABW和ABH A:ABW测量示意;B:ABH测量位置;C:ABH测量示意
1.6 组织学检查
取各组实验标本于多聚甲醛中固定48 h,EDTA脱钙2个月,乙醇逐级脱水,石蜡包埋,做拔牙窝冠状位切片,切片层厚2~3 μm,苏木精-伊红(hematoxylin-eosin,HE)染色,正置相差显微镜观察新生骨组织情况。每张切片均在×100下进行观察。通过Image-Pro Plus(Media Cybernetic,Silver Springs,MD,USA)图像分析软件对标本切片进行测量,每张切片均选取拔牙创正中位置水平方向连续3个视野,计算新生骨小梁的面积比。
2 结果
2.1 骨密度测量结果
随着术后时间的延长,各组骨密度均不断增加。术后2、4、8周,PLGA+OI组BMD均大于PLGA组和空白组,PLGA组大于空白组,差异有统计学意义(P
<0.001),见表1。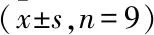
表1 各组不同时间点BMD测量值
2.2 ABW及ABH测量结果
术后8周,ABW及ABH变化值测量结果见表2,可见各组数据均为正数,说明各组的ABW和ABH均出现了不同程度的吸收。PLGA+OI组宽度与高度变化值均小于PLGA组与空白组,差异有统计学意义(P
<0.001)。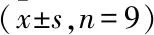
表2 术后8周各组ABW和ABH变化值
2.3 组织学观察结果
术后2周,PLGA+OI组(A1)可见较多新生骨岛,成骨细胞规则排列在新生骨组织周围,PLGA组(B1)和空白组(C1)新生骨较少,可见大量血细胞及纤维结缔组织。术后4周,PLGA+OI组(A2)新生骨组织相互连接形成板层状类骨质,骨小梁较粗大,排列整齐,PLGA组(B2)间质内仍可见大量血细胞,空白组(C2)纤维结缔组织较多,少量骨组织散在分布。术后8周,PLGA+OI组(A3),已形成成熟板状骨,骨板致密,与周围骨组织完全融合,PLGA组(B3)新生骨组织排列紊乱,可见破骨性陷窝,空白组(C3)新生骨组织未完全融合(图4),定量分析结果见表3。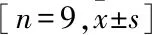
表3 各组不同时间新生骨面积百分比
3 讨论
拔牙创的骨改建是成骨细胞主导的新骨形成和破骨性吸收之间的动态平衡,其中新骨形成起着重要的作用。而拔牙创愈合过程中,上皮细胞和结缔组织向拔牙创内生长速度比骨组织更快,使软组织优先占据拔牙窝,使骨形成相对减少,从而导致牙槽嵴高度和宽度降低。因此促进牙拔除术后拔牙窝的早期骨改建对牙槽嵴形态的维持及后续修复治疗具有重要作用。目前研究较多的局部应用药物及材料有Bio-Oss骨粉、重组人形态发生蛋白-2、富血小板纤维蛋白等。但由于这些材料存在价格较贵、远期效果尚不确定等缺陷,目前尚没有公认一致的材料可用于拔牙后促进牙槽骨改建。理想的骨组织工程支架应具备以下特点:具有良好的生物相容性,骨传导性和骨诱导性,其降解速率与骨生长速率相匹配,促进骨质的沉积和生长,其降解产物无毒性,经济易得等。在前期研究表明局部应用由10mmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 mg维生素C组成的OI,能促进新西兰兔拔牙创骨愈合的基础上,利用PLGA作为缓释载体,构建OI缓释系统,通过观察研究不同溶剂配比、溶剂用量、PLGA质量分数和OI体积分数对凝胶性状、凝结时间、凝胶黏度和药物累积释放率的影响,发现溶剂N-甲基-2吡咯烷酮 ∶三乙酸甘油酯体积比为5 ∶5,PLGA质量分数为40%,OI体积分数为15%的凝胶黏度适宜,凝结良好,药物浓度维持时间达14 d以上。本实验将以PLGA凝胶为载体的OI缓释系统局部应用于兔下前牙拔牙窝,影像学结果提示OI缓释系统能较快提高新骨骨密度,并减少拔牙创愈合早期ABW和ABH的吸收。组织学结果提示PLGA+OI组新生骨组织速度优于PLGA组和空白组。
OI缓释系统促进牙拔除术后早期骨改建,降低ABW及ABH吸收的机制可能与以下几个因素有关:PLGA凝胶一方面使OI的释放均匀缓慢,延长了药物作用时间;另一方面作为支架结构阻挡上皮细胞、成纤维细胞及软组织的长入,为成骨细胞向拔牙窝内的增殖分化提供足够空间。OI缓释系统药物成分能有效促进成骨细胞增殖与分化。其药物成分的成骨诱导机制与以下几个因素有关:① 地塞米松可以显著增加骨髓基质干细胞的碱性磷酸酶活性,刺激细胞外胶原基质的合成、钙的沉积和矿化结节的形成。同时,地塞米松能刺激骨改建重要核心因子的表达并增强其的活性,使成骨标志基因(骨钙素、Ⅰ型胶原、骨桥蛋白等)的转录增加,从而刺激BMSCs向成骨细胞分化,并激活成骨细胞功能。② β-甘油磷酸钠则可以为成骨细胞提供磷酸离子,促进生理性钙盐的沉积和钙化,从而加速节结钙化。③ 维生素C可以调节碱性磷酸酶的活性,启动钙化; 同时,能促进细胞合成胶原,形成钙化,促进成骨。
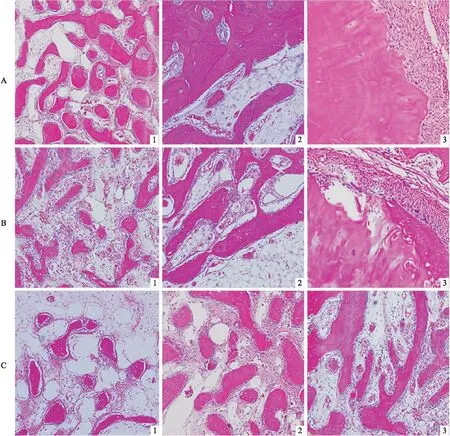
图4 HE染色结果 ×100 A:PLGA+OI组;B:PLGA组;C:空白组;1、2、3:随机选取不同位置
综上所述,以PLGA凝胶为载体的OI缓释系统可有效延长OI作用时间,促进兔拔牙创早期骨愈合,降低ABW和ABH的吸收值。此生物材料制作简便,临床应用程序简便、易于掌握,价格相对便宜,为牙拔除术后牙槽嵴形态的维持提供了新方法。

