植物提取物对晚期糖基化终产物抑制 机理的研究进展
韩 喻,扈莹莹,贺菁蕾,王 辉,陈 倩,秦立刚,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.东北农业大学动物科学技术学院,黑龙江 哈尔滨 150030)
晚期糖基化终产物(advanced glycation end products,AGEs)是由还原糖中的羰基与蛋白质、脂类和核酸中的游离氨基结合而引发的一系列化学反应的最终产物[1]。 人体内AGEs的来源主要包括内源性产生和外源性摄入,外源性AGEs通过烟草或食品等摄入产生。体内AGEs的积累过多可能会促进人体的氧化应激反应,引起神经 细胞损伤,从而导致多种疾病,如神经退行性疾病、炎症反应,以及肾脏、心血管疾病和糖尿病,甚至癌症[2-3]。 近年来研究主要集中在各种植物提取物对AGEs活性的抑制、影响因素和作用机理上,但鲜有关于此方面的 综述。本文对AGEs的来源、形成机理和对人体的致病性等方面进行介绍,并概述了植物提取物对AGEs的抑制机理及其研究进展,旨在为控制食品加工过程中产生的AGEs提供理论依据。
1 AGEs的概述
1.1 AGEs的结构与特性
AGEs是由葡萄糖或其他还原糖(如戊糖、木糖和核糖等)与蛋白质、核酸或脂质中的游离氨基进行反应而形成的一类糖基化产物[4-5]。此概念最初由Brownlee等[6]于1984年提出,用来描述生物体内美拉德反应晚期阶段所形成的褐色、发荧光并具有交联结构的一类物质。根据是否具有荧光特性和是否与蛋白质存在交联结构来对AGEs进行分类[7],可分为具有荧光特性且互相交联的AGEs、不具有荧光特性但互相交联的AGEs以及既不具有荧光特性也不存在结构交联的AGEs。AGEs的荧光特性被广泛应用于AGEs检测技术中[8],其中AGEs的检测方法主要为色谱法和酶联免疫法,不具有荧光特性的AGEs(如羧甲基赖氨酸(NԐ-(carboxymethyl)-lysine,CML))在使用高效液相色谱荧光检测法、气相色谱-质谱联用法等色谱分析技术之前需要先利用邻苯二甲醛进行样品衍生化处理[2,9-10]。AGEs能够与蛋白质进行分子间的共价交联,AGEs及其蛋白加成产物一旦形成,其结构十分稳定且不可逆性较强,很难降解[4,11-12]。
1.2 AGEs的来源
AGEs的来源主要分为内源性产生和外源性摄入,其中外源摄入主要来自食物,被称作食物源晚期糖基化终产物(dietary advanced glycation end products,dAGEs)[13]。 dAGEs的摄入是人体AGEs的主要来源,从定量的角度来看,dAGEs对人体内AGEs总量的贡献比葡萄糖代谢异常或脂质过氧化引起的内源性AGEs贡献大[14]。从组成、结构和功能方面来看,dAGEs与内源性AGEs几乎没有区别[15-16],但是二者在人体内的存在状态有较大的差异。dAGEs经过人体吸收后主要以游离或与短肽结合的形式存在于体内,而本身存在于体内的内源性AGEs则主要以与人体内蛋白组织稳定结合的形式存在[17]。dAGEs主要来自于动物源食物,Uribarri等[18]检测了549 种食品中的dAGEs,并发现动物源食品中的dAGEs含量最高,其中牛肉和奶酪中的dAGEs含量最高,其次是家禽、猪肉、鱼和鸡蛋。虽然油脂类食品含有更多的dAGEs,若考虑其总摄入量的贡献度,油脂类食品则低于动物源食品,其次是碳水化合物食品和谷物、豆类、蔬菜、水果等植物源食品。此外,除未经烹调的动物源食物中自然存在的AGEs,烹调方式也会促使这些食物形成新的AGEs。Goldberg等[19]发现烹调方式对于AGEs的变化影响为油炸> 烧烤>烘焙>蒸煮。评估AGEs每日健康摄入量对日常膳食的安排来说有着指导性意义,其中Delgado-Andrade等[20]建议CML的人均日摄入量应为34~252 μg/kg。 此外,除了直接摄入食物中的AGEs,高糖的摄入 也会促进体内AGEs的生成(图1)。在人体内葡萄糖过量的情况下,其会在醛糖还原酶和山梨醇脱氢酶的连续作用下通过多元醇途径转化为果糖。葡萄糖代谢途径将会导致组织中的果糖水平和还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide hydrate,NADH)与烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的比值升高,从而导致甘油醛-3-磷 酸(glyceraldehyde-3-phosphate,GAP)和3,4-二羟基苯乙酮(3,4-dihydroxyace tophenone,DHAP)的积累,其中GAP和DHAP分别为二羰基化合物乙二醛(glyoxal,GO)和丙酮醛(methylglyoxal,MGO)的前体[21]。
2 AGEs的形成途径
AGEs是由葡萄糖、醛类或其他糖衍生物和蛋白质、核苷酸或脂质在人体内发生非酶糖基化反应而产生的。其中AGEs的形成途径[11,22-23]如图2所示,包括:1)Amadori重排产物(Amadori rearrangement products,ARPs)非氧化裂解;2)席夫碱氧化裂解(Namiki途径);3)葡萄糖自氧化(Wolff途径);4)糖酵解途径;5)多元醇途径;6)酮体和苏氨酸代谢;7)脂质过氧化(丙酮醇途径)。
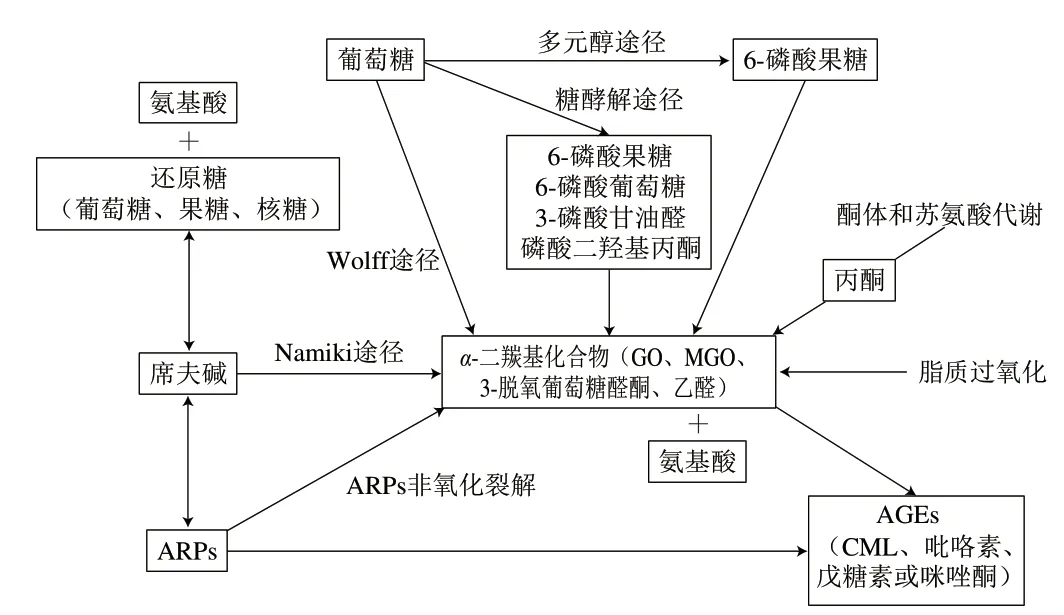
图 2 AGEs的形成途径[14]Fig. 2 Generation pathways of AGEs[14]
内源性AGEs和外源性AGEs均以美拉德反应为主要形成途径,主要包括以下3 个步骤。首先,还原糖的羰基与氨基酸发生非酶褐变,生成一种不稳定的产物,称为席夫碱[15],这一步反应的方向取决于葡萄糖浓度,当反应过程中葡萄糖浓度降低时,该反应变为可逆反应[24]。 席夫碱有两个反应途径,它可以水解生成糖和氨基酸,也可以经过环化反应和进一步的Amadori重排形成更稳定的化合物,称为ARPs[25],在生理和非氧化条件下,90%的ARPs能与反应中的起始底物还原糖和氨基酸发生可逆反应[14]。最后,ARPs可以通过氧化型或非氧化型裂解两种不同的方式来产生AGEs。ARPs通过氧化型裂解所产生的中间体在自氧化和进一步重排后会生成AGEs,以这种形式产生的AGEs主要是CML。CML正是目前AGEs研究的主要标志物,可通过ARPs非氧化裂解、Namiki途径、Wolff途径和丙酮醇途径等途径生成[26-27]。ARPs通过非氧化裂解产生3-脱氧葡萄糖醛酮(3-deoxyglucosane,3-DG),它可与氨基酸发生反应并形成CML或一些AGEs交联物,如吡咯素、戊糖素或咪唑酮[28-29]。除了美拉德反应直接生成AGEs,乙醛、3-DG、GO和MGO等二羰基化合物作为中间体也可以进一步生成AGEs[30]。
此外,二羰基化合物也可以通过葡萄糖自氧化、糖酵解途径、多元醇途径、酮体和苏氨酸的代谢以及脂质过氧化等途径来生成,最终生成AGEs[31]。其中,席夫碱可以通过Namiki途径来生成α-二羰基化合物,而葡萄糖在金属离子的催化下通过Wolff途径也能生成α-二羰基化合物。此外,糖酵解中间体(如6-磷酸果糖、6-磷酸葡萄糖、3-磷酸甘油醛和磷酸二羟基丙酮)、多元醇途径中间产物(如6-磷酸果糖)、酮体和苏氨酸代谢的中间产物(如丙酮)和脂质过氧化的反应产物(如MGO)等代谢产物也参与了α-二羰基化合物的生成[32-33]。
各形成途径也存在一定的相关性,如脂质过氧化反应与美拉德反应,其生成的产物可以影响另一个反应的进程[34]。美拉德反应产物会抑制脂质过氧化反应的进行,但由于脂质过氧化与美拉德反应有共同的中间产物和中间反应途径,其在一定程度上可以促进美拉德反应[35]。 韩立鹏[36]通过建立赖氨酸+GO模拟体系,发现脂质过氧化反应可以促进Wolff途径和Namiki途径的发生,使两条途径中产生的GO向CML转化。马月等[37]通过测定蛋白棒在贮藏过程中色差、还原糖含量、过氧化值等变化,发现美拉德反应对脂质过氧化存在明显的抑制作用。
3 AGEs的致病途径
通常而言,AGEs的生物学效应由两种不同的途径产生:一种途径独立于受体,由AGEs直接诱导体内蛋白质的 结构变化或交联作用而产生;另一种由AGEs与糖基化终产物受体或细胞表面受体相互结合而产生。根据目前的研究,AGEs诱导疾病的途径(图3[38])主要有:1)细胞内蛋白质的结构变化;2)与细胞表面受体的结合;3)警报蛋白信号的诱导;4)内质网应激;5)细胞外基质(extracellular matrix,ECM)的修饰。
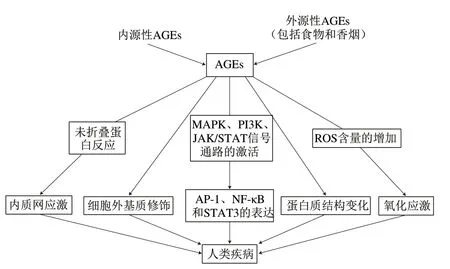
图 3 AGEs的致病途径[38]Fig. 3 Pathogenical pathways of AGEs[38]
AGEs可以直接诱导细胞内的蛋白质结构变化,即由α-螺旋转变为β-折叠结构,从而损害细胞功能[39]。其主要通过氧化磷酸化和脂肪酸氧化这两个途径来修饰蛋白质,最终引起一系列疾病的发生,包括癌症、炎症和自身免疫性疾病,如肝纤维化、肝硬化、胃癌、大肠癌和肝癌等[40-41]。胶原蛋白是一种半衰期较长的蛋白质,在体内极易发生糖基化,这种蛋白质的修饰可能在糖尿病并发症中发挥主要作用[42]。
AGEs也可以通过与细胞受体的结合来引发一系列疾病,目前已鉴定出来的AGEs受体有AGE-R1、AGE-R2、AGE-R3、清道夫受体ScR-II、清道夫受体CD-36和晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE),其中RAGE是AGEs最为常见的特异性受体[43]。当AGEs与RAGE结合后,一些细胞内的信号通路将会被激活,包括烟酰胺腺嘌呤二核苷酸磷酸氧化酶、MAPK、PI3K和JAK/STAT信号通路,而它们将会诱导与应激和炎症相关的转录因子AP-1、NF-κB和STAT3的表达,并进一步调节单核细胞趋化蛋白-1、血管内皮生长因子、血管细胞黏附分子、内皮素-1、E-选择素、金属蛋白酶和炎性细胞因子的基因表达,最终导致炎症、氧化应激甚至衰老、慢性疾病和癌症的发生[14,44]。
与AGEs的多种受体相对应,RAGE也具有多种配体,包括高迁移率族蛋白B1(high mobility group box 1,HMGB1)、巨噬细胞1抗原、S-100蛋白、β-淀粉样蛋白、β-片状纤维和脂多糖[41]。其中,HMGB1是所有经历非程序性死亡细胞释放出的一种关键警报蛋白,它可以与RAGE结合,从而促进树突状细胞的成熟并诱导免疫应答,但AGEs/RAGE信号轴会抑制激活T细胞和树突状细胞向淋巴结迁移来应对抗原警报信号的传导,从而诱导与炎症相关的过敏反应[45]。曾真等[46]研究发现,AGEs通过与RAGE的结合可以促进人卵巢颗粒细胞分泌HMGB1,从而引起慢性炎症状态并促进颗粒细胞的凋亡。
AGEs也可以通过激活内质网应激途径来诱导细胞的凋亡。内质网是参与蛋白合成和折叠、钙稳态调节以及脂质合成的重要细胞器。大量未折叠蛋白或错误折叠蛋白的堆积将导致内质网应激的发生,而内质网应激是一种在没有线粒体参与的情况下诱发细胞凋亡的替代机制。AGEs可经由RAGE介导激活氧化应激反应并进一步启动内质网应激[47],其中错误折叠和未折叠蛋白的聚集将会破坏内质网内Ca2+的动态平衡。虽然内质网具有一定调节稳态的功能,但是长期的内质网应激会导致一系列疾病的发生,包括胰岛素抵抗、异位脂肪沉积、炎症、细胞凋亡和自噬失调等[48]。
AGEs也可以通过与ECM分子之间形成交联,导致各种疾病的发生[43]。ECM是由动物细胞合成的存在于细胞外的一些多糖、蛋白质或蛋白聚糖等物质。弹性蛋白、胶原蛋白和层黏连蛋白等长寿命结构蛋白可以作为AGEs的靶点与AGEs相结合,从而使ECM的硬度增加和弹性降低,最终导致动脉粥样硬化和肾小球硬化等疾病的发生[49]。
4 植物提取物对AGEs的抑制机理及具有抑制作用的 常见植物提取物
4.1 植物提取物对AGEs抑制机理
AGEs抑制剂主要分为合成和天然两大类。合成抑制剂如氨基胍、奎宁、噻唑烷二酮类和二甲双胍等,其虽有抑制AGEs的作用,但这些物质仍存在许多副作用和安全隐患,如导致肝功能减弱、贫血、呕吐、胃肠道疾病、腹泻、头晕、头痛流感和狼疮样症状以及与抗中性粒细胞胞质抗体相关的血管炎[50]。植物提取物属于天然抑制剂,现已被证实具有抑制AGEs的作用,且具有比合成抑制剂更强的抑制能力,将是合成抑制剂的最佳替代品。
由于植物提取物结构和功能的多样性,加之其发挥生物学效应的阶段也不尽相同,因此,植物提取物对AGEs的抑制机理较复杂,尚未明确。但是,目前关于植物提取物对AGEs的潜在抑制作用方式及潜在作用位点[51](图4)主要包括以下几种:1)竞争性结合蛋白质;2)金属螯合;3)清除活性氧(reactive oxygen species,ROS);4)捕获二羰基化合物;5)降低血糖水平; 6)改善胰岛素抵抗;7)降血脂;8)醛糖还原酶抑制剂;9)减少AGEs交联;10)抑制RAGE表达;11)保护乙二醛酶解毒系统。
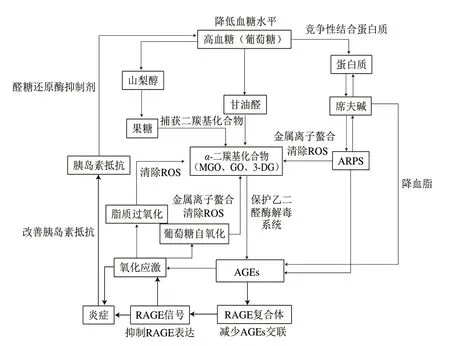
图 4 植物提取物抑制AGEs的潜在位点[51]Fig. 4 Potential inhibition of AGEs by plant extracts[51]
目前研究表明,植物提取物在体内体外对于AGEs均具有一定的抑制作用,其中对于植物提取物的体外抑制途径主要是基于美拉德反应和自身抗氧化能力[15]。植物提取物可以通过竞争性结合蛋白质、捕获羰基化合物、金属离子螯合和清除ROS等重要途径来抑制AGEs的形成。植物提取物,特别是儿茶素、槲皮素、芦丁等多酚类化合物,可以通过与羰基化合物结合来抑制AGEs的生成,其中捕获MGO的主要活性位点是A环的4号位和6号位[52]。另外,植物提取物可依靠自身的羧基或羟基与金属离子发生螯合作用,从而抑制Wolff途径;也可利用自身的抗氧化活性,主要是利用结构中的羟基来作为氢供体,从而有效清除ROS,最终抑制AGEs的形成[53]。
除了糖基化外,植物提取物对脂质过氧化反应也具有一定的抑制作用。脂质过氧化是由氢原子的去除或氧自由基的加入而引起的连锁反应,能够使多不饱和脂肪酸发生氧化反应[54]。植物提取物主要借助其侧链上的烯羟基来发挥抗脂质过氧化作用,烯羟基通过向过氧自由基提供H+来生成更稳定的自由基,从而抑制脂质过氧化过程中的链断裂,最终抑制AGEs的产生[55-56]。
降低人体的血糖和血脂水平也是限制AGEs形成和积累的重要途径。植物提取物主要通过提升胰岛素活性、保护胰岛β细胞和抑制α-葡萄糖苷酶活性来降低血糖水平。胰岛素是人体内关键的葡萄糖调节激素,植物提取物可通过促进蛋白激酶B的磷酸化和减弱游离脂肪酸诱导的胰岛素信号抑制剂来提升胰岛素活性[57]。由于胰岛β细胞分泌胰岛素,该细胞出现任何损伤都会导致胰岛素分泌不足,从而导致血液中葡萄糖的积累,故可以利用 植物提取物通过减少脂质过氧化、增加胰岛素分泌和支持抗氧化防御系统等途径来保护胰岛β细胞,并有助于改善胰岛素抵抗[58-59]。α-淀粉酶或α-葡萄糖苷酶可以将多糖分解为葡萄糖,从而提高血液中的葡萄糖水平,最终导致AGEs含量的增加。植物提取物主要是通过范德华力和氢键与α-葡萄糖苷酶结合,占据了α-葡萄糖苷酶的活性中心,使其构象发生变化,最终抑制该酶的活性[60-61]。此外,植物提取物降低血脂的作用主要是通过上调解偶联蛋白-2和激素敏感性脂肪酶以及下调核因子-纤溶酶原激活物抑制物-1来介导的[60]。
醛糖还原酶是多元醇途径中的一种关键酶,在多元醇途径中,葡萄糖转化为果糖,而果糖更容易被转化为α-二羰基化合物或AGEs;因此,抑制多元醇途径也是减少AGEs形成的潜在方式。羧基是植物提取物中抑制醛糖还原酶活性的必需官能团,一方面其通过离子键与辅酶上带正电荷的烟酰胺环相互作用;另一方面其通过自身氢键与酶侧链上的残基相互作用,从而达到抑制醛糖还原酶活性,进而抑制AGEs生成的作用62]。
由于AGEs易与RAGE结合从而引发各种疾病,故通过植物提取物来阻断AGEs与RAGE的结合和表达也是一种有效途径,可以通过激活过氧化物酶体增殖物激活受体γ活性来抑制RAGE的表达、激活去乙酰化酶来抑制RAGE的转录,以及直接与RAGE结合从而阻断其与配体的相互作用等方法来实现[63]。其中过氧化物酶体增殖物激活受体γ/血红素氧合酶-1信号通路的激活能够抑制HMGB1/RAGE通路,从而抑制RAGE的表达和炎症反应[64]。而去乙酰化酶能够通过去乙酰化NF-κ亚单位RelA/p65中的赖氨酸310来抑制NF-κB信号通路,从而抑制RAGE基因的转录[65]。其中,AGE-RAGE信号转导的最终结果主要是氧化应激的产生[66],而植物提取物可以通过参与Kelch样环氧氯丙烷相关蛋白1-核因子E2相关因子2-抗氧化反应元件(Kelch-like ECH-associated protein 1-nuclear factor erythroid 2 related factor 2-antioxidant response element,Keap1-Nrf2-ARE)、PI3K/蛋白激酶B (protein kinase B,AKT)、Wnt/β-连环蛋白通路和NF-κB等多种信号通路来发挥其抗氧化应激作用[67],进而抑制机体自身的细胞损伤和稳态破坏,从而抑制氧化应激所导致的疾病(如糖尿病及其并发症、动脉粥样硬化和癌症)。
乙二醛酶系统是一种代谢途径,存在于所有哺乳动物细胞和大多数微生物的细胞质中,是由乙二醛酶I和乙二醛酶II,以及还原型谷胱甘肽作为辅助因子组成,可催化α-氧化醛转变为相应的α-醇酸;因此,它可以保护细胞免受AGEs的损害[68]。乙二醛酶I能够将MGO与谷胱甘肽一起催化成D-乳酰谷胱甘肽,并在乙二醛酶II的作用下转化为无毒的D-乳酸盐排出体外[69]。植物提取物尤其是 多酚类植物提取物可以通过其自身的抗氧化作用从而对乙二醛酶系统具有一定的保护功效,能够使乙二醛酶在辐射条件下保持良好的活性[63,70]。
4.2 常见具有抑制AGEs作用的植物提取物
4.2.1 生物碱类植物提取物
生物碱可以通过抑制肠道对碳水化合物的吸收、抑制糖异生作用、促进细胞对葡萄糖的摄取、刺激胰岛素分泌和防止氧化损伤等途径而表现出抗糖化活性[71]。Selvaraj等[72]发现生物碱能够结合过氧化物酶体增殖物激活受体γ、蛋白酪氨酸磷酸酶和胰岛素受体,并通过抑制糖异生作用,激活胰高血糖素样肽和改善胰岛素信号传导通路发挥血糖调节作用。周琦[73]发现小檗碱属三颗针甲醇提取物可以明显增加腺苷酸活化蛋白激酶的活性,提高磷酸腺苷酸活化蛋白激酶的表达水平,从而促进胰岛素降低血糖,最终达到抑制AGEs的作用。
4.2.2 皂苷类植物提取物
皂苷类植物提取物主要有降血糖的作用,能够通过修正胰岛素信号的传导、促进胰岛β细胞分泌胰岛素、激活糖原合成、抑制糖异生作用和α-葡萄糖苷酶活性等途径来降血糖,进而减少体内AGEs的生成[74]。Jin Zhaohui等[75]发现三七总皂苷可以降低糖尿病兔子体内的果糖胺、糖化血清蛋白和糖化血红蛋白等糖基化产物的含量,从而阻止它们经过分子重排和交联进一步产生AGEs。 Motomura等[76]发现黄芪皂苷可以通过与葡萄糖直接作用来抑制AGEs产生,而不同结构的黄芪皂苷及其与葡萄糖的不同结合位点会影响对CML和戊糖苷的抑制效果。
4.2.3 多酚类植物提取物
多酚类提取物具有一定的抗糖化活性,主要通过清除ROS、捕获二羰基化合物、激活体内抗氧化剂和破坏蛋白质的交联而达到抑制ACEs的目的[51]。Harris等[77]采用荧光法和免疫组织化学法分别检测了17 种黄酮类植物提取物,发现所有提取物都能降低AGEs的生成量,但抑制程度不同,其中大多数提取物抑制AGEs形成的半抑制浓度在0.4~38.6 μg/mL 之间。Justino等[78]发现酚酸类化合物可以通过捕获前体(如1,2-二羰基)或与葡萄糖竞争性结合而抑制AGEs的形成。孙涛等[79]发现竹叶黄酮可以与糖基化反应产生的自由基结合,从而抑制糖基化的反应进程,最终抑制dAGEs的产生。Grzegorczyk-Karolak等[80]发现黄芩和高山黄芩提取物在体外可以通过抑制白蛋白糖基化反应来减少AGEs的生成。
4.2.4 维生素类植物提取物
维生素类植物提取物主要是通过抑制AGEs信号传导、清除ROS、降血脂和提升胰岛素的活性等途径来抑制AGEs的生成和表达[81]。Ali等[82]发现番茄红素对于糖基化进程的抑制作用主要依赖于其抗氧化作用,表现为 抑制氧化应激反应和葡萄糖自氧化反应。郑智楷[83]发现吡哆胺可能通过清除ROS、捕获二羰基化合物和抑制ARPs的进一步反应等途径来抑制人体内AGEs的生成。
4.2.5 多糖类植物提取物
多糖、皂苷和多酚类植物提取物均具有降血糖、增加肝糖原含量、抑制α-葡萄糖苷酶活性以及改善胰岛素抵抗的作用,此外,多糖类植物提取物还可以通过延缓葡萄糖吸收等途径来调节血糖水平[84]。张丽梅[85]通过对实验小鼠血清的分析,发现紫山药多糖具有阻止非酶糖基化反应的功效,减少小鼠体内AGEs的含量,进而保护小鼠机体器官不受损伤。Rout等[86]发现石榴多糖对糖基化反应的抑制不仅是由于其清除自由基的特性,还由于其参与了美拉德反应中氨基或羰基的修饰,从而抑制了果糖胺的生成。
4.2.6 其他类植物提取物
Grassmann等[87]发现萜类化合物如二萜类、三萜类化合物都具有抑制醛糖还原酶活性的功能,从而能够抑制AGEs的生成。Joglekar等[88]发现4-异丙基甲苯比氨基胍抑制戊糖素的效果更好,其主要是通过稳定蛋白质的结构从而阻止糖基化反应,进而导致果胺糖或羰基化合物的含量降低。康世墨[89]发现芦荟中的蒽醌类植物提取物对于AGEs的抑制作用主要依靠其自身的抗氧化活性和酚羟基结构。Liu Weixi等[90]发现蒽醌类植物提取物也可以通过维持蛋白质结构来抑制MGO和GO诱导血清蛋白的糖基化反应。
5 结 语
综上所述,外源AGEs的摄入和内源AGEs的生成容易促使细胞中的AGEs超越其临界水平,并通过促进蛋白质的糖基化、与RAGE的结合和诱导氧化应激反应等多种途径导致疾病的发生。AGEs抑制剂,尤其是植物提取物,可通过清除自由基、螯合金属离子、降血糖血脂等途径来抑制体内或体外产生的AGEs。因此,植物提取物具有作为食品添加剂或治疗疾病的新型药物的潜力。若利用天然植物提取物来进行一系列药物研究,则必须掌握其具体的作用机理,而目前植物提取物抑制AGEs的作用机理尚不明确。因此,为了减少人体内的AGEs含量并最终降低AGEs诱导的相关疾病的发生率,今后的研究可围绕外源性和内源性AGEs两方面展开:在外源性AGEs方面,可以通过酶联免疫吸附法和色谱法等诸多检测方法来估算常见食品中的AGEs的含量,研究食品组分和加工条件对AGEs生成动力学、生成路径的影响,并进一步研究外源性AGEs的生物可利用度和其在体内的代谢途径,同时研究植物提取物在食品中的抑制机理;在内源性AGEs方面,可以进一步研究不同AGEs在体内的 吸收、循环和致病机理,并通过进一步分析植物提取物的结构和进行临床实验,来研究植物提取物在人体内抑制AGEs的机理,以期将植物提取物更好地应用于食品和药物领域。

