茄子菌核病病原菌鉴定及抗性种质资源筛选
李韦柳 吴永官 甘桂云 蒋雅琴 玉 宁 李文嘉 黎 炎 康德贤 王益奎
(广西农业科学院蔬菜研究所,广西蔬菜育种与新技术研究重点实验室,广西南宁 530007)
近年来随着茄子生产的规模化和设施化,菌核病危害呈逐年加重趋势,在广西,每年4—8 月是菌核病发生较重的时期,造成的茄子产量损失达10%~35%,严重地块减产达60%(莫贱友 等,2011)。目前对菌核病的防治以施用化学杀菌剂为主,但该方法成本高、易造成环境污染,且因长期大量使用化学药剂,易产生耐药菌株,导致一些传统药剂(如多菌灵)防治效果不理想(乔昕 等,2016),培育抗病品种是防治菌核病最安全、有效的措施之一,因此,通过抗性鉴定挖掘抗性资源显得尤为重要。目前,对菌核病抗性种质的鉴定研究多见于大豆(王金生 等,2009;董利东 等,2014)、油菜(冉毅 等,2007;刘玲彦,2013;马田田 等,2014;何烈干 等,2018)、花椰菜(孙溶溶 等,2011)以及烟草(高崇 等,2018)等作物上,并获得了相应的抗性资源作为转育材料或直接应用于生产(Ding et al.,2015),而茄子资源抗性鉴定研究鲜见报道。
茄子菌核病是由子囊菌门盘菌纲核盘菌属的核盘菌〔Sclerotinia sclerotiorum(Lib.)de Bary〕引起的一种真菌病害,又称白霉病、软腐病、茎腐病等(钟仕田,1987)。核盘菌是最具破坏性的土壤真菌病原体之一,寄主植物广泛,可侵染多达75 个科600 多种植物种类(Boland &Hall,1994;Liang &Rollins,2018)。研究表明,核盘菌在茄子整个生育期都能侵染危害,苗期主要发病部位在茎基部,初呈水渍状浅褐色斑,后变棕褐色,使病苗呈立枯状死亡,成株期茎、枝、花、果、叶均能受害,大多数从植株茎部距地面5~30 cm 的主茎或侧枝处开始发病再上下扩展(钟仕田,1987;莫贱友 等,2011)。核盘菌的菌核可萌发温度为10~30 ℃,温度高于20 ℃有利于菌丝型萌发,菌丝生长最适温度为20~25 ℃(李丽丽 等,1986;Huang &Kokko,1989;孙敬贤和张鲁刚,2015;母红岩 等,2017),广西6—8 月的最低气温普遍高于25 ℃,茄子菌核病的发生较为普遍。不同核盘菌小种在不同寄主上的致病性和病症不尽相同(Choudhary &Prasad,2012;Nahar et al.,2019),明确病原菌种类是开展科学防控的基础。本试验对广西高温高湿条件下发生的茄子菌核病采用形态学、分子生物学方法进行病原菌种类鉴定,并采用田间接种鉴定方法对茄子资源进行抗性筛选,为菌核病的科学防控及抗病育种提供理论依据。
1 材料与方法
1.1 供试材料
参试茄子种质材料共42 份,5 种类别,其中高级栽培茄25 份、初级栽培茄(Meyer et al.,2012)5 份、红茄6 份、野生茄3 份,远缘杂种3 份,均由广西农业科学院蔬菜研究所提供。各种质形态特点如表1 所示。
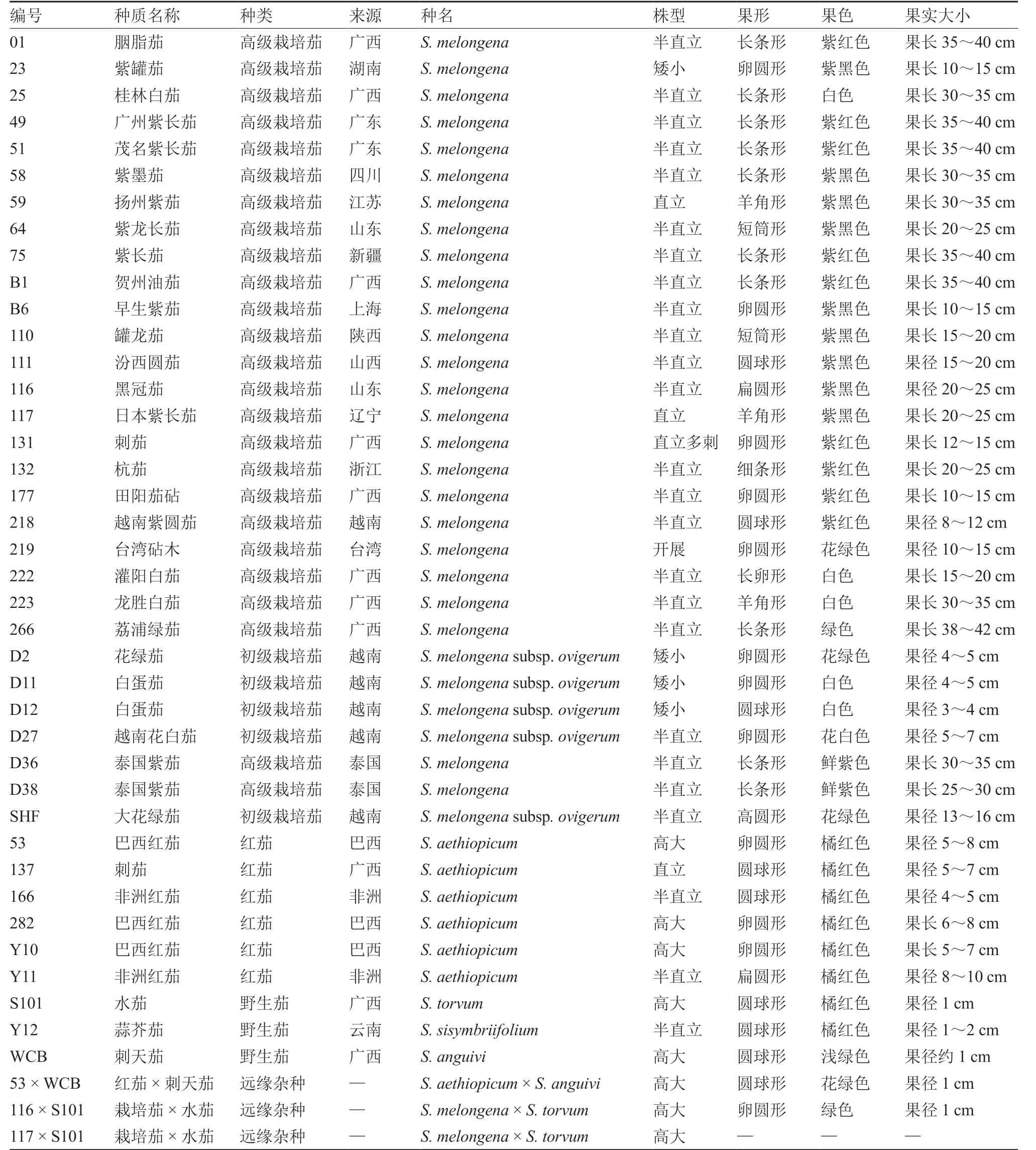
表1 参试茄子种质形态特点
1.2 方法
1.2.1 病样采集与病原菌的分离 在南宁市良庆区那马镇茄子发病地块采集发病枝条,干燥密封带回实验室进行分离。用75%乙醇擦拭感病枝条表面,0.1%的升汞浸泡消毒1 min 后无菌水冲洗3 遍,无菌纸吸干表面水分,用无菌镊子取韧皮部下方的发病组织,接种于PDA 平板培养基上,于20 ℃黑暗条件下培养3~4 d。当白色菌丝出现后进行镜检,确定病原后将菌丝挑出转接于PDA 平板培养基上,25 ℃下暗培养3~4 d,反复镜检与转接直至培养基上病菌纯化,用打孔器取培养基外圈制成直径约7 mm 的菌碟,贴在茄子创伤茎部保湿固定进行致病性测定,显症后再次分离鉴定该病原菌与上轮分离有无差别。完成柯赫氏法则验证后,将菌株命名为ESR001 并低温保存备用。
1.2.2 病原菌rDNA-ITS 序列测定 参考周增强等(2012)的方法,采用简化CTAB 法提取基因组DNA,利用真菌生物核糖体DNA 通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR检测,并将目标DNA 片段送至广州擎科新业生物技术有限公司进行测序,测序结果在NCBI 上进行序列比对分析,确定该病原菌的分类地位。
1.2.3 茄子菌核病的田间接种鉴定 参考韩广振等(2010)的方法对本试验中茄子菌核病田间接种鉴定方法进行改进,茄子9 月播种,待幼苗长至四叶一心时移栽至大棚内,进入开花期时采用菌丝体进行田间活体茎接种。用刀片轻刮茄子茎部表皮制造长约0.5 cm 的伤口,用打孔器沿着菌落的外围打孔制成直径0.5 cm 的菌碟,将菌碟长有菌丝的一面贴于植株茎部刮破处,用脱脂棉浸无菌水包在菌碟的外面保湿,最外层用5 cm × 3 cm 的锡箔纸捆绑固定。每个品种接菌10 株,3 次重复,对照10 株(对照使用无菌PDA 培养基,其余与接菌处理相同),接种后喷雾保湿48 h,之后常规管理,每天喷洒无菌水1 次,保持湿润。每天观察病斑变化,并于接种病菌20 d 后,依据病情分级标准调查病情指数(disease severity index,DSI)进行抗性归类。
1.2.4 茄子菌核病病级评价标准 参考韩广振等(2010)对大豆菌核病的病级评价标准,根据菌丝体侵染茄子植株直径的比例,将茄子菌核病发病级别分为0~5 个等级,评价标准参见表2 和图1。茄子菌核病病情指数计算公式为:DSI=〔∑(各病级值×该病级株数)/(5 ×调查总株数)〕× 100。按照菌核病病情指数的大小,将抗性水平分为6 级:免疫(I)(病情指数=0,无侵染),高抗(HR)(0 <病情指数≤20),抗病(R)(20 <病情指数≤35),中抗(MR)(35 <病情指数≤50),感病(S)(50 <病情指数≤70),高感(HS)(70 <病情指数≤100)。

表2 茄子菌核病病情分级标准
1.3 数据统计分析
数据采用Microsoft Office Excel 2016软件进行计算,利用DPS 软件对试验数据进行统计分析。
2 结果与分析
2.1 病原菌形态鉴定
菌株ESR001 在PDA 平板培养基上25 ℃条件下生长迅速,接种3~4 d 后菌落呈圆形并铺满整个平板,菌丝呈白色棉絮状(图2-A),再培养4~5 d 后,培养基边缘棉絮状菌丝聚集成团,先期白色,后渐变为深褐色,最终变为黑色,同时逐步变干变硬,表面粗糙,形成不规则状的鼠粪状菌核,直径5~10 mm(图2-B)。显微镜下观察菌丝无色、透明、有隔膜(图2-C)。
2.2 病原菌分子鉴定
对菌株ESR001 进行PCR 扩增获得长度为524 bp 的片段,测序得到的ITS 序列在数据库中进行序列分析,该病原菌菌株与已登记的Sclerotinia sclerotiorum真菌rDNA-ITS 序列相似,同源性达99.80%,与Sclerotinia trifoliorum同源性为98.81%,与Sclerotinia glacialis同源性为98.39%。ITS 序列提交至GenBank,登录号为MN099 281.1,使用MEGA 6.0 软件,选择灰葡萄孢菌(Botrytis cinerea)作为外类群,构建系统发育树,结果显示该病原菌与已鉴定为Sclerotinia sclerotiorum的真菌聚类在一起(图3)。经形态学、分子生物学方法鉴定该病原菌为核盘菌〔Sclerotinia sclerotiorum(Lib.)de Bary〕,引起茄子菌核病。
2.3 茄子种质菌核病抗性鉴定
对42 份茄子种质进行田间活体茎接种鉴定,接种10 d 后茄子枝条可见明显病斑,随时间推移病斑继续外扩,接种20 d 后病斑停止扩展,统计病情指数,结果如表3 和表4 所示。不同茄子品种和种质类别的病情指数差异极显著(P<0.01),对菌核病的抗性水平亦不相同,其中,免疫材料6份,占鉴定种质的14.29%,均为茄子野生种及其杂种后代;高抗材料1 份和抗病材料3 份,分别占鉴定种质的2.38%和7.14%,均为红茄;中抗材料4 份,占鉴定种质的9.52%,均为初级栽培茄;感病材料10 份和高感材料18 份,分别占鉴定种质的23.81%和42.86%。

表4 42 份茄子种质的菌核病病情指数方差分析
对不同茄子种质类别的病情指数和抗病水平分析发现(表5),高级栽培茄的平均病情指数高达74.53,显著高于其他种质类别,均为感病或者高感材料;其次为初级栽培茄,平均病情指数为49.07,无抗病或高抗材料,中抗材料4 份(编号D2、D11、D27、SHF),占该鉴定类别种质的80%,其余1 份材料表现为感病;红茄的平均病情指数为36.78,高抗材料1 份(编号53),占该鉴定类别种质的16.67%,抗病材料3 份(编号137、166、Y11),占该鉴定类别种质的50.00%,其余2 份材料表现为感病;野生茄(编号S101、Y12、WCB)病情指数为0,抗病水平达免疫,占该类型种质的100.00%;同时鉴定发现,种间杂种53 × WCB 及以菌核病高感材料116、117 为母本,以免疫材料S101 为父本的远缘杂种116 × S101、117 × S101 的病情指数均为0,对菌核病的抗性水平达到免疫,说明野生种携带的菌核病抗源可通过杂交转育。

表5 茄子种质类别抗性统计分析
3 讨论与结论
本试验中茄子菌核病菌株ESR001 是从广西越夏发病的茄子病株上分离纯化获得的,经形态特征观察初步认定为核盘菌。通过进一步对ITS 序列分析表明此菌株属于核盘菌属,与其他属种存在显著的遗传差异,与Sclerotinia sclerotiorum的同源性达到99.80%,因此可以确定该病原菌为核盘菌〔Sclerotinia sclerotiorum(Lib.)de Bary〕。由于菌核病对不同寄主的致病力和发病症状均有较大差异(Nahar et al.,2019),以及寄主的防御机制也不尽相同(Wang et al.,2019),本试验对广西茄子菌核病病原菌的鉴定将有助于该病原菌致病机理和防御机制研究工作的进一步开展和深入,可为茄子菌核病的防治研究提供依据。
菌核病抗性鉴定在大豆和油菜上有较多报道(冉毅 等,2007;韩广振 等,2010;刘玲彦,2013;马田田 等,2014;孙明明 等,2017;何烈干 等,2018),而国内外还没有统一的茄子菌核病鉴定方法和评价标准,田间或温室接种相关研究鲜见报道。结合茄子的植株特点,参考韩广振等(2010)对大豆菌核病田间活体茎的接种鉴定方法,本试验对茄子菌核病田间接种鉴定方法进行了改进。采用了菌丝体接种方式,且采用了保湿性好的锡箔纸将无菌湿润脱脂棉和菌丝体紧密包裹固定在植株伤口处,保证了每个接种体侵染环境的相对一致,且每日喷洒无菌水,保持潮湿环境有利于菌丝体生长和侵染。该方法能较好地区分不同材料之间的抗性水平,可作为茄子菌核病抗性的有效鉴定方法。菌核病菌菌丝体的生长和侵染能力受环境温度和湿度的影响较大(母红岩,2017),因此可通过多年多点的重复接种鉴定或利用人工气候室控制环境温湿度提高鉴定的准确性。目前我国茄子栽培品种中抗病、高抗菌核病的材料甚少,也没有明确的对照种质,因此还需要在茄子菌核病的鉴定方面进行深入研究。
核盘菌寄主范围广泛,传播途径及致病机理复杂(Melo et al.,2019),茄子抗病遗传资源缺乏,导致茄子菌核病的研究进展缓慢。茄属物种丰富,在东南亚、非洲、南美以及我国南方均有茄属野生种 分 布(Tepe &Bohs,2011;Stern et al.,2013;Ranil et al.,2017;Aubriot et al.,2018),在自然选择中形成与保留了许多栽培茄所不具备或人工选择过程中已丧失的抗性基因,前人研究表明茄子野生种具有丰富的青枯病(刘富中 等,2005;李兆龙 等,2015)、黄萎病(王益奎 等,2011;马艳,2016;吴丽艳 等,2017)等抗病基因资源,特别是水茄(S.torvum),已被研究证明是复合多个优良基因的野生材料(王洋 等,2020),而尚未见有抗菌核病的相关报道。本试验对42 份茄子种质资源的菌核病抗性鉴定统计结果显示,国内收集的栽培茄中没有抗菌核病材料,而茄子野生种(S.aethiopicum、S.torvum、S.sisymbriifolium、S.anguivi)具有菌核病抗源,东南亚收集的栽培茄中初级栽培茄(S.melongenasubsp.ovigerum)的菌核病抗性强于高级栽培茄,下一步可扩大该类资源的鉴定规模,以期筛选出亲缘关系更接近国内栽培种的高抗资源。栽培茄与茄属野生种杂交可以拓宽茄子遗传基础,同时也是转育优良基因的有效手段(曹必好 等,2009),茄子远缘杂交存在生殖障碍,栽培茄(S.melongena)与野生种S.torvum的杂交表现为F1不育,且父母本花粉与杂交后代F1柱头不亲和(王益奎 等,2015),而刺天茄(S.anguivi)作为菌核病另一抗源材料可与红茄(S.aethiopicum)杂交并产生对菌核病表现免疫的可育后代,有研究表明非洲红茄(S.aethiopicum)与栽培茄的种间杂种可通过利用母本持续回交逐渐恢复育性(庄勇和王述彬,2011)。因此,可利用高抗红茄作为育种桥梁,将野生种的抗病性导入到栽培茄中,得到抗病性好、商品性优良的茄子品种。这为野生资源有利基因的转育利用提供了可能途径,可为防治茄子菌核病和抗病种质的选育提供参考。

