人参皂苷Rb1对系统性红斑狼疮患者外周血T淋巴细胞体外活化的影响
杨 帆,沈俊逸,蔡 辉
0 引言
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种以自身抗体病理性增多和非特异性系统器官损伤为特征的慢性免疫性疾病[1],此外,其与基因、环境、内分泌紊乱、表观遗传等因素也密切相关[2]。虽然病因复杂,但是众多研究证实,免疫耐受缺失及免疫稳态失衡是SLE最重要的发病基础,包括T细胞增殖和分化功能缺陷、病理性T细胞大量聚集、T细胞自身凋亡增加等[3],因此,深入探索SLE患者T细胞异常活化的分子免疫机制,对于临床疗效的判断和靶向生物制剂的开发都具有重要的研究价值。中药复方或单体成分在免疫性疾病领域的作用越来越受到医学界的普遍关注[4]。人参皂苷因具有甾环样结构、类糖皮质激素样作用、免疫调节功能等,是众多治疗SLE中药组方中的重要成分之一[5]。人参皂苷Rb1是临床上常用的免疫佐剂[6-7],但是否能用于SLE的治疗尚不明确。本研究拟通过体外实验,探讨人参皂苷Rb1对SLE患者外周血T淋巴细胞体外活化、增殖、凋亡的影响。
1 材料与方法
1.1 对象选择 选择2019年1-12月在东部战区总医院首次确诊的SLE门诊或住院患者30例,所有患者均为女性,年龄27~65岁,平均年龄(48.10±10.90)岁;病程3~53个月,中位病程21.0个月。本研究血液标本的采集符合伦理学要求,并获得受试者的知情同意。纳入标准:符合美国风湿病协会1997年推荐的SLE诊断标准[8];SLE疾病活动指数(Systemic lupus erythematosus disease activity index,SLEDAI)<10分者[9]。排除标准:合并其他自身免疫系统疾病、结缔组织疾病或严重感染性疾病者。另外,收集同时期30例健康女性志愿者捐献的外周血样本,年龄25~60岁,平均年龄(45.63±12.12)岁。SLE患者和健康志愿者年龄比较,差异无统计学意义(P>0.05)。
1.2 主要试剂和仪器 人参皂苷Rb1(纯度>98% HPLC,规格:20 mg,天津马克生物有限公司),用DMSO制备成1 mg/ml储备液,分装冻存于-20 ℃,用前6 h稀释至所需浓度(DMSP最终浓度<1%)。人外周血淋巴细胞分离液(Ficoll-Hypaque Solution),美国Sigma-Aldrich公司;RPMI1640培养基和胎牛血清,美国Hyclone公司。刀豆球蛋白A(ConcanavalinA,ConA),美国Sigma公司;3H标记胸腺嘧啶核苷(3H-TdR,比活性:2~10 mCi/mg,美国Molecular Probes公司),将1 mCi/ml溶液以生理盐水稀释成100 μCi/ml,于4 ℃保存备用。临用前用培养液稀释至所需浓度。鼠抗人CD3-FITC、鼠抗人CD4-PerCP-Cyanine5.5、鼠抗人CD8-PE、鼠抗人FITC-CD69、鼠抗人CD25-FITC、鼠抗人PE-Foxp3,美国BD公司;白细胞介素4(Interleukin4,IL-4)ELISA试剂盒和干扰素-γ(Interferon-γ,IFN-γ)ELISA试剂盒,武汉艾美捷科技有限公司。DPM-7001型液体闪烁计数器,法国SDEC公司;流式细胞仪(FACS Calibur),美国Becton-Dickinson公司。
1.3 实验方法
1.3.1 外周血T淋巴细胞的分离 采集入组受试者外周静脉血15 ml,置于肝素抗凝管中,加入等体积PBS稀释,采用FICOLL密度梯度离心法分离人外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)。2 000 r/min离心30 min,用毛细血管轻轻吸取中间层白色絮状物(PBMCs比重约为1.075~1.090),置于另一离心管中,用PBS洗涤2次,磁珠分选缓冲液重悬,得到PBMCs(>95%)。
1.3.2 CD3+T淋巴细胞的分选 取上述PBMCs悬液,采用免疫磁珠法分选CD3+T淋巴细胞。用含有10%胎牛血清的RPMI1640完全培养液(2 mmol/L谷氨酰胺+10 mg/L非必需氨基酸+1 mmol/L丙酮酸盐+100 U/ml青霉素和100 μg/ml链霉素+5 μg/ml植物血凝素)重悬,得到CD3+T淋巴细胞悬液(>95%)。
1.3.3 实验分组 根据体细胞来源分为2组:健康对照(control)组和SLE组,每组进一步分为空白组、ConA组,ConA+Rb1组。空白组:将T淋巴细胞按1×105/孔接种至96孔板中后,未经任何药物处理;ConA组:将T淋巴细胞按1×105/孔接种至96孔板中后,加入10 μg/ml ConA刺激72 h;ConA+Rb1组:将T淋巴细胞按1×105/孔接种至96孔板中后,加入10 μg/ml ConA刺激72 h,同时加入Rb1干预。
1.3.43H-TdR渗入法检测T淋巴细胞增殖活性 取上述纯化的T淋巴细胞,设为空白组、ConA组,ConA+各浓度人参皂苷Rb1(2.5、5、10、20 μmol/L)组。加入不同药物干预72 h后,每孔加入0.5 μCi3H-TdR,继续培养12 h。收集细胞至玻璃纤维滤纸上,烘干后用液体闪烁计数器进行检测。细胞增殖率(%)=(ConA组-空白组)/空白组×100%;细胞增殖抑制率(%)=(ConA组-ConA+Rb1组)/ConA组×100%。
1.3.5 流式细胞术检测T淋巴细胞早期活化抗原CD69表达水平 T淋巴细胞分组和处理方式同“1.3.3”,人参皂苷Rb1作用浓度为10 μmol/L,收集细胞约1×107个。PBS离心(1 000 r/min,4 ℃,5 min)洗涤,加入CD4-PerCP-Cyanine5.5、CD8-PE、FITC-CD69,混匀后室温避光染色30 min,上机检测。
1.3.6 流式细胞术检测T淋巴细胞分化水平 T淋巴细胞分组和处理方式同“1.3.3”,人参皂苷Rb1作用浓度为10 μmol/L,收集细胞约1×107个,处理方式同“1.3.5”。加入CD4-PerCP-Cyanine 5.5、CD25-FITC,4 ℃孵育30 min,4%甲醛固定20 min,破膜处理,加入PE-Foxp3,混匀后室温避光染色30 min,上机检测。
1.3.7 ELISA法检测细胞培养上清中IL-4和IFN-γ水平 取上述纯化的T淋巴细胞,设为空白对照组(未加药物处理)、各浓度人参皂苷Rb1(2.5、5、10、20 μmol/L)组,培养48 h。采用ELISA法检测细胞培养上清中IL-4和IFN-γ水平。
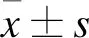
2 结果
2.1 人外周血CD3+T淋巴细胞分选鉴定 经流式细胞术检测,磁珠分选得到的CD3+T淋巴细胞悬液中CD3+T淋巴细胞比例为98.95%,细胞形态均一,经台盼蓝染色,活细胞>95%。见图1。

图1 经免疫磁珠分选后,CD3+T淋巴细胞含量
2.23H-TdR渗入法检测人参皂苷Rb1对人外周血T淋巴细胞增殖活性的影响 SLE人群空白组外周血T淋巴细胞增殖活性明显高于健康对照人群,差异有统计学意义(P<0.05);ConA可明显刺激SLE人群和健康对照人群外周血T淋巴细胞的增殖活性(增殖率:410.71%±128.59%vs.321.30%±96.54%),差异无统计学意义(P>0.05)。另外,加入Rb1后,对ConA诱导的T淋巴细胞增殖有显著的抑制作用,而且当Rb1浓度为10 μmol/L和20 μmol/L时,抑制作用最为明显,当Rb1浓度为10 μmol/L时,抑制率分别为40.87%±9.82%和53.94%±9.12%,Rb1对SLE人群外周血T淋巴细胞增殖的抑制作用高于健康对照人群,差异有统计学意义(P<0.05)。见图2。

图2 人参皂苷Rb1对人外周血T淋巴细胞增殖活性的影响
2.3 流式细胞术检测人参皂苷Rb1对人外周血T淋巴细胞CD69+表达的影响 采用双抗体染色法,ConA可明显刺激SLE人群和健康对照人群外周血T淋巴细胞早期活化(CD3+CD69+T/CD3+T细胞比例:48.53%±7.26%vs.53.73%±8.45%),差异无统计学意义(P>0.05)。另外,加入10 μmol/L Rb1对ConA诱导的T淋巴细胞早期活化有显著的抑制作用,CD3+CD69+T/CD3+T细胞比例分别为31.28%±5.32%vs.33.64%±5.79%,Rb1对SLE人群和健康对照人群外周血T淋巴细胞早期活化的抑制比较,差异无统计学意义(P>0.05)。见图3。

图3 人参皂苷Rb1对人外周血T淋巴细胞早期活化标志物CD69+表达的影响
2.4 流式细胞术检测人参皂苷Rb1对人外周血T淋巴细胞分化的影响 经10 μmol/L Rb1后,健康对照组和SLE组外周血T淋巴细胞CD4+CD25+T细胞百分比(24.38%±5.45%、16.29%±3.18%)和CD4+CD25+FoxP3+T细胞百分比(32.76%±7.43%、26.35%±5.14%)显著增加,与ConA组比较,差异有统计学意义(P<0.05)。见图4。

图4 人参皂苷Rb1对人外周血T淋巴细胞分化的影响
2.5 人参皂苷Rb1对人外周血T淋巴细胞分泌细胞因子的影响 经10 μmol/L Rb1后,健康对照组和SLE组外周血T淋巴细胞培养上清中IFN-γ水平显著增加,而IL-4水平显著降低,与ConA组比较,差异有统计学意义(P<0.05)。见图5。

图5 人参皂苷Rb1对人外周血T淋巴细胞分泌细胞因子的影响
3 讨论
SLE目前临床治疗以糖皮质激素、免疫抑制剂等作为一线基础用药,常用的免疫抑制剂包括糖皮质激素、环磷酰胺、甲氨蝶呤等传统免疫抑制剂或单克隆抗体、环孢素A、他克莫司等新型免疫抑制剂以抑制T细胞增殖和抗体生成,但是均存在选择性差、毒副作用严重等不足[10],而且单一靶点的治疗药物难以取得全面持久的作用效果。而中医在SLE治疗中具有一定的特色和优势,大大改善了众多SLE患者预后。
2013年,赵伟刚等[11]研究表明,人参皂苷胶囊联合泼尼松治疗SLE疗效显著,SLE疾病活动指数降低值优于单独使用泼尼松组。人参是我国传统的扶正固本、益气生津的名贵中药材,现代药理学机制分析,其皂苷类活性成分具有重要的免疫调节作用。吕梦婕等[12]发现,人参皂苷Rb1可抑制小鼠T淋巴细胞的体外活化及增殖活性,是一种潜在的免疫抑制剂,其作用机制可能与降低细胞内Ca2+水平有关。T淋巴细胞既是体液免疫的核心分子,又是机体自身免疫的上游靶点,其活化-凋亡失衡是介导SLE发病机制的关键环节[13]。因此,针对T淋巴细胞异常研发相关的药物,有望为SLE患者带来治愈希望。
在本研究中,虽然纳入的SLE人群均处于疾病非活动期,并服用不同剂量免疫抑制剂或糖皮质激素治疗,T淋巴细胞的活性受到了一定程度的抑制,但是其外周血T淋巴细胞增殖活性仍然高于健康对照人群。ConA是基础研究中最常使用的一类植物凝集素,通过作用于T淋巴细胞表面TCR/CD3复合体进而刺激T淋巴细胞增殖,而人参皂苷Rb1不仅可抑制ConA刺激的健康对照人群外周血T淋巴细胞增殖活性,同样也可抑制SLE人群外周血T淋巴细胞的增殖活性,而且当Rb1浓度为10 μmol/L时,抑制作用已经十分明显。CD69是T淋巴细胞早期活化标志物,人参皂苷Rb1可抑制健康对照人群和SLE人群CD69表达,说明其可以抑制T淋巴细胞体外活化,干扰T淋巴细胞由静息期向淋巴母细胞的转化,从而抑制其增殖作用以及相关免疫功能。此外,人参皂苷Rb1对SLE人群外周血T淋巴细胞增殖活性的抑制作用略高于健康对照人群,推测可能的原因与SLE患者外周血T淋巴细胞过度活化,包括T细胞膜信号中的免疫突触异常、细胞内钙能增强等因素有关。
此外,调节性T细胞在SLE发病过程中也发挥着重要作用。临床研究证实,SLE患者普遍存在CD4+CD25+T细胞数量减少及功能下降[14-15]。CD4+CD25+T细胞缺失易导致T细胞对自身抗原过度免疫应答,进而对自身组织造成损伤;此外,还可以促进细胞炎症因子INF-γ、TNF-α等大量分泌,进一步加重机体组织损伤。而FoxP3是CD4+CD25+T细胞活化的重要标志分子之一。在本研究中,人参皂苷Rb1可显著促进外周血T淋巴细胞中CD4+CD25+T细胞数量和CD4+CD25+FoxP3+T细胞数量,这可能也是人参皂苷Rb1发挥免疫调节作用,治疗SLE的重要机制之一。由于SLE属于异质性疾病,不同患者存在不同的免疫状态,Talaat等[16]认为,SLE病情活动初期多呈现Th1型活化优势,INF-γ等细胞因子水平显著增加,从而增加自身抗原递呈;但随着疾病进展,SLE患者逐渐偏向Th2型优势,IL-4等细胞因子分泌量逐渐增加。而Dolff等[17]发现,在SLE患者体内,细胞因子的平衡偏向Th1型,尤其在Ⅳ型狼疮肾炎患者中呈现明显Th1优势。Th1/Th2免疫失衡是导致SLE发生、进展的关键机制。在本研究中,纳入的SLE患者已出现典型的临床症状,因此,以Th2型优势为主,但是仍表现为Th1/Th2失衡。本研究结果发现,人参皂苷Rb1可促进INF-γ产生,抑制IL-4的分泌,故而调节Th1/Th2平衡可能也是人参皂苷Rb1发挥免疫调节功能的重要作用机制之一。
综上所述,本研究首次证实了人参皂苷Rb1可抑制ConA刺激的SLE患者外周血T淋巴细胞增殖活性,同时增加CD4+CD25+T细胞比例,维持Th1/Th2免疫平衡,为其用于自身免疫性疾病的治疗提供了有利的实验证据支持。

