圆齿野鸦椿枝条抗辣椒疫霉病菌活性成分
张 耀, 林智熠, 周文娟, 潘镇泽, 傅佳蕊, 陈景新, 倪 林,3, 邹双全,3
(1.福建农林大学植物保护学院;2.福建农林大学林学院;3.自然生物资源保育利用 福建省高校工程研究中心,福建 福州 350002)
辣椒疫霉病菌(Phytophthoracapsici)是鞭毛菌亚门卵菌纲霜霉目疫霉属真菌[1].该菌可严重侵染辣椒的根茎、果实等,且传播速度快,造成植物根茎腐烂霉变;该菌还可侵染黄瓜、南瓜等,严重威胁蔬菜瓜果的产量[2].目前,防治辣椒疫霉病菌最有效的手段依旧是化学防治,以甲霜灵为主的苯基酰胺类杀菌剂[3]是防治辣椒疫霉病菌的常用药剂.而甲霜灵的长期使用使土壤中的腐霉菌群体结构发生改变,耐药菌株数量增多,形成抗药性菌体,致使甲霜灵的防治效果下降甚至无效[4-5].因此,挖掘和开发防治辣椒疫霉病菌的新型且低毒的有效生物成分已迫在眉睫.
圆齿野鸦椿(EuscaphiskonishiiHayata)为省沽油科(Staphyleaceae)野鸦椿属(Euscaphis)植物,是民间常用中草药[6-7].该植物广泛分布在福建省各地,植物资源丰富,其中,福建沙县种植基地约有20万株.本课题组一直致力于圆齿野鸦椿药用资源的开发与利用,已分离得到的野鸦椿属植物的化学成分有木脂素类、萜类、黄酮类和鞣质类等[8-10],且这些化合物具有抗炎、抗肿瘤、抗肝纤维化、抑菌等药理活性[11-15].目前,有关圆齿野鸦椿药用成分的研究主要集中于根和果实,针对枝条化学成分的研究较少.本课题组前期研究发现,圆齿野鸦椿枝条的乙酸乙酯萃取物抑菌效果较好,其对辣椒疫霉病菌的抑制效果最好.为了进一步探究其抑菌活性成分,并为野鸦椿属植物资源的利用提供参考,本研究采用生物活性追踪法,筛选对辣椒疫霉病菌抑制效果较好的单体成分,并初步评价其抑菌机制.
1 仪器与材料
1.1 仪器
Waters W2695-QDA高效液相色谱-质谱联用仪(Waters公司);BS-214D电子天平(赛多利斯科学仪器北京有限公司);LC-20AP制备型高效液相色谱仪(Shimadzu);THZ-C-1台式冷冻恒温振荡器(苏州培英实验设备有限公司);SPX-250B-Z型生化培养箱(上海博讯实业有限公司医疗设备厂);SW-CJ-2FD型双人单面净化工作台(苏州净化设备厂);GR85DF型高压灭菌锅(美国致微仪器有限公司);Therom电导率仪(苏州赛力威仪器设备有限公司);UVmini-1240紫外分光光度计(Shimadzu);MIKRO-200R小型台式高速离心机(Hettich);DK-98IIA水浴锅(天津泰斯特仪器苏州有限公司);EPOCH2酶标仪(美国伯腾仪器有限公司).
1.2 材料
硅胶(青岛海洋化工有限公司);Sephadex LH-20凝胶(General Electric Company);PRP-512A树脂(北京聚福树脂厂);YMC-Pack ODS-A反相色谱柱(日本YMC公司);Diamonsil C18分析型反相色谱柱(北京迪马科技有限公司);有机溶剂甲醇、二氯甲烷、石油醚、乙酸乙酯(西陇化工有限公司);色谱纯甲醇(批号I1108107033)、乙腈(批号SHBL4495)均购自默克公司;丁子香酚(山东亿嘉农化有限公司,批号HNP13106-D3648);马铃薯(采购于永辉超市);蒸馏水(实验室自制);Tris-HCl缓冲液(sigma公司);苯酚(批号20200728)、亚硫酸钠(批号20200708)、酒石酸钾钠(批号20190815)均购自国药集团化学试剂有限公司;96孔板(福州市闽侯县科迈仪器有限公司);考马斯亮蓝G-250(批号No.617P038)、酶活性测试试剂盒均购自福州惠科生物有限公司.
圆齿野鸦椿枝条样品于2016年11月采自福建省三明市清流圆齿野鸦椿种植基地,经福建农林大学林学院邹双全教授鉴定为省沽油科野鸦椿属圆齿野鸦椿.腊叶标本(No.20161105)由福建农林大学植物保护学院倪林副教授采自福建省三明市尤溪县,保存在福建农林大学植物保护学院农药与制药工程系样品室.
辣椒疫霉病菌由福建农林大学农药学教育部重点实验室提供,菌种保存于福建农林大学植物保护学院农药与制药工程系样品室.
2 试验方法
2.1 化学成分提取
取干燥的圆齿野鸦椿枝条粗粉10 kg,用80 L的95%乙醇回流提取3次(每次3 h),提取液减压浓缩得乙醇浸膏670 g.取浸膏600 g,甲醇溶解,与等量白色硅藻土拌样;依次用石油醚、乙酸乙酯、乙醇各6.0 L进行洗脱,分别得到石油醚萃取物(106 g)、乙酸乙酯萃取物(150 g)和乙醇萃取物(149 g).对抑菌效果最好的乙酸乙酯萃取物进行分离,经硅胶(48~75 μm)柱色谱分析,按v(二氯甲烷)∶v(甲醇)=100∶0、50∶1、30∶1、20∶1、10∶1、5∶1、2∶1、1∶1和0∶100依次进行梯度洗脱,得到16个馏分Fr.1~Fr.16.采用菌丝生长速率法[16-17],测定16个馏分的抑菌活性,结果表明Fr.16对辣椒疫霉病菌的抑制效果较好.
Fr.16(5.5 g)经PRP-512A树脂分离,依次以体积分数为10%、30%、60%、95%的乙醇和丙酮洗脱,得到5个组分(Fr.16.1~Fr.16.5).馏分Fr.16.1(0.5 g)和馏分Fr.16.3(1.1 g)分别重结晶得化合物5(200 mg)和8(500 mg);Fr.16.2(103 mg)经HPLC(C18,40%甲醇,8.0 mL·min-1,检测波长210 nm)纯化得到化合物1(6.9 mg)和4(3.9 mg);Fr.16.5(1.4 g)经PRP树脂分离,收集馏分,通过TLC检测合并得到3个组分(Fr.16.5.1~Fr.16.5.3).其中,Fr.16.5.2(1 g)经Sephadex LH-20柱色谱分析,以甲醇进行洗脱分离,收集馏分,通过TLC检测合并得到5个组分(Fr.16.5.2.1~Fr.16.5.2.5). Fr.16.5.2.2(232 mg)经HPLC(C18,25%甲醇,8.0 mL·min-1,检测波长210 nm)纯化得到化合物3(4.5 mg)和6(15 mg);Fr.16.5.2.3(117 mg)经HPLC(C18,25%甲醇,8.0 mL·min-1,检测波长210 nm)纯化得到化合物2(12 mg)和7(4 mg).
2.2 化合物抑菌活性测定
抑菌活性测定采用菌丝生长速率法[16-17].将化合物6、8用二氯甲烷溶解,其余均用甲醇溶解,药液最终浓度为75 mg·L-1,以此浓度测定抑菌活性.将抑制率≥50%的提取物配制成浓度为25、50、100、200、400 μg·mL-1的含药PDA培养基,接种培养后再次测定其抑菌活性,并计算毒力回归方程、有效中浓度(EC50)值和决定系数(R2).以丁子香酚为阳性对照药,每个处理组3个重复.
2.3 化合物5对菌丝干重影响的测定
将提取物分别配制成终浓度为25、50、100、200、400 μg·mL-1的含药PDB培养基,取生长至6 d的辣椒疫霉病菌菌株,打取5个菌饼接入培养基中,以不加菌株的PDB培养基作为空白对照.将培养基置于振荡培养箱中(28 ℃,110 r·min-1)培养6 d,然后把培养后的菌丝干燥、称重.每个处理组3个重复.
2.4 化合物5对辣椒疫霉病菌细胞膜的影响
2.4.1 细胞膜相对电导率的测定 取6 d菌龄的辣椒疫霉病菌菌饼接入PDB培养基中,在恒温振荡培养箱中培养6 d,收集菌丝,用无菌水冲洗菌丝并抽干水分.将药剂浓度稀释为100 μg·mL-1,取药液25 mL,加入1 g病菌菌丝,以蒸馏水为空白对照,每个处理组3个重复.室温条件下分别处理0.5、1.0、1.5、2.0、2.5 h后,用电导率仪测量电导率,2.5 h后将菌丝体煮沸、冷却,测定最终电导率[18].计算菌丝体的相对电导率:

2.4.2 细胞膜丙二醛含量的测定 打取5个培养好的辣椒疫霉病菌菌饼,接入PDB培养液中,在振荡培养箱中培养6 d,收集菌丝,用无菌水冲洗干净并抽干水分,配制药剂浓度为100 μg·mL-1,取药液25 mL,加入1 g病菌菌丝,以蒸馏水为空白对照,每个处理组3个重复.室温条件下分别处理1、6、12、18、24 h后收集处理的菌丝,-20 ℃保存备用.分别取0.4 g不同时间收集到的菌丝,加入2 mL Tris-HCl缓冲液研磨,1 000 r·min-1离心10 min,取上清液备用.
通过硫代巴比妥酸法[19]测定辣椒疫霉病菌的丙二醛含量.将0.5% TBA溶液加入2 mL上述菌丝提取液中反应,沸水浴10 min,冷却后再放入离心机以10 000 r·min-1条件离心10 min.空白对照为0.5% TBA溶液,分别测定450、532、600 nm处的光密度(D)值,计算丙二醛含量,每个处理组3个重复.
2.5 化合物5对辣椒疫霉病菌蛋白质含量影响的测定
分别取不同处理(方法同2.4.2)的菌丝提取液0.1 mL,稀释10倍后再取0.1 mL,加入考马斯亮蓝G-250溶液5 mL,混合反应5 min后在540 nm处测定各处理的D值.每个处理组3个重复,同时以Tris-HCl缓冲液与考马斯亮蓝G-250溶液的混合液为空白对照.
2.6 化合物5对辣椒疫霉病菌保护酶活性影响的测定
过氧化氢酶(catalase, CAT)活性测定采用紫外分光光度法[20].取1 mL不同处理(方法同2.4.2)的菌丝提取液,分别加入5%硫酸钛和浓氨水反应,然后3 000 r·min-1离心10 min,再加入5%硫酸5 mL至完全溶解.以蒸馏水为空白对照,每个处理组3个重复,分别测定各处理在240 nm处的D值.
过氧化物酶(peroxidase, POD)活性测定采用愈创木酚比色法[20].取100 μL不同处理(方法同2.4.2)组的菌丝提取液,分别加入3 mL pH为5.5的磷酸缓冲液(0.05 mol·L-1)、1 mL愈创木酚溶液(0.05 mol·L-1)、1 mL 1%的双氧水,在37 ℃水浴中混匀反应.以蒸馏水为空白对照,每个处理组3个重复,分别测定各处理在470 nm处的D值.
超氧化物歧化酶(superoxide dismutase, SOD)活性测定采用氮蓝四唑(NBT)法[20].取1 mL不同处理(方法同2.4.2)的菌丝提取液,分别加入50 mmol·L-1缓冲液、pH 7.8的13 mmol·L-1甲硫氨酸、100 nmol ·L-1EDTA溶液、75 μmol·L-1NBT溶液、2 μmol·L-1核黄素溶液混匀.以蒸馏水为空白对照,每个处理组3个重复,分别测定各处理在560 nm处的D值.
2.7 数据处理和分析
采用SPSS(20.0)软件处理抑菌活性数据,采用Excel和GraphPad Prism 8软件作图.
3 结果与分析
3.1 结构鉴定
通过1H-NMR、13C-NMR等对化合物1~8的结构进行鉴定,并结合已报道的波谱数据确定其结构,如图1所示.

图1 化合物1~8的结构Fig.1 Structure of compounds 1-8
化合物1:黄色油状物(甲醇),分子式为C35H40O13,ESI-MSm/z: 669[M+H]+,1H-NMR (400 MHz, DMSO-d6)δ:6.08 (1H, s, H-3), 6.59 (1H, s, H-6), 1.89 (1H, m, H-8), 3.58 (2H, dd,J=10.0, 3.0, H-9a), 3.46 (2H, dd,J=10.0, 6.0 Hz, H-9b), 6.78 (1H, d,J=2.0 Hz, H-2′), 6.68(1H, d,J=8.0 Hz, H-5′), 6.49 (1H, dd,J=2.0, 8.0 Hz, H-6′), 4.36 (2H, dd,J=12.0, 1.6 Hz, H-6a″), 4.14 (2H, dd,J=12.0, 1.6 Hz, H-6b″), 6.39 (1H, d,J=16.0 Hz, H-8‴), 3.69 (3H, s) , 3.71 (3H, s);13C-NMR (100 MHz, DMSO-d6)δ:127.0 (C-1), 132.6 (C-2), 116.3 (C-3), 144.1 (C-4), 145.5 (C-5), 111.8 (C-6), 32.5 (C-7), 37.6 (C-8), 62.7 (C-9), 136.9 (C-1′), 113.8 (C-2′), 147.2 (C-3′), 144.5 (C-4′), 115.5 (C-5′), 121.2 (C-6′), 45.6 (C-7′), 44.6 (C-8′), 67.7 (C-9′), 104.0 (C-1″), 73.4 (C-2″), 76.4 (C-3″), 70.1 (C-4″), 73.7 (C-5″), 63.8 (C-6″), 124.9 (C-1‴), 130.4 (C-2‴), 115.8 (C-3‴), 160.1 (C-4‴), 115.8 (C-5‴), 130.4 (C-6‴), 144.9 (C-7‴), 113.9 (C-8‴), 166.7 (C-9‴), 55.5 (5-OCH3), 55.6 (3′-OCH3).以上波谱数据与文献[21]基本一致,故将化合物1鉴定为(+)-(8R, 7′R, 8′R)-isolariciresinol-9-(6-tris-p-coumaroyl)-O-β-D-glucopyranoside.
化合物2:黄色油状物(甲醇),分子式为C26H36O11,ESI-MSm/z: 523[M-H]-,1H-NMR (400 MHz, DMSO-d6)δ:8.48 (1H, s, 4-OH), 6.98 (1H, d,J=2.0 Hz, H-2), 6.85 (1H, d,J=8.0 Hz, H-5), 6.75 (1H, m, H-3′), 6.67 (1H, d,J=8.0 Hz, H-3), 6.64 (1H, m, H-5′), 5.30 (1H, d,J=4.5Hz, H-7),4.70 (1H, m, H-8), 4.56 (1H, m, H-9′b), 4.46 (1H, m, H-9′a), 4.22 (1H, m, H-9a), 4.1 (1H, d,J=7.6 Hz, H-9b), 3.72 (3H, s, 2′-OCH3), 3.69 (3H, s, 3-OCH3), 2.52 (2H, m, H-7′), 1.67 (2H, m, H-8′);13C-NMR (100 MHz, DMSO-d6)δ:149.5 (C-2′), 147.0 (C-3), 146.0 (C-4), 145.4 (C-1′), 134.7 (C-4′), 133.3 (C-1), 120.1 (C-5′), 119.5 (C-6), 115.9 (C-5), 114.6 (C-6′), 113.0 (C-2), 111.3 (C-3′), 103.0 (C-1″), 83.9 (C-8), 73.5 (C-4″), 71.6 (C-7), 70.4 (C-2″), 70.1 (C-3″), 68.3 (C-5″), 61.1 (C-9), 61.1 (C-9′), 55.4 (2′-OCH3), 55.6 (3-OCH3), 33.8 (C-8′), 31.2 (C-7′), 17.9 (C-6″).以上波谱数据与文献[22]基本一致,故将化合物2鉴定为(7R, 8R)-threo-7, 9, 9′-三羟基-3, 3′-二甲氧基-8-O-4′-新木脂素7-O-α-L-鼠李糖苷.
化合物3:白色结晶(甲醇),分子式为C20H16O7,ESI-MSm/z: 369[M+H]+,1H-NMR (400 MHz, CDCl3)δ:6.78~6.86 (6H, m, H-2,2′, 5,5′, 6,6′), 5.98 (2H, s, -OCH2O-), 5.96 (2H, s, -OCH2O-), 5.30 (1H, dd,J=4.0, 9.6 Hz, H-7),4.33 (1H, dd,J=6.8, 9.6 Hz, H-9a), 4.02 (1H, dd,J=9.6, 4.8 Hz, H-9b), 3.42 (1H, dd,J=4.0, 9.2 Hz, H-8′), 3.20 (1H, m, H-8);13C-NMR (100 MHz, CDCl3)δ:176.8 (C-9′), 148.5 (C-3′), 148.2 (C-4′), 148.1 (C-3), 147.4 (C-4), 134.4 (C-1′), 133.1 (C-1), 119.2 (C-6′), 118.9 (C-6), 108.7 (C-2), 108.5 (C-2′), 106.1 (C-5′), 105.8 (C-5), 101.6 (OCH2O), 101.3 (OCH2O), 84.5 (C-7′), 83.5 (C-7), 72.8 (C-9), 53.4 (C-8), 50.1 (C-8′).以上波谱数据与文献[23]基本一致,故将化合物3鉴定为4-氧代芝麻素.
化合物4:黄色油状物(甲醇),分子式为C8H12O3,ESI-MSm/z: 157[M+H]+,1H-NMR (400 MHz, DMSO-d6)δ:4.88 (1H, q,J=2.0 Hz, H-6), 4.35 (1H, brs, H-4), 3.93 (1H, m, H-8), 2.89 (1H, s, H-3a), 2.77 (1H, dd,J=2.0, 19.2 Hz, H-3b), 1.93 (1H, m), 1.55 (1H, dt,J=2.2, 18.4 Hz, H-7b), 1.22 (3H, d,J=6.0 Hz, H-9);13C-NMR (100 MHz, DMSO-d6)δ:169.5 (C-2), 72.6 (C-6), 65.3 (C-4), 61.4 (C-8), 38.1 (C-7), 36.1 (C-3), 28.7 (C-5), 21.3 (C-9).以上波谱数据与文献[8]基本一致,故将化合物4鉴定为tetraketide.
化合物5:白色粉末(甲醇),分子式为C30H48O4,ESI-MSm/z: 471[M-H]-,1H-NMR (400 Hz, pyridine-d5)δ:5.64 (1H, brs, H-12), 3.46 (1H, dd,J=4.8, 11.2 Hz, H-3), 3.17 (1H, m, H-16a), 3.09 (1H, s, H-18), 2.37 (1H, m, H-15a), 2.18 (1H, m, H-16b), 2.14 (1H, m, H-22a), 2.09 (1H, m, H-21), 2.08 (2H, m, H-11), 2.05 (1H, m, H-22b), 1.88 (1H, m, H-9), 1.85 (2H, m, H-2), 1.76 (3H, s, H-27), 1.66 (1H, m, H-7a), 1.58 (1H, m, H-6a), 1.56 (1H, m, H1-1), 1.52 (1H, m, H-20), 1.48 (3H,s, H-29), 1.42 (2H, m, H-7b, H-6b), 1.35 (1H, m, H-21b), 1.31 (1H, m, H-15b), 1.26 (3H,s, H-23), 1.15 (3H, s, H-26), 1.14 (3H, d,J=6.6Hz, H-30) , 1.05 (3H, s, H-24), 0.98 (1H, m, H1-2), 0.93 (3H, s, H-25), 0.91 (1H, m, H-5);13C-NMR (100 Hz, pyridine-d5)δ:179.6 (C-28), 138.8 (C-13), 127.0 (C-12), 76.9 (C-3), 71.5 (C-19), 54.7 (C-5), 53.4 (C-18), 47.1 (C-17), 41.2 (C-20), 40.9 (C-14), 39.1 (C-8), 38.2 (C-4), 37.8 (C-1), 37.3 (C-22), 36.6 (C-9), 36.2 (C-10), 32.4 (C-7), 28.1 (C-15), 27.6 (C-23), 26.9 (C-2), 25.9 (C-29), 25.8 (C-21), 25.2 (C-16), 23.5 (C-27), 22.8 (C-11), 17.7 (C-6), 15.6 (C-30), 16.0 (C-26), 15.4 (C-24), 14.4 (C-25).以上波谱数据与文献[24]基本一致,故将化合物5鉴定为19α-羟基熊果酸.
化合物6:白色针状结晶(氯仿),分子式为C16H16O3,ESI-MSm/z: 257[M+H]+,1H-NMR (400 MHz, DMSO-d6)δ: 9.60 (1H, s, 4′-OH), 7.42 (2H, d,J=8.4 Hz, H-2′,6′), 7.16 (1H, d,J=16.4 Hz, H-8),6.94 (1H, d,J=16.4 Hz, H-7), 6.77 (2H, d,J=8.4 Hz, H-3′,5′), 6.72 (2H, d,J=2.0 Hz, H-2,6), 6.37 (1H, t,J=2.0 Hz, H-4), 3.77 (6H, s, 3,5-OCH3);13C-NMR (100 MHz, DMSO-d6)δ:160.7 (C-3,5), 157.4 (C-4′), 139.6 (C-1), 129.0 (C-1′,8), 128.0 (C-2′,6′), 125.2 (C-7) , 115.6 (C-3′,5′), 104.1 (C-2,6), 99.3 (C-4), 55.2 (3,5-OCH3).以上波谱数据与文献[25]基本一致,故将化合物6鉴定为紫檀芪.
化合物7:黄色油状物(甲醇),分子式为C17H19O6,ESI-MSm/z: 342[M+Na]+,1H-NMR (400 MHz, DMSO-d6)δ:7.60 (1H, dd,J=2.0, 8.4 Hz, H-6), 7.48 (1H, d,J=2.0 Hz, H-2), 6.91 (1H, dd,J=2.0, 8.0 Hz, H-2′), 6.82 (1H, d,J=8.4 Hz, H-5), 6.67 (2H, m, H-5′, H-6′), 4.75 (1H, dd,J=9.2, 5.2 Hz, H-8), 4.09 (1H, t,J=9.2 Hz, H-9a), 3.79 (3H, s, 3-OCH3), 3.72 (3H, s, 3′-OCH3), 3.51 (1H, dd,J=9.2, 5.2 Hz, H-9b);13C-NMR (100 MHz, DMSO-d6)δ:197.1 (C-7), 151.1 (C-4), 147.6 (C-3′), 147.5 (C-3), 145.6 (C-4′), 128.5 (C-1), 128.3 (C-1′), 123.6 (C-6), 120.3 (C-6′), 115.5 (C-5′), 114.9 (C-5), 112.4 (C-2′), 111.6 (C-2), 63.8 (C-9), 55.6 (3-OCH3), 55.5 (3′-OCH3), 53.9 (C-8).以上波谱数据与文献[10]一致,故将化合物7鉴定为evofolin B.
化合物8:无色片状固体(氯仿),分子式为C29H48O,ESI-MSm/z: 411[M-H]-,1H-NMR (400 MHz, CDCl3)δ:5.01 (1H, dd,J=15.2, 8.6 Hz), 5.16 (1H, dd,J=15.2, 8.6 Hz), 5.35 (2H, d,J=5.2 Hz);13C-NMR (100 MHz, CDCl3)δ:140.8 (C-5), 121.7 (C-6), 71.8 (C-3), 56.7 (C-13), 53.6 (C-16),50.2 (C-9), 49.8 (C-8), 42.3 (C-4), 41.8 (C-12), 39.0 (C-19), 38.4 (C-11), 37.3 (C-1), 36.2 (C-10), 31.3 (C-7), 31.1 (C-2), 31.0 (C-21), 29.5 (C-24), 28.0 (C-23), 27.4 (C-15), 24.3 (C-14), 23.1 (C-27), 21.1 (C-22), 21.0 (C-20), 20.6 (C-10), 19.7 (C-25), 19.0 (C-18), 18.8 (C-26), 12.0 (C-28), 12.0 (C-17).与豆甾醇对照品进行TLC对照,Rf值(比移值)及显色行为均一致,且以上波谱数据与文献[26]基本一致,故将化合物8鉴定为豆甾醇.
3.2 化合物对辣椒疫霉病菌的抑制活性
8种化合物中仅3种抑菌活性较强,分别为化合物4、5、7.其中,化合物7(evofolin B)和化合物4(tetraketide)对辣椒疫霉病菌具有中等抑制作用,EC50值分别为0.906和1.285 μmol·L-1;化合物5(19α-羟基熊果酸)对辣椒疫霉病菌抑制效果最好,EC50值为0.300 μmol·L-1,且其毒力高于阳性对照丁子香酚(表1).
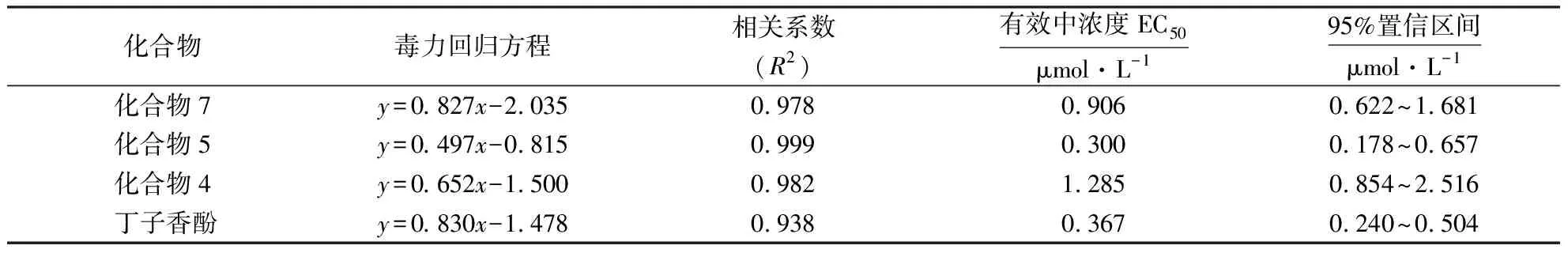
表1 3种化合物对辣椒疫霉病菌的毒力Table 1 Toxicity testing of 3 compounds on P.capsici
3.3 19α-羟基熊果酸对辣椒疫霉病菌菌丝干重的影响
化合物浓度为25 μg·mL-1时,处理6 d后对菌丝干重的影响不明显;随着化合物浓度不断升高,菌丝干重逐渐降低;当化合物浓度为400 μg·mL-1时,菌丝干重仅为28.00 mg,对照组为55.11 mg,差异显著,抑制率为50.81%(图2A).

柱上不同字母表示同一处理条件下处理组与对照组的差异显著.图2 19α-羟基熊果酸对辣椒疫霉病菌菌丝干重(A)、细胞膜相对电导率(B)和丙二醛含量(C)及菌体蛋白质含量(D)的影响Fig.2 Effect of pomolic acid on hyphae dry weight (A), relative conductivity (B), malondialdehyde content (C) and protein content (D) of P.capsici
3.4 19α-羟基熊果酸对辣椒疫霉病菌细胞膜的影响
3.4.1 细胞膜相对电导率 图2B表明:细胞膜的相对电导率随着处理时间的延长而不断增大,0~2 h相对电导率变化幅度较小;而在2 h后相对电导率急剧增大,2.5 h时达到73.3%,处理组与对照组差异显著.这说明处理时间越长对菌体破坏越严重.
3.4.2 细胞膜丙二醛含量 处理前期,细胞膜丙二醛含量随着处理时间的延长而不断增高,但达到峰值(18 h,4.49 nmoL·g-1)后急剧降低,而对照组丙二醛含量几乎保持一致(图2C).辣椒疫霉病菌细胞膜受损害后引起膜脂过氧化反应,MDA就是其产物之一,其可以间接反映细胞膜受损程度.处理6~24 h细胞膜丙二醛含量均高于对照组且差异显著,表明19α-羟基熊果酸可破坏菌体细胞膜,引起膜脂过氧化反应.
3.5 19α-羟基熊果酸对辣椒疫霉病菌蛋白质含量的影响
19α-羟基熊果酸处理辣椒疫霉病菌后,随着处理时间的延长,菌丝体内可溶性蛋白质含量变化不明显,但整个试验过程中处理组蛋白质含量均高于对照组(图2D),表明19α-羟基熊果酸可以干扰菌丝体蛋白质的合成,促进菌体内储存的蛋白质大量分解.
3.6 19α-羟基熊果酸对辣椒疫霉病菌CAT、POD、SOD活性的影响
图3A显示,CAT活性在处理1 h内无明显变化;6 h后CAT活性迅速升高并在18 h时达到峰值,约为对照组的7.60倍;18~24 h该酶活性显著下降,但仍然高于对照组.而对照组CAT活性没有明显变化.
POD活性变化规律与CAT基本相同(图3B):处理1 h内POD活性无明显变化;6~12 h POD活性迅速升高并达到峰值,约为对照组的7.38倍;12 h后,POD活性显著下降,但仍然高于对照组.
图3C显示,处理1 h内SOD活性与对照组相比明显升高;6~12 h SOD活性迅速升高并达到峰值,为对照组的3.49倍;12~18 h SOD活性急剧下降,但仍然高于对照组;18~24 h SOD活性缓慢降低.

图3 19α-羟基熊果酸对辣椒疫霉病菌CAT (A)、POD (B)、SOD (C)活性的影响Fig.3 Effect of pomolic acid on CAT (A), POD (B) and SOD (C) activities of P.capsici
4 结论与讨论
本研究对圆齿野鸦椿枝条的抑菌成分进行分离、纯化,从中得到8种化合物,分别鉴定为:(+)-(8R, 7′R, 8′R)-isolariciresinol-9-(6-tris-p-coumaroyl)-O-β-D-glucopyranoside(1)、(7R, 8R)-threo-7, 9, 9′-三羟基-3, 3′-二甲氧基-8-O-4′-新木脂素7-O-α-L-鼠李糖苷(2)、4-氧代芝麻素(3)、tetraketide(4)、19α-羟基熊果酸(5)、紫檀芪(6)、evofolin B(7)、豆甾醇(8).其中,化合物1、2、3、7属于木脂素类化合物,化合物4为内酯类化合物,化合物5为三萜酸类化合物,化合物6为联苄类化合物,化合物8属于甾体化合物.除化合物4、5、7外,其他成分均为本课题组首次从野鸦椿属分离所得.
化合物1~8对辣椒疫霉病菌均有一定抑制作用.其中,化合物5对辣椒疫霉病菌的抑制作用最强,抑制率达65.63%,EC50值为0.300 μmol·L-1;化合物4和7对辣椒疫霉病菌的抑制率也均在50%以上,EC50值分别为1.285 和0.906 μmol·L-1.进一步探究化合物5对辣椒疫霉病菌的菌丝干重、细胞膜、可溶性蛋白质含量、保护酶(CAT、POD、SOD)活性的影响,结果表明:随着化合物浓度的增大,菌丝干重不断减少;细胞膜相对电导率随处理时间的延长而增大,且在整个试验过程中,处理组相对电导率均大于对照组,说明19α-羟基熊果酸会增大辣椒疫霉病菌细胞膜的通透性,使菌体细胞内容物外泄,抑制菌丝生长,从而使电导率不断升高;可溶性蛋白质含量随处理时间的延长变化幅度不大,但整体水平高于对照组;CAT、POD、SOD活性随处理时间的延长呈倒 “V” 型(先增大后减小)的变化趋势.已有研究发现,用棉花茎中分离获得的内生细菌J13处理接种辣椒疫霉病菌的辣椒苗后,植株体内的CAT、POD、SOD活性均呈倒“V”型(先升高后降低)变化趋势[27],与本试验结果基本一致.这说明辣椒疫霉病菌可以通过调节多种酶活性来减轻化合物对自身的毒害作用.本研究仅检测了化合物5对辣椒疫霉病菌的离体活性,对于其作用机理还需进行深入研究,进而为植物源农药的开发提供更多依据.

