响应面优化超声波辅助酶法提取油莎豆ACE抑制肽的工艺
殷海洋,刘振春,张世康,安 琪
(吉林农业大学食品科学与工程学院,吉林长春 130118)
油莎豆(Cyperus esculentus)因细长的根系顶端长有形状似豆的块茎而得名,属禾本科一年生植物,原产于非洲及地中海沿岸国家。油莎豆拥有极强的适应生存能力,于1960年被我国引进并大面积种植,主要分布于黑龙江、北京、河北、湖南、山东、四川等地[1−2]。油莎豆的主要成分是油脂及淀粉,占比达55%,此外还含有约10%的蛋白质。油莎豆蛋白中含17 种氨基酸,营养极为丰富且消化率极高,其中70.59%的蛋白可被胃蛋白酶直接消化吸收,是一种利用价值超过小麦、玉米的高价值粮食作物[3−6]。
血管紧张素转化酶(ACE)是一种对血压有升高作用的酶,主要存在于动物肺部组织。ACE 可通过催化血管紧张素I 转化为血管紧张素II,促进血管收缩引起血压升高[7−8],还可使人体内舒缓肌肽失活,阻碍血管舒张,从而使血压升高。而ACE 抑制肽是一种可以有效抑制ACE 生理活动、降低血压的多肽物质,它与ACE 间存在极强的相互作用,可以限制血管紧张素I 向血管紧张素II 转化[9−12]。近年来有很多研究者从核桃、绿豆等植物中提取ACE 抑制肽并用于治疗高血压,都表现出明显的效果[13−15]。
我国对油莎豆ACE 抑制肽的制备和研究处于起步阶段,主要集中在研究油莎豆的种植和成分分析。利用超声波辅酶法提取油莎豆ACE 抑制肽未见报道,对油莎豆的利用和开发有重要意义[16]。本研究利用响应面法优化超声波辅助酶法提取油莎豆ACE 抑制肽工艺,以期为油莎豆ACE 抑制肽进一步研究提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
油莎豆 吉林农大外农贸市场售;碱性蛋白酶(100 U/mg)、中性蛋白酶(200 U/mg)、胃蛋白酶(200 U/mg)、木瓜蛋白酶(100 U/mg) 北京奥博星生物技术有限公司;血管紧张素转化酶、马尿酰组氨酰亮氨酸(HHL) Sigma 公司。
JY99-2D 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;LG0.2 真空冷冻干燥机 沈阳航天新阳速冻设备制造有限公司;LXJ-ⅡB 离心机 上海安亭科学仪器厂;SHA-B 水浴恒温振荡器 金坛市医疗仪器厂;SPD-20A UVmini-1240 紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 油莎豆蛋白等电点的测定 将霉变和有虫洞的油莎豆筛除后粉碎、用石油醚浸泡脱脂、干燥过80 目筛。称取油莎豆粉20 g,按1:15(g/mL)加入蒸馏水混合,45 ℃水浴。用1 mol/L NaOH 调pH 为9.0,搅拌1 h,5000 r/min 离心10 min 后,将上清液均分成6 组。用1 mol/L HCl 溶液将上述6 组上清液pH 分别调为3.8、4.0、4.2、4.4、4.6、4.8,静置30 min 后5000 r/min 离心10 min,取沉淀物称重,以沉淀质量最大值时的pH 为油莎豆蛋白等电点[17]。

1.2.2 ACE 抑制率测定 采用Cushman 检测方法[18],在4 mL EP 管中先加入200 μL 马尿酰-组氨酰-亮氨酸(HHL)溶液,再加入50 μL ACE 抑制剂,混合后置于37 ℃恒温水浴锅中水浴5 min,然后再加入50 μL ACE 溶液。37 ℃水浴条件下保持40 min,将1 moL/L HCl 溶液作为终止剂,向上述溶液中加入200 μL HCl 溶液迅速降低pH 终止反应。再向试管中加入1.2 mL 乙酸乙酯摇匀混合约15 s,5000 r/min 离心10 min 吸取0.8 mL 脂层溶液,120 ℃烘干30 min。烘干后白色晶体加入3 mL 的去离子水溶解,用紫外分光光度计测定波长为228 nm 处吸光值。
ACE 抑制率测定步骤见表1,计算公式如下:
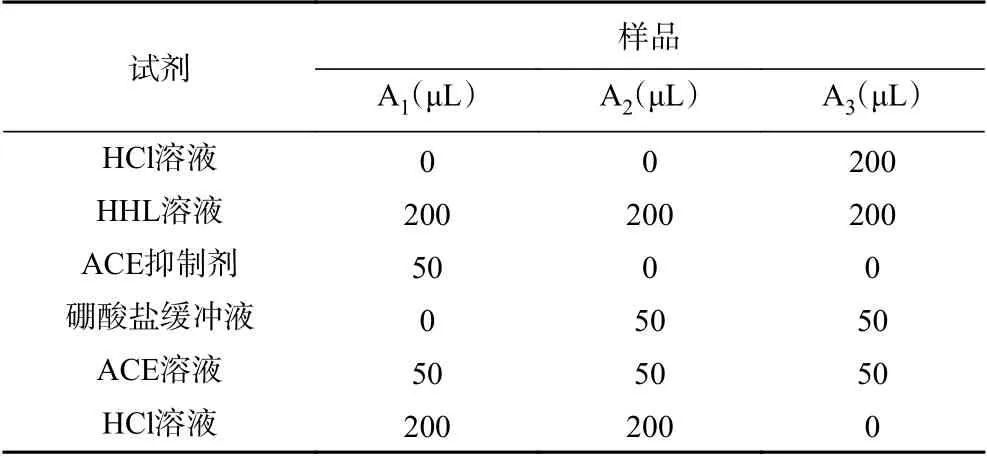
表1 ACE 抑制率的测定步骤Table 1 Determination of ACE inhibition rate
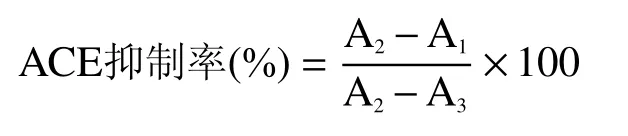
式中:A1:ACE 抑制肽和ACE 都存在的溶液吸光度值;A2:不加ACE 抑制肽的溶液吸光度值;A3:ACE 与HHL 存在的空白溶液吸光度值。
1.2.3 油莎豆蛋白质提取 将霉变和有虫洞的油莎豆筛除后粉碎、用石油醚浸泡脱脂、干燥过80 目筛。按1:15 (g/mL)加入蒸馏水混合均匀,用0.5 mol/L NaOH 将pH 调至9.0 搅拌提取1 h,5000 r/min 离心10 min,取上清液。再将上清液用0.5 mol/L HCl滴定至等电点(pH4.2),静置30 min 后5000 r/min 离心10 min,沉淀用蒸馏水反复洗至中性,冷冻干燥48 h。密封在−20 ℃冰箱中保存[19]。
1.2.4 超声波辅助酶法制备油莎豆ACE 抑制肽工艺 取5 g 油莎豆粗蛋白,按料液比1:10 加入蒸馏水。180 W 超声处理20 min,用0.5 mol/L NaOH 调节pH 到9,水浴至恒温45 ℃后加入5000 U/g 的蛋白酶,酶解3 h。将温度提升至90 ℃维持15 min 灭酶,冷却至室温再将酶解液pH 调至等电点(4.2),5000 r/min 离心20 min,取上清液冷冻干燥[20]。
1.2.5 蛋白酶的筛选 油莎豆粗蛋白为底物,选取中性蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶4 种酶在最适条件下对油莎豆粗蛋白进行酶解[21]。底物浓度3%,加酶量5000 U/g,酶解时间3 h。将温度提升至90 ℃维持15 min 灭酶,冷却至室温再将酶解液pH 调至等电点(4.2),5000 r/min 离心20 min,收集上清液,测其ACE 抑制率。
1.2.6 单因素实验
1.2.6.1 底物浓度对油莎豆ACE 肽抑制率的影响制备底物浓度为1%、2%、3%、4%、5%(m/v)的油莎豆粗蛋白溶液。180 W 超声处理20 min,将pH 调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定底物浓度对酶解液ACE 抑制率的影响。
1.2.6.2 超声处理时间对油莎豆ACE 肽抑制率的影响 配制底物浓度为3%(m/v)的蛋白质溶液,超声功率180 W,将超声处理时间设定为10、15、20、25、30 min。将pH 调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定超声处理时间对油莎豆ACE 肽抑制率的影响。
1.2.6.3 超声功率对油莎豆ACE 肽抑制率的影响配制底物浓度为3%(m/v)的蛋白质溶液,分别在超声功率为0、60、120、180、240 W,超声处理20 min。将pH 调至9,水浴温度45 ℃,加酶量5000 U/g,酶解时间3 h。测定超声功率对油莎豆ACE 肽抑制率的影响。
1.2.6.4 酶解温度对油莎豆ACE 肽抑制率的影响配制底物浓度为3%(m/v)的蛋白质溶液,180 W 超声处理20 min。将pH 调至9,分别设定酶解温度为40、45、50、55、60 ℃,加酶量5000 U/g,酶解时间3 h。测定酶解温度对油莎豆ACE 肽抑制率的影响。
1.2.6.5 酶解时间对油莎豆ACE 肽抑制率的影响配制底物浓度为3%(m/v)的蛋白质溶液,180 W 超声处理20 min。将pH 调至9,酶解温度45 ℃,加酶量5000 U/g,酶解时间分别选取为1、2、3、4、5 h。测定酶解时间对油莎豆ACE 肽抑制率的影响。
1.2.6.6 加酶量对油莎豆ACE 肽抑制率的影响 配制底物浓度为3%(m/v)的蛋白质溶液,180 W 超声处理20 min。将pH 调至9,酶解温度45 ℃,加酶量分别选取为3000、4000、5000、6000、7000 U/g,酶解时间3 h。测定加酶量对油莎豆ACE 肽抑制率的影响。
1.3 响应面优化试验
根据Box-Benhnken 试验设计原理,以油莎豆ACE 抑制率为响应变量,从单因素实验结果中选取3 个对油莎豆ACE 抑制率影响最大的因素,见表2。以ACE 抑制率为指标优化酶解温度、超声功率、酶解时间。
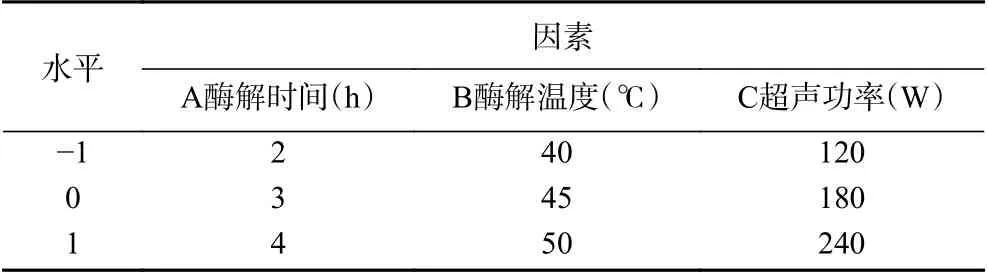
表2 响应面分析因素及水平Table 2 Response surface analysis factors and levels
1.4 数据处理
所有试验均重复三次,取平均值。单因素实验采用Origin2018 软件绘图,数据以“平均值±标准差”来表示;采用Design Expert8.0.6 软件进行响应面试验设计与分析。
2 结果与分析
2.1 油莎豆蛋白等电点的确定
油莎豆等电点测定结果如图1所示,在pH3.8~4.2 时,蛋白质得率增加;在pH4.2~4.8 时,蛋白质得率降低,因此提取油莎豆蛋白最佳pH 为4.2。
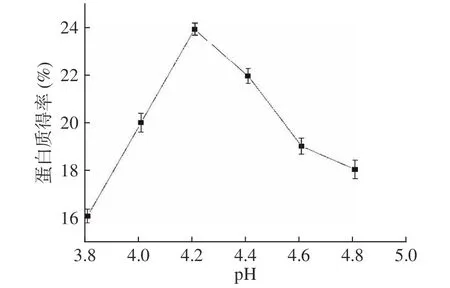
图1 油莎豆蛋白等电点的测定Fig.1 Determination of the isoelectric point of Cyperus esculentus protein
2.2 蛋白酶的选择
选用4 种蛋白酶对油莎豆蛋白进行酶解,测定其抑制率,结果如表3所示。其中碱性蛋白酶的ACE 抑制率最高,为74.45%,因此碱性蛋白酶为油莎豆粗蛋白最适酶解用酶。
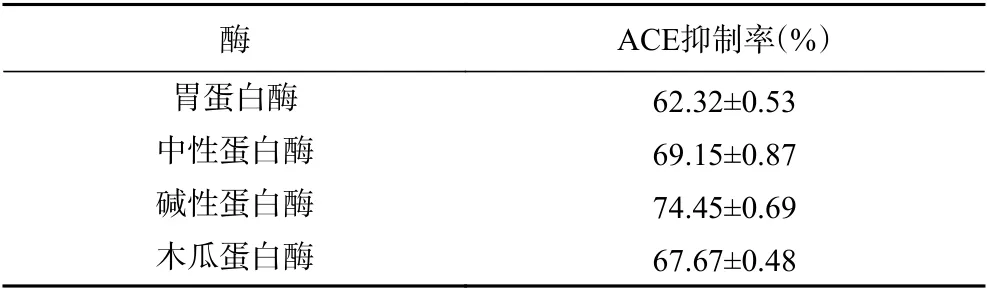
表3 四种蛋白酶对油莎豆ACE 抑制肽的抑制率的影响Table 3 Influence of four proteases on the inhibition rate of Cyperus esculentus ACE inhibitor peptide
2.3 单因素实验结果
2.3.1 底物浓度对油莎豆ACE 肽抑制率的影响 由图2可知,当蛋白质浓度为1%~3%时,ACE 抑制率随着底物浓度的增加而增加;底物浓度为3%时ACE 抑制率达到最大值74.29%;底物浓度超过3%时,ACE 抑制率开始降低。底物浓度的多少直接决定了ACE 抑制肽的含量,从而影响了ACE 与ACE 抑制肽间相互作用机率的大小及传质速度。底物浓度较小即ACE 抑制肽含量较少时,溶液浓度较低二者相互接触更加容易,所以ACE 抑制率随底物浓度的增加而增大。但底物浓度过高时ACE 抑制肽浓度也随之增大,此时ACE 抑制肽之间可能会出现团聚现象,减小了其与ACE 间可接触作用的表面积。此时表现为ACE抑制率随底物浓度增加而减小[22−23]。因此,选择底物浓度为3%。
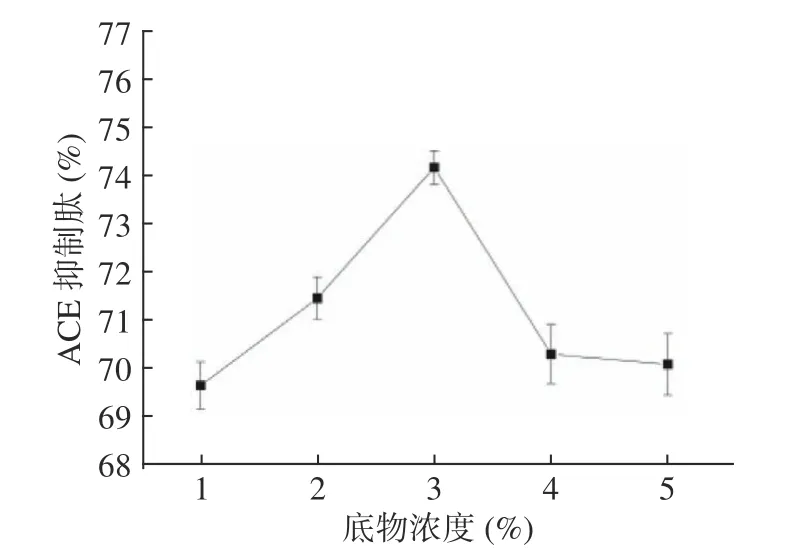
图2 底物浓度对油莎豆ACE 肽抑制率的影响Fig.2 Effect of substrate concentration on the inhibition rate of Cyperus esculentus ACE peptide
2.3.2 超声处理时间对油莎豆ACE 肽抑制率的影响 由图3可知,随超声时间增长,ACE 抑制率先增加后降低。超声时间为20 min 时,ACE 抑制率达到最大值74.03%。适当时间的超声处理可破坏细胞壁释放胞内物质给蛋白酶提供更多的酶切位点,超声时间过长有可能将蛋白质结构破坏,影响ACE 抑制肽的提取,降低其抑制率。因此,选择超声时间为20 min。
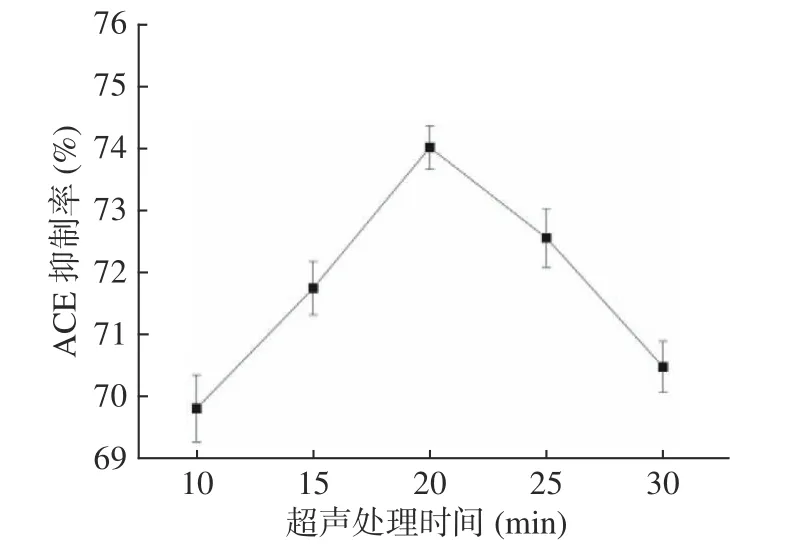
图3 超声处理时间对油莎豆ACE 肽抑制率的影响Fig.3 Effect of ultrasonic treatment time on inhibition rate of Cyperus esculentus ACE peptide
2.3.3 超声功率对油莎豆ACE 肽抑制率的影响 由图4可知,随着超声功率的增加,ACE 抑制率先增加后降低,超声功率为180 W 时,ACE 抑制率达到最大值74.52%。适当的超声功率能够破坏细胞壁,为蛋白酶提供更多的酶切位点。因此,选择超声功率为180 W。
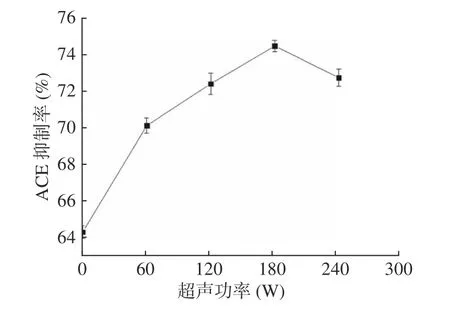
图4 超声功率对油莎豆ACE 肽抑制率影响Fig.4 Effect of ultrasonic power on the inhibition rate of Cyperus esculentus ACE peptide
2.3.4 酶解温度对油莎豆ACE 肽抑制率的影响 由图5可知,随着酶解温度的升高,ACE 抑制率先增加后降低,酶解温度为45 ℃时,ACE 抑制率达到最大值74.60%。当温度继续升高时,会导致蛋白质变性蛋白酶失活,酶解度下降,ACE 抑制肽含量降低,ACE 抑制率减少[24]。因此,选择酶解温度为45 ℃。
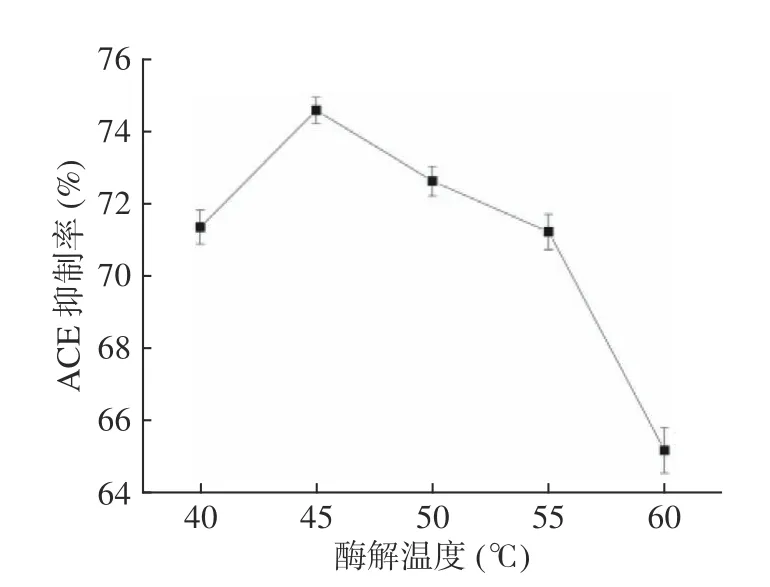
图5 酶解温度对油莎豆ACE 肽抑制率的影响Fig.5 Effect of enzymatic hydrolysis temperature on the inhibition rate of Cyperus esculentus ACE peptide
2.3.5 酶解时间对油莎豆ACE 肽抑制率的影响 由图6可知,前3 h 随酶解时间的增加,ACE 抑制率逐渐增加。3 h 后,ACE 抑制率趋于平缓,这可能是时间过长导致蛋白酶活性降低或底物量不足导致反应终止。酶解时间3 h 时,ACE 抑制率为最大值74.48%。因此,选择酶解时间为3 h。
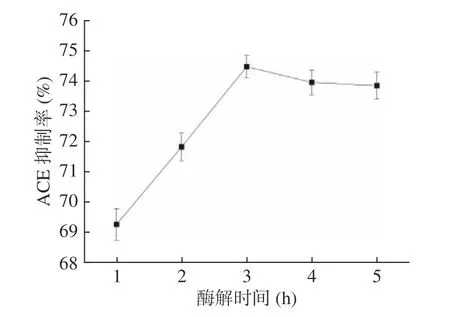
图6 酶解时间对油莎豆ACE 肽抑制率的影响Fig.6 Effect of enzymatic hydrolysis time on the inhibition rate of Cyperus esculentus ACE peptide
2.3.6 加酶量对油莎豆ACE 肽抑制率的影响 由图7可知,随加酶量的增加,ACE 抑制率逐渐增加后平稳,加酶量5000 U/g 时,ACE 抑制率达到最大值74.13%。因此ACE 抑制率并不会随着加酶量增高而不断变高,而是达到峰值后趋于稳定。为了节约生产成本,选择加酶量为5000 U/g。
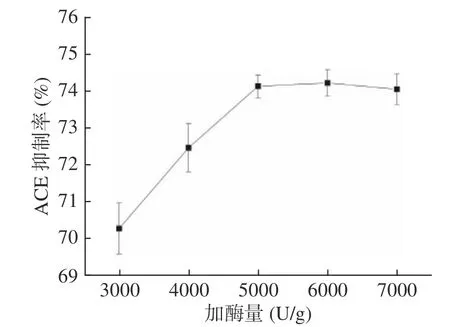
图7 加酶量对油莎豆ACE 肽抑制率的影响Fig.7 Effect of enzyme addition on the inhibition rate of Cyperus esculentus ACE peptide
2.4 响应面优化试验
根据单因素实验结果,影响油莎豆ACE 抑制率最大的主要因素有:酶解时间(A)、酶解温度(B)、超声功率(C),利用Box-Behnken 中心组合试验进行三因素三水平试验,对酶解条件进行优化。响应面试验结果见表4,方差分析结果见表5。
2.4.1 回归方程的建立与检验 利用Design Expert 8.0.6 软件对表4中的实验数据进行多元回归拟合,得到二次多项回归程:Y=+74.29+0.41A−0.50B+0.049C−0.27AB+0.095AC−0.43BC−1.73A2−2.67B2−0.97C2。
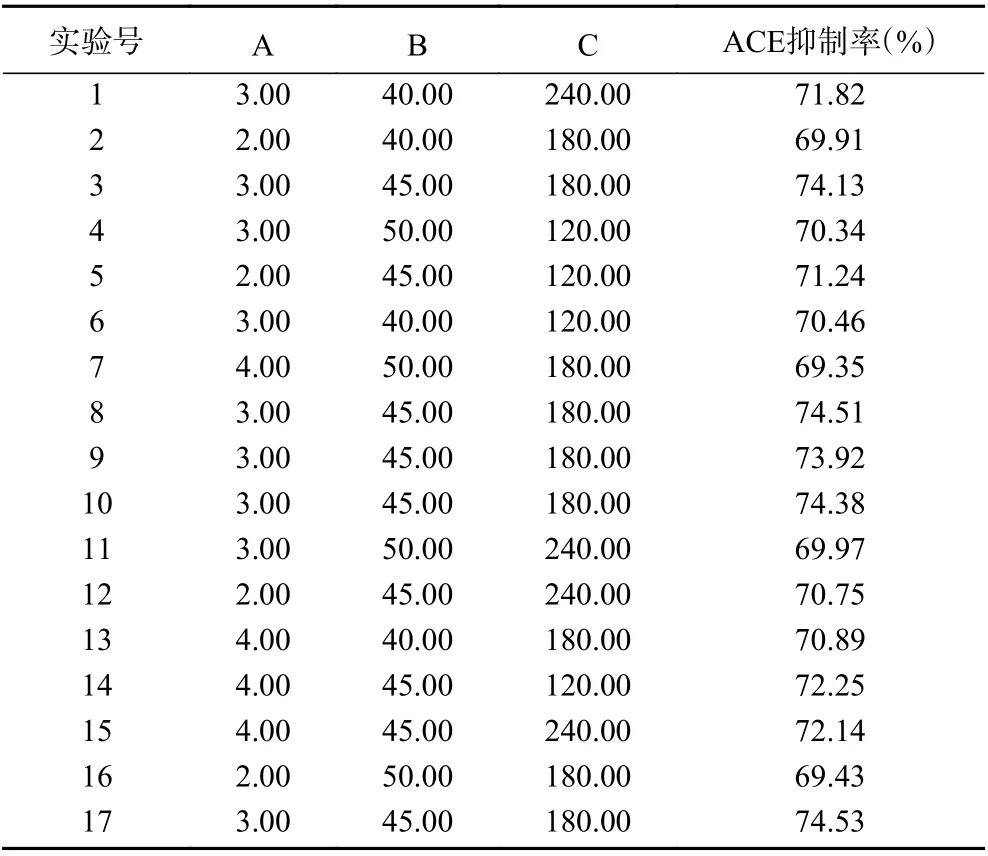
表4 Box-Behnken 试验设计及其结果Table 4 Box-Behnken experimental design and results
由表5可知,模型P<0.0001,模型的决定系数R2=0.9646,调整系数R2adj=0.9845,说明该模型的拟合度很好。三个因素的显著性影响大小依次为:酶解温度>酶解时间>超声功率。
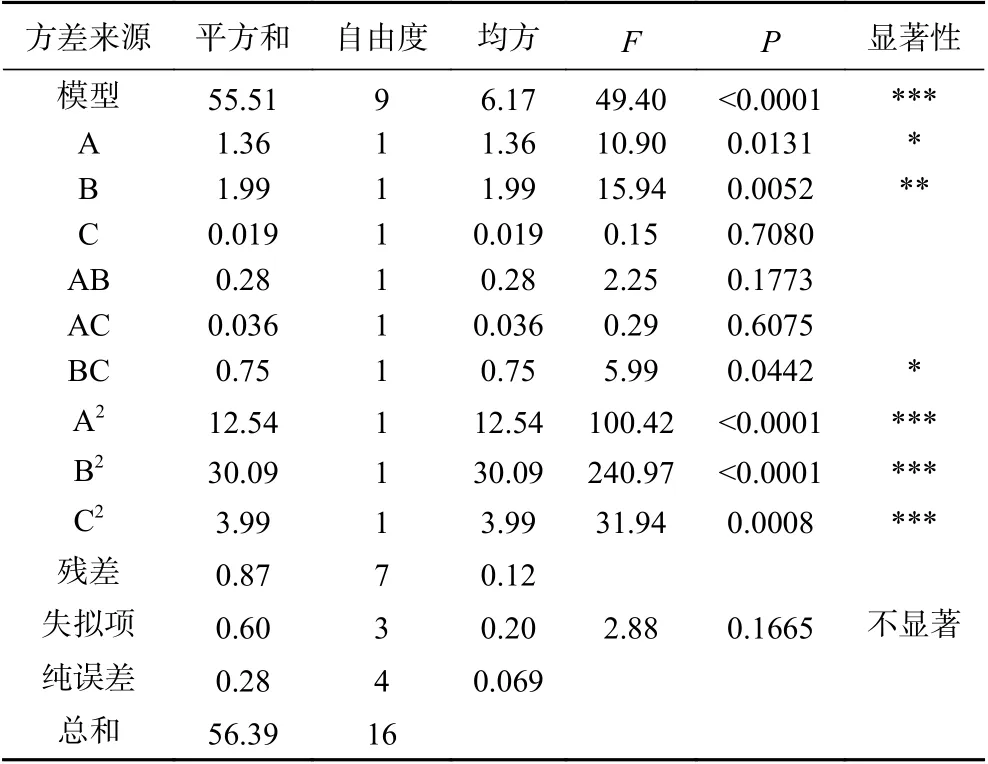
表5 响应面方差分析结果Table 5 Response surface analysis of variance results
2.4.2 双因素的交互作用 等高线图可以直观地反映两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形表示交互作用显著。
如图8所示,酶解时间与温度的交互作用三维立体图的等高线图为圆形,所以酶解时间与温度的交互作用不显著。
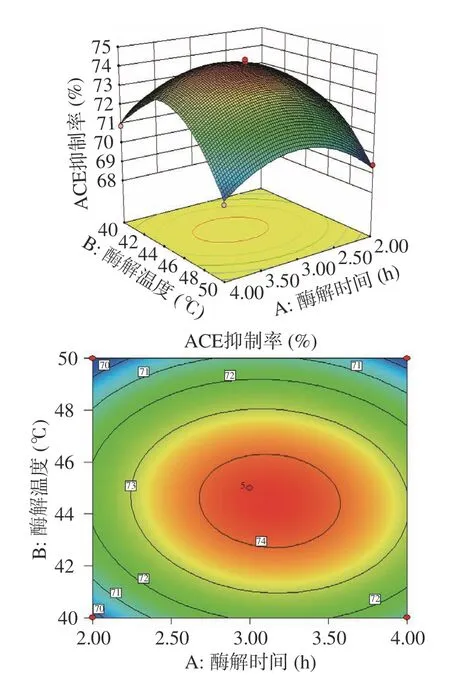
图8 酶解时间与酶解温度的交互作用Fig.8 Interaction between enzymolysis time and enzymolysis temperature
如图9所示,超声功率与酶解时间的交互作用三维立体图的等高线图为圆形,所以超声功率与酶解时间的交互作用不显著。
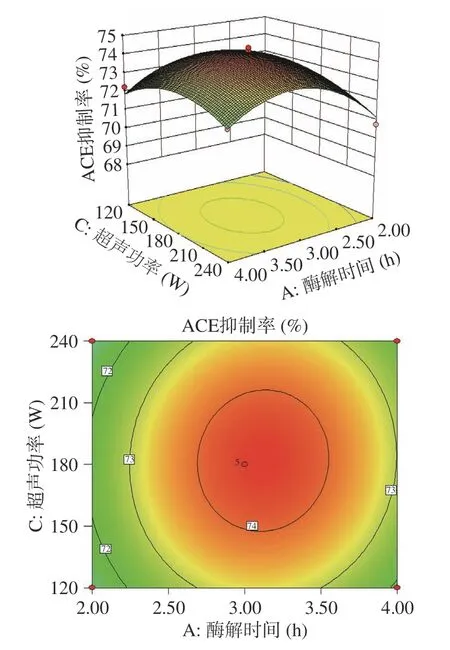
图9 超声功率与酶解时间的交互作用Fig.9 Interaction between ultrasonic power and enzymolysis time
如图10所示,超声功率与温度的交互作用三维立体图的等高线图为椭圆,所以超声功率与温度的交互作用显著。

图10 超声功率与酶解温度的交互作用Fig.10 Interaction between ultrasonic power and enzymolysis temperature
2.4.3 最佳制备参数的确认及验证 通过Design Expert8.0.6 软件进行工艺参数的优化组合,得到碱性蛋白酶酶解油莎豆蛋白制备ACE 抑制肽的最佳工艺条件为:底物浓度3%、超声功率180 W、超声处理时间20 min、加酶量5000 U/g、酶解温度45 ℃、酶解时间3 h,预测此条件下ACE 抑制率为74.45%。按照上述最佳条件进行三次验证试验,得到ACE 抑制率的平均值为74.16%。基本接近试验所获得的理论值,表明预测值和真实值之间有很好的拟合性,因此本研究中利用响应面法获得的优化工艺参数准确可靠。
3 结论
本实验在单因素实验的基础上用响应面法优化了油莎豆ACE 抑制肽的提取工艺,确定了超声辅助碱性蛋白酶法提取ACE 抑制肽的最佳条件:超声处理时间20 min、温度45 ℃、超声功率180 W、底物浓度3%、加酶量5000 U/g、酶解时间3 h,此条件下油莎豆ACE 抑制肽的抑制率为74.16%。其中对最终提取效果影响较大的因素是酶解时间、超声功率、温度,因此提取过程本质上的影响因素可以归结为酶活性的高低以及酶活性位点与蛋白结合的难易程度。本研究对酶法提取ACE 抑制肽工艺具有一定的参考价值,但是ACE 抑制实验中的抑制率还存在较大的上升空间仍需继续探索。

