杨桃根活性成分对高糖诱导H9c2心肌细胞损伤的改善作用及机制
高雨桐 吴娅妮 陈铭 张晓琳 韦秀莎 韦晓洁 黄仁彬


摘 要 目的:研究楊桃根活性成分2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮(DMDD)对高糖诱导H9c2 心肌细胞损伤的改善作用及机制。方法:将H9c2 心肌细胞分为正常组、高糖组、渗透压对照组和DMDD高、中、低浓度组(8、4、2 μmol/L)。正常组和高糖组细胞分别加入低糖(含5.5 mmol/L葡萄糖,下同)、高糖DMEM培养基(含33.3 mmol/L葡萄糖,下同)培养48 h;渗透压对照组细胞加入含27.5 mmol/L甘露醇的低糖DMEM培养基培养48 h;DMDD各浓度组细胞先加入高糖DMEM培养基培养24 h,再加入含相应浓度DMDD的高糖DMEM培养基继续培养24 h。各组细胞培养结束后,采用MTT法检测细胞存活率;采用相应试剂盒检测细胞上清液中活性氧簇(ROS)、谷胱甘肽过氧化物酶(GSH-Px)、乳酸脱氢酶(LDH)的活性;采用酶联免疫吸附法(ELISA)检测细胞上清液中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)的水平;采用吖啶橙/溴化乙锭(AO/EB)染色法检测细胞凋亡情况;采用Western blot法检测细胞中凋亡相关蛋白[活化的胱天蛋白酶3(cleaved caspase-3)、B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)]的表达水平以及核因子κB (NF-κB)/NF-κB抑制蛋白α(IκBα)信号通路相关蛋白(NF-κB p65、IκBα)的磷酸化水平。结果:与正常组比较,高糖组细胞存活率、GSH-Px活性、Bcl-2蛋白表达水平均显著降低(P<0.01); ROS、LDH活性,TNF-α、IL-6水平,Bax、cleaved caspase-3蛋白表达水平和NF-κB p65、 IκBα蛋白磷酸化水平均显著升高(P<0.01);细胞呈橙黄色荧光,且形态模糊的细胞明显增多,表现出明显的凋亡状态。渗透压对照组细胞上述指标与正常组比较差异无统计学意义。与高糖组比较,DMDD各浓度组细胞上述指标活性或水平(低浓度组细胞存活率、LDH活性除外)均显著逆转(P<0.05或P<0.01);细胞中橙黄色荧光明显减少,细胞形态较完整。结论:DMDD可改善高糖诱导的H9c2心肌细胞损伤;其作用机制可能与抑制氧化应激和炎症反应、调控凋亡相关蛋白和NF-κB/IκBα通路相关蛋白的表达有关。
关键词 2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮;糖尿病心肌病;H9c2心肌细胞;凋亡;NF-κB/IκBα信号通路
ABSTRACT OBJECTIVE: To study the improvement effects of 2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione (DMDD) from Averrhoa carambola on H9c2 myocardial cell injury induced by high glucose and its mechanism. METHODS: H9c2 myocardial cells were divided into normal group, high glucose group, osmotic pressure control group, DMDD high, medium and low concentration groups (8, 4, 2 μmol/L). Normal group and high glucose group were treated with low glucose DMEM medium (containing 5.5 mmol/L glucose, similarly hereinafter) and high glucose DMEM medium (containing 33.3 mmol/L glucose, similarly hereinafter) for 48 h, respectively. The cells in osmotic pressure control group were cultured in low glucose DMEM medium containing 27.5 mmol/L mannitol for 48 h. In DMDD groups, cells were cultured in high glucose DMEM medium for 24 h, and then in high glucose DMEM medium containing corresponding concentration of DMDD for 24 h. At the end of cell culture, MTT method was used to detect the cell survival rate. The activities of ROS, GSH-Px and LDH in cell supernatant were detected by using related kits. ELISA assay was used to detect the levels of TNF-α and IL-6 in cell supernatant. Cell apoptosis was detected by acridine orange/ethidium bromide (AO/EB) staining. Western blot assay was used to detect the expression of apoptosis related proteins (cleaved caspase-3, Bcl-2, Bax) and the phosphorylation level of nuclear factor κB (NF-κB)/NF-κB suppressor protein α (IκBα) signaling pathway related proteins (NF-κB p65, IκBα). RESULTS: Compared with the normal group, survival rate, the activity of GSH-Px and protein expression of Bcl-2 in high glucose groups were decreased significantly (P<0.01); the activities of ROS and LDH, the levels of TNF-α and IL-6, the protein expression of Bax and cleaved caspase-3, and the phosphorylation level of NF-κB p65 and IκBα were increased significantly (P<0.01); the cells showed orange yellow fluorescence, and the number of cells with fuzzy morphology increased significantly, showing an obvious apoptotic state. There was no statistical significance in above indexes of osmotic pressure control group compared with normal group. Compared with high glucose group, the activities or levels of above indexes (except for cell survival rate an LDH activity in low concentration group) were reversed significantly in DMDD groups (P<0.05 or P<0.01); the orange yellow fluorescence in the cells decreased significantly, and the cell morphology was relatively complete. CONCLUSIONS: DMDD can significantly improve H9c2 myocardial cell injury induced by high glucose; the mechanism of which may be associated with suppressing oxidative stress and inflammatory response, regulating the expression of apoptosis related protein and NF-κB/IκBα pathway related protein.
KEYWORDS 2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione; Diabetic cardiomyopathy; H9c2 myocardial cell; Apoptosis; NF-κB/IκBα signaling pathway
糖尿病心肌病是一种糖尿病心血管并发症,由机体糖代谢紊乱引发,可表现出心肌组织结构异常和心功能下降,在疾病末期常伴有充血性心力衰竭和心收缩功能不全,是目前糖尿病患者死亡的主要原因[1]。现有的研究认为,心肌细胞损伤所致的凋亡是糖尿病心肌病产生的关键因素,在整个疾病发生和发展过程中持续存在并扮演重要角色[2]。然而糖尿病心肌病的心肌细胞凋亡发生机制复杂,目前认为其与高糖引起的非酯化脂肪酸累积、活性氧簇(ROS)聚集、炎症反应及自噬紊乱等有关[3-4] 。因此,研发能有效缓解高糖所致心肌细胞损伤的药物,对于防治糖尿病心肌病具有十分重要的意义。
2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮(2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione,简称为“DMDD”)是本课题组首次从酢浆草科植物杨桃根Averrhoa carambola L.中分离出的一种活性成分[5],具有降血糖、改善血脂代谢、抗炎、抗氧化和抗肿瘤等药理作用[6-7]。經本课题组前期预实验发现,DMDD可明显改善糖尿病心肌病模型小鼠的心肌损伤,但其具体作用机制尚不明确。相关研究发现,NF-κB通路能调控H9c2心肌细胞的氧化应激、炎症反应、细胞凋亡等多个生理或病理过程,进而影响心肌损伤,是治疗糖尿病心肌病的潜在靶点[8]。基于此,本研究以高糖诱导建立H9c2心肌细胞损伤模型,研究DMDD对模型细胞的存活率、氧化应激相关因子[ROS、谷胱甘肽过氧化物酶(GSH-Px)、乳酸脱氢酶(LDH)]、炎症因子[肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)]、凋亡相关蛋白[活化的胱天蛋白酶3(cleaved caspase-3)、B细胞淋巴瘤2(Bcl-2)、Bcl-2相关X蛋白(Bax)]以及核因子κB(NF-κB)/NF-κB抑制蛋白α(IκBα)信号通路相关蛋白(NF-κB p65、IκBα)的影响,以期为DMDD治疗糖尿病心肌病提供理论基础和实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有311型CO2细胞培养箱、Micro CL17R型高速冷冻离心机(美国Thermo Fisher Scientific公司),1450型生物超净台(苏州净化设备有限公司),CKX-41型荧光倒置显微镜(日本Olympus公司),SpectraMaxPlus384型多功能酶标仪(香港分子仪器有限公司),Odysse Clx型双色红外荧光成像仪(美国Li-COR公司),Mini PROTEAN?Tetra Cell型电泳槽(美国Bio- Rad公司)。
1.2 主要药品与试剂
本研究所用DMDD由本实验室自制,纯度不低于80%;低糖DMEM 培养基、胰蛋白酶(批号分别为8120459、2120539)均购自美国Gibco公司;青链霉素混合液、磷酸盐缓冲液(PBS)、MTT试剂(批号分别为20190306、20200804、715F0527)均购自北京索莱宝科技有限公司;胎牛血清(批号A58G00J)购自美国Gemini公司;BCA蛋白浓度检测试剂盒(批号P0010S)购自上海碧云天生物技术有限公司;兔抗GAPDH多克隆抗体、兔抗cleaved caspase-3多克隆抗体、兔抗Bax多克隆抗体、兔抗Bcl-2多克隆抗体、兔抗IκBα多克隆抗体(批号分别为00083125、00077110、00089105、00093692、00091696)均购自美国Proteintech公司;兔抗NF-κB p65多克隆抗体(批号CN89330)购自南京巴傲得生物科技有限公司;兔抗磷酸化NF-κB p65(p-NF-κB p65)多克隆抗体、兔抗磷酸化IκBα(p-IκBα)多克隆抗体、DyLightTM 800荧光标记的山羊抗兔免疫球蛋白二抗(批号分别为3033S、2859S、5151)均购自美国Cell Signaling Technology公司;吖啶橙/溴化乙锭(AO/EB)双荧光染色试剂盒(批号0629A20)购自北京雷根生物技术有限公司;小鼠ROS、IL-6、TNF-α酶联免疫试验试剂盒(批号分别为Oct2019、Oct2019、Oct2019)购自上海泛柯实业有限公司;LDH检测试剂盒、GSH-Px检测试剂盒(批号分别为20190910、20190905)均购自南京建成生物工程研究所;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
本研究所用大鼠H9c2心肌细胞购自中国科学院上海生科院细胞资源中心。
2 方法
2.1 细胞培养
将大鼠H9c2心肌细胞培养于含10% 胎牛血清和1%青-链霉素的低糖DMEM培养基(含5.5 mmol/L葡萄糖,下同)中,置于 37 ℃、5%CO2培养箱中培养至融合度达70%~80%时,以含0.25%乙二胺四乙酸(EDTA)的胰酶消化并传代培养,取对数生长期的细胞进行后续实验。
2.2 分组、造模与给药
参考文献[9]的方法,将对数生长期的H9c2心肌细胞分为正常组、高糖组、渗透压对照组(以考察由高糖引起的渗透压改变是否会造成细胞损伤)和DMDD高、中、低浓度组(8、4、2 μmol/L,浓度根据本课题组前期研究结果设置)。正常组和高糖组细胞分别加入低糖、高糖(含33.3 mmol/L葡萄糖,下同)DMEM培养基培养48 h;渗透压对照组细胞加入含27.5 mmol/L甘露醇的低糖DMEM培养基培养48 h;DMDD各浓度组细胞先加入高糖DMEM培养基培养24 h后,再加入含相应浓度DMDD的高糖DMEM培养基继续培养24 h。
2.3 H9c2心肌细胞存活率的检测
取对数生长期的H9c2心肌细胞,以5×104 mL-1的密度接种于96孔板中,每孔100 μL,按“2.2”项下方法分组、造模与给药,另设不含培养基和细胞的空白组,每组设置3个复孔。各组细胞培养结束后,每孔加入含 10% MTT的低糖DMEM 培养基100 μL,继续培养4 h;弃去培养基,加入二甲基亚砜(DMSO)150 μL,避光振荡15 min;采用酶标仪于 490 nm波长下检测每孔吸光度(OD)值,并计算细胞存活率[细胞存活率(%)=(实验组OD值-空白组OD值)/(正常组OD值-空白组OD值)×100%]。
2.4 H9c2心肌细胞上清液中ROS、GSH-Px和LDH活性的检测
取对数生长期的H9c2心肌细胞,以5×104 mL-1的密度接种于96孔板中,每孔100 μL,按“2.2”项下方法分组、造模与给药,每组设置3个复孔。各组细胞培养结束后,收集培养液,于4 ℃条件下以3 000 r/min离心10 min;取上清液,按相应试剂盒说明书方法操作,然后采用酶标仪分别于450、412、450 nm波长下,检测细胞上清液中ROS、GSH-Px、LDH的活性。
2.5 H9c2心肌细胞上清液中TNF-α和IL-6水平的检测
采用ELISA法进行检测。取对数生长期的H9c2心肌細胞,以5×104 mL-1的密度接种于96孔板中,每孔100 μL,按“2.2”项下分组、造模与给药,每组设置3个复孔。各组细胞培养结束后,收集培养液,于4 ℃条件下以3 000 r/min离心10 min;取上清液,按相应试剂盒说明书方法操作,采用酶标仪于450 nm波长下,检测细胞上清液中TNF-α和IL-6的水平。
2.6 H9c2心肌细胞凋亡情况的检测
采用AO/EB染色法进行检测。取对数生长期的H9c2心肌细胞,以1×105 mL-1的密度接种于6孔板中,每孔1 mL,按“2.2”项下方法分组、造模与给药,每组设3个复孔。各组细胞培养结束后,按试剂盒说明书相关方法染色5 min,然后采用荧光显微镜观察各组细胞的凋亡情况(AO能透过正常细胞的细胞膜,从而嵌入细胞核使细胞呈绿色荧光;EB仅能透过受损细胞的细胞膜,从而嵌入细胞核使细胞呈橘红色荧光)。
2.7 H9c2心肌细胞中凋亡相关蛋白表达和NF-κB/IκBα通路相关蛋白磷酸化水平的检测
采用Western blot法进行检测。将对数生长期的H9c2心肌细胞,接种到直径为70 mm的培养皿中,待细胞生长至融合度达80% 时,按“2.2”项下方法分组、造模与给药。各组细胞培养结束后,弃去培养液,以PBS 洗涤3次,加入裂解液于冰上充分裂解细胞15 min后,于4 ℃条件下以 12 000 r/min离心15 min;收集上清液,采用BCA蛋白浓度检测试剂盒测定蛋白浓度。蛋白经变性处理后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜;以TBST缓冲液清洗5 min×3次,加入cleaved caspase-3、Bax、Bcl-2、NF-κB p65、p-NF-κB p65、IκBα、p-IκBα、GAPDH的一抗(稀释度均为1 ∶ 1 000),于4 ℃条件下孵育过夜;以 TBST 洗涤5 min×3次,加入二抗(稀释度为1 ∶ 5 000),室温孵育1 h,置于双红外荧光成像仪中成像。采用Image J 1.8.0软件进行分析,以p-NF-κB p65与NF-κB p65的蛋白灰度值比值、p-IκBα与IκBα的蛋白灰度值比值分别表示NF-κB p65、IκBα蛋白的磷酸化水平,以Bcl-2、Bax、cleaved caspase-3与内参GADPH的蛋白灰度值比值表示3种蛋白的表达水平。实验重复3次。
2.8 统计学方法
采用SPSS 17.0 软件对数据进行统计分析,结果以x±s表示。多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
3.1 DMDD对高糖诱导的H9c2心肌细胞存活率的影响
与正常组比较,高糖组细胞存活率显著降低(P<0.01),渗透压对照组细胞存活率差异无统计学意义(P>0.05);与高糖组比较,DMDD高、中浓度组细胞存活率均显著升高(P<0.01),详见表1。
注:与正常组比较,**P<0.01;与高糖组比较,##P<0.01
Note:vs. normal group,**P<0.01; vs. high glucose group,##P<0.01
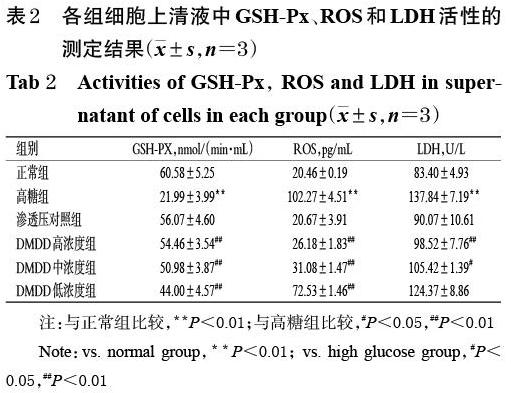
3.2 DMDD对高糖诱导的H9c2心肌细胞上清液中ROS、GSH-Px和LDH活性的影响
与正常组比较,高糖组细胞上清液中ROS、LDH活性均显著升高,GSH-Px活性显著降低(P<0.01),而渗透压对照组细胞上清液中上述指标活性差异无统计学意义(P>0.05);与高糖组比较,DMDD各浓度组细胞上清液中ROS、LDH(低浓度组除外)活性显著降低(P<0.05或P<0.01),GSH-Px活性均显著升高(P<0.01),详见表2。
注:与正常组比较,**P<0.01;与高糖组比较,#P<0.05,##P<0.01
Note:vs. normal group,**P<0.01; vs. high glucose group,#P<0.05,##P<0.01
3.3 DMDD对高糖诱导的H9c2心肌细胞上清液中TNF-α和IL-6水平的影响
与正常组比较,高糖组细胞上清液中TNF-α和IL-6水平均显著升高(P<0.01),渗透压对照组上述指标水平差异无统计学意义(P>0.05);与高糖组比较,DMDD各浓度组细胞上清液中TNF-α和IL-6水平均显著降低(P<0.01),详见表3。
3.4 DMDD对高糖诱导的H9c2心肌细胞凋亡的影响
正常组细胞的细胞膜光滑,细胞核完整;高糖组细胞呈橙黄色荧光,且形态模糊的细胞较正常组明显增多,表现出明显的凋亡状态;渗透压对照组细胞无明显的凋亡状态;DMDD各浓度组细胞的橙黄色荧光较高糖组明显减弱,且细胞形态较完整,详见图1。
3.5 DMDD对高糖诱导的H9c2心肌细胞中凋亡相关蛋白和NF-κB/IκBα通路相关蛋白表达的影响
与正常组比较,高糖组细胞中Bcl-2蛋白表达水平显著降低(P<0.01),Bax、cleaved caspase-3蛋白表达水平和NF-κB p65、IκBα蛋白磷酸化水平均显著升高(P<0.01),而渗透压对照组上述蛋白表达水平或磷酸化水平差异无统计学意义(P>0.05);与高糖组比较,DMDD各浓度组细胞中Bcl-2蛋白表达水平均显著升高(P<0.05或P<0.01),Bax、cleaved caspase-3蛋白表达水平和NF-κB p65、IκBα蛋白磷酸化水平均显著降低(P<0.05或P<0.01),详见图2、图3、表4。
4 讨论
氧化应激和炎症反应均是糖尿病心肌病产生、恶化的关键因素;氧化应激是由于ROS的过度生成和(或)清除减少,导致机体内的ROS相对过剩;当糖尿病患者体内的ROS长期过量时,会诱发DNA、蛋白质、脂质等生物大分子损伤,进而引起心脏炎症、心肌肥厚及心血管功能的病变,从而诱导糖尿病心肌病的发生[10-11]。有研究表明,ROS活性的升高在高糖诱导的H9c2心肌细胞的凋亡过程中具有重要作用[12]。GSH-Px是机体的清除剂,能特异性地清除过氧自由基、超氧阴离子等,从而减轻ROS造成的损伤[13]。LDH主要存在于细胞内,当细胞受损时,LDH会泄漏至细胞外,故可作为反映细胞损伤程度的指标[7]。本研究发现,DMDD可显著降低高糖诱导的H9c2心肌细胞上清液中ROS、LDH的活性,升高GSH-Px的活性。这表明DMDD对高糖诱导的H9c2心肌细胞损伤的改善作用,可能与抑制氧化应激反应有关。
相关研究发现,促炎因子IL-6和TNF-α在糖尿病心肌病的发病机制中也具有重要的作用[8, 14]。当糖尿病患者体内TNF-α水平升高时,可损害其胰岛素信号传导功能和心肌功能;当TNF-α水平降低时,可减轻心肌炎症和心肌纤维化程度,进而改善心功能[14]。另有研究发现,当糖尿病模型小鼠体内IL-6水平降低时,其心功能改善、间质纤维化减轻[15]。本研究发现,DMDD可降低高糖诱导的H9c2心肌细胞上清液中IL-6、TNF-α水平。这表明DMDD对高糖诱导的H9c2心肌细胞损伤的改善作用,可能与抑制炎症因子表达有关。
促凋亡因子caspase-3在细胞凋亡途径中发挥着至关重要的作用:当细胞凋亡发生时,凋亡信号通过级联反应汇聚于caspase-3酶原,然后使该酶原发生裂解、活化,从而获得凋亡执行能力[16]。另外,凋亡的发生也与Bcl-2蛋白家族密切相关,其中Bcl-2、Bax之间的动态平衡是界定细胞凋亡发生的重要指标[17-18]。本研究发现,DMDD可升高高糖诱导的H9c2心肌细胞中cleaved caspase-3、Bax蛋白的表达水平,降低Bcl-2蛋白的表达水平。这表明DMDD对高糖诱导的H9c2心肌细胞损伤的改善作用,可能与调控凋亡相关蛋白的表达有关。
NF-κB是一种核转录因子,当机体发生应激、炎症时均可将其激活;IκB蛋白家族是NF-κB的抑制蛋白,当细胞处于静息状态时,细胞质中NF-κB 的p65亚基或p50亚基会与IκB结合,从而在细胞质中形成多聚体复合物,使NF-κB蛋白活性受到抑制;当细胞受到刺激时,IκBα被蛋白酶降解,使得NF-κB与IκB形成的多聚体逐渐解离,最终激活NF-κB信号通路[9,19]。本研究发现,与正常组比较,高糖组H9c2心肌细胞中NF-κB p65、IκBα蛋白的磷酸化水平均显著升高,说明NF-κB/IκBα通路被激活;经DMDD干预后,H9c2心肌细胞中NF-κB p65、IκBα蛋白的磷酸化水平均显著降低。这表明DMDD对高糖诱导的H9c2心肌细胞损伤的改善作用,可能与抑制NF-κB/IκBα通路相关蛋白的表达有关。
综上所述,DMDD可改善高糖诱导的H9c2心肌细胞损伤;其作用机制可能与抑制氧化应激和炎症反应、调控凋亡相关蛋白和NF-κB/IκBα通路相关蛋白的表达有关。
参考文献
[ 1 ] DILLMANN W H. Diabetic cardiomyopathy:what is it and can it be fixed?[J]. Circ Res,2019,124(8):1160-1162.
[ 2 ] JIA G,HILL M A,SOWERS J R. Diabetic cardiomyopathy an update of mechanisms contributing to this clinical entity[J]. Circ Res,2018,122(4):624-638.
[ 3 ] CIELUCH A,URUSKA A,ZOZULINSKA-ZIOLKIEWICZ D. Can we prevent mitochondrial dysfunction and diabetic cardiomyopathy in type 1 diabetes mellitus? Pathophysio- logy and treatment options[J]. Int J Mol Sci,2020,21(8):2852.
[ 4 ] 王靜娜,侯瑞田,史亦男,等.糖尿病心肌病发病机制及病理改变研究进展[J].心血管病学进展,2016,37(4):412- 415.
[ 5 ] 温庆伟.杨桃根化学成分及其降血糖活性的研究[D].南宁:广西医科大学,2013.
[ 6 ] LU S,ZHANG H,WEI X,et al. 2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione isolated from Averrhoa ca- rambola L. root ameliorates diabetic nephropathy by inhi- biting the TLR4/MyD88/NF-κB pathway[J]. Diabetes Metab Syndr Obes,2019,12:1355-1363.
[ 7 ] ZHOU X,WU X,QIN L,et al. Anti-breast cancer effect of 2-dodecyl-6-methoxycyclohexa-2,5-diene-1,4-dione in vivo and in vitro through MAPK signaling pathway[J]. Drug Des Devel Ther,2020,14:2667-2684.
[ 8 ] 王鑫焱.解毒通络方对实验性糖尿病心肌病变大鼠PPARγ- NF-κB-炎症因子信号通路的干预研究[D].长春:长春中医药大学,2017.
[ 9 ] LUO B B,LI B,WANG W K,et al. NLRP3 gene silen- cing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model[J]. PLoS One,2014,9(8):e104771.
[10] FARIA A,PERSAUD S J. Cardiac oxidative stress in diabetes:mechanisms and therapeutic potential[J]. Pharmacol Ther,2017,172:50-62.
[11] WU H,SHENG Z Q,XIE J,et al. Reduced HMGB 1-mediated pathway and oxidative stress in resveratrol-treated diabetic mice:a possible mechanism of cardioprotection of resveratrol in diabetes mellitus[J/OL]. Oxid Med Cell Longev,2016,2016:9836860[2021-01-24]. https://pub- med.ncbi.nlm.nih.gov/27833703/.DOI:10.1155/2016/9836860.
[12] YAN X,XUN M,LI J,et al. Activation of Na+/K+-ATPase attenuates high glucose-induced H9c2 cell apoptosis via suppressing ROS accumulation and MAPKs activities by DRm217[J]. Acta Biochim Biophys Sin (Shanghai),2016,48 (10):883-893.
[13] SUN T,ZHANG Y,ZHONG S,et al. N-n-butyl haloperidol iodide,a derivative of the anti-psychotic haloperidol,antagonizes hypoxia/reoxygenation injury by inhibiting an Egr-1/ROS positive feedback loop in H9c2 cells[J]. Front Pharmacol,2018,9:19.
[14] 梁俭,骆杰炉,蔡庆群,等.基于不同Caspase凋亡通路的玄参环烯醚萜总苷抑制心肌梗死模型大鼠心肌细胞凋亡的作用机制研究[J].中国药房,2019,30 (6):735-740.
[15] ZHANG Y,WANG J H,ZHANG Y Y,et al. Deletion of interleukin-6 alleviated interstitial fibrosis in streptozotocin-induced diabetic cardiomyopathy of mice through affecting TGFβ1 and miR-29 pathways[J]. Sci Rep,2016,6:23010.
[16] KHALILZADEH B,SHADJOU N,KANBEROGLU G S,et al. Advances in nanomaterial based optical biosensing and bioimaging of apoptosis via caspase-3 activity:a review[J]. Mikrochim Acta,2018,185 (9):434.
[17] SHU Y,YANG Y,ZHAO Y,et al. Melittin inducing the apoptosis of renal tubule epithelial cells through upregulation of Bax/Bcl-2 expression and activation of TNF-α signaling pathway[J/OL]. Biomed Res Int,2019,2019:9450368[2021-01-24]. https://pubmed.ncbi.nlm.nih.gov/31772938/. DOI:10.1155/2019/9450368.
[18] SRIVASTAVA R,CAO Z,NEDEVA C,et al. Bcl-2 family protein BOK is a positive regulator of uridine metabolism in mammals[J]. Proc Natl Acad Sci U S A,2019,116(31):15469-15474.
[19] PATRUNO A,FRANCESCHELLI S,PESCE M,et al. Novel aminobenzyl-acetamidine derivative modulate the differential regulation of NOSs in LPS induced inflammatory response:role of PI3K/Akt pathway[J]. Biochim Biophys Acta,2012,1820 (12):2095-2104.
(收稿日期:2021-02-24 修回日期:2021-05-06)
(編辑:唐晓莲)

