基于铂纳米颗粒@金属有机骨架纳米模拟酶的无标记电化学赭曲霉毒素适体传感器的构建
李 梅,夏晓娟,陈志雄,杨 梦,李紫滢,杨 通,孟 爽,杨云慧,胡 蓉
(云南师范大学化学化工学院,昆明650500)
近年来,真菌毒素的污染情况已变得日益严峻,引起了全球范围内的广泛关注.据统计,世界上约25%的农产品均受到真菌毒素不同程度的污染,给人类的健康带来了不利影响[1~3].在农产品普遍存在的真菌毒素中,赭曲霉毒素是其中一类较为典型且常见的真菌毒素,共包含7种结构类似物.其中,以赭曲霉毒素A(OTA)的污染较为严重,毒性最大,且OTA是一种高度稳定的化合物,普遍存在于花生、谷物、玉米、蔬菜等人类和动物的食物供应链中[4].OTA由于具有肾毒性、肝毒性、致畸性、免疫抑制和致癌性,已被国际癌症研究机构列为了2B类致癌物质[5].此外,由于OTA与人体内必需氨基酸苯丙氨酸的结构相似,会间接地通过影响人体肾脏和肝脏中苯丙氨酸羟化酶的活性,从而阻碍人体内蛋白质、DNA以及RNA的合成[6,7].我国的食品国家安全标准对OTA在食品中的含量作了明确规定:在谷物、豆类、坚果及其制品中的含量不超过5 μg/kg,在饮料中的限量浓度为5~10 μg/kg[8].目前,已开发出了表面增强拉曼光谱法[9]、酶联免疫吸附法[10]、毛细管装置检测法[11]及荧光分析法等多种OTA检测方法[12].这些方法精确、高效,但存在成本高、不易携带、需专业技术人员等缺点,限制了其在真菌毒素检测中的应用.因此,开发简便快捷、灵敏度高且重现性好的OTA现场检测技术显得非常重要.
纳米酶是一种仿生纳米材料,它与天然酶一样具有催化生化反应的能力,与天然酶相比,纳米酶具有稳定性好、成本效益高及易修饰等特点,因而成为天然酶的替代物.自2007年发现Fe3O4纳米酶以来,科研人员已开发出多种具有类酶活性的纳米材料,并应用于生物传感、疾病诊断和环境污染物检测等多个领域中[13].其中,纳米酶在生物传感器中的应用处于领先地位,其作为天然酶的一种优良替代物,已被用于以类似酶的方式产生和放大信号,并用于构建生物传感器[14].迄今,基于纳米酶催化介导产生信号的不同模式,已开发出多种基于纳米模拟酶的新型生物传感器,包括比色生物传感器、荧光生物传感器、化学发光生物传感器、电化学生物传感器和表面增强拉曼散射(SERS)等[15~18].
金属有机骨架(MOFs)是一类重要的无机有机杂化晶体,独特的组成、多样性的结构和可调的尺寸使其在纳米酶领域展现出潜在的应用价值.MOFs具有高密度和分散均匀的活性中心以及多孔结构和多通道,有利于小分子底物进入到孔道中与活性中心充分接触,同时有利于产物的扩散和转移.MOFs还具有优良的模拟酶催化性能,引起了广泛关注[19,20].研究发现,典型的过渡金属离子如铁、铜、锰和钴与对苯二甲酸(H2BDC)及1,3,5-均苯三甲酸(H3BTC)等有机配体反应所制备的MIL-53,MIL-88等多种MIL型MOFs都具有模拟酶的性质.此外,一些贵金属纳米颗粒,如Pt NPs,Au NPs,Ag NPs和Pd NPs均具有模拟酶活性,将纳米粒子内嵌到MOFs结构中可以增强纳米粒子的模拟酶活性,如Au NPs和Ag NPs的表面增强拉曼散射(SERS)活性[21,22].
本文将Mn2+和2,5-二羟基对苯二甲酸置于高压反应釜中反应,制备了具有过氧化物酶活性的Mn-MOF-74,将铂纳米颗粒负载在Mn-MOF-74上制得Pt NPs@Mn-MOF纳米复合材料,并利用其模拟酶活性在丝网印刷电极上构建了一种无标记电化学适体传感器,用于OTA的定量检测.将具有优良催化性能的Pt NPs负载到Mn-MOF结构上,不仅有利于协同提高纳米酶的催化活性,还可用于固定修饰有巯基的OTA适体.在H2O2存在的条件下,Pt NPs@Mn-MOF可催化H2O2还原而产生电流变化,并通过计时电流法来测定Pt NPs@Mn-MOF对H2O2的电流响应.由于加入的检测目标物OTA与适体形成闭环结构,封闭了Pt NPs@Mn-MOF的部分催化活性位点,导致纳米酶的催化活性降低,电流响应信号减小,从而实现了OTA的定量检测.当OTA浓度在0.01~300 ng/mL范围内,电流响应信号与OTA浓度成反比.该传感器选择性好、灵敏度高,检出限低至3.33 pg/mL,且可用于真实玉米样品中OTA的检测,在真菌毒素检测以及其它小分子检测领域中展现出良好的应用前景.
1 实验部分
1.1 试剂与仪器
四水合氯化锰(MnCl4˙4H2O)、2,5-二羟基对苯二甲酸和赭曲霉毒素A(OTA)购于美国Sigma公司;氯铂酸(H2PtCl6)购于上海源叶生物科技有限公司;无水乙醇(C2H6OH)购于天津市风船化学试剂科技有限公司;双氧水(H2O2)购于北京百灵威科技有限公司;OTA aptamer 5'-SH-GATCGGGTGTGGGTGGCGTAAAGGGAGCATCGGACA-3'购于生工生物工程(上海)股份有限公司.实验用水均为去离子水;玉米粉购自当地超市.
丝网印刷电极(参比电极为Ag/AgCl电极)购于百胜仪器(广州)有限公司;计时电流(i-t)曲线,循环伏安(CV)曲线和电化学阻抗谱(EIS)通过U盘式电化学工作站(Sensit Smart,PalmSens BV公司)测试得到;JEM-2100型透射电子显微镜(TEM,日本JEOL有限公司);UV-8000S型紫外-可见吸收光谱仪(UV-Vis,上海元析仪器有限公司);DX-2700型X射线粉末衍射仪(XRD,丹东方圆仪器有限公司).
1.2 材料的制备
1.2.1 金属有机骨架(Mn-MOF-74)的合成参照文献[23]方法,称取0.8784 g MnCl4·4H2O和0.2664 g 2,5-二羟基对苯二甲酸加入120 mL体积比为15∶1∶1的DMF/乙醇/水混合溶液中,将其超声溶解后,转移到高压反应釜中.将高压反应釜转移至鼓风干燥箱中,于135℃反应24 h,反应结束后冷却至室温,采用DMF和甲醇分别离心洗涤2次,最后将红棕色的固体置于真空干燥箱中于200℃干燥过夜,得到棕色固体粉末状Mn-MOF-74.
1.2.2 铂纳米颗粒(Pt NPs)的合成参照文献[24]方法,在圆底烧瓶中加入40 mL去离子水和1 mL 1%的H2PtCl6,经超声分散均匀后加热搅拌至沸腾,然后向反应瓶中缓慢加入1%的柠檬酸三钠(6 mL),继续加热40 min,溶液逐渐变为咖啡色时停止加热,冷却至室温后于4℃保存备用.
1.2.3 Pt NPs@Mn-MOF-74的合成称取10 mg Mn-MOF-74固体粉末置于小棕色瓶中,加入1 mL铂纳米颗粒溶胶,常温下搅拌48 h使Pt纳米颗粒充分吸附在Mn-MOF-74上,产物置于4℃下保存备用.
1.2.4 玉米样品液的制备称取5 g未受污染的玉米粉溶于10 mL浓度为90%的甲醇溶液中,密封后将其置于室温下搅拌30 min,在用孔径为0.22 μm的滤膜进行过滤,收集滤液,所得滤液以1∶20的比例用重蒸水稀释后置于4℃环境下保存备用.
1.3 检测原理
利用Pt NPs@Mn-MOF-74纳米复合材料的类过氧化物酶特性,借助壳聚糖的成膜性将该纳米复合材料修饰到丝网印刷电极的表面,然后将修饰有巯基的OTA适体链固定在电极表面的Pt NPs上;加入目标分子OTA,由于OTA分子与适体形成闭合结构封闭了Pt NPs@Mn-MOF-74的部分催化活性位点,导致纳米酶的催化活性降低,因此电流响应信号减小,最后通过U盘式小型电化学工作站采用计时电流法检测电流变化,从而实现对OTA的定量检测.该传感器的检测原理如Scheme 1所示.

Scheme 1 Schematic diagram of the construction of label⁃free OTA aptasensor
1.4 检测方法
将丝网印刷电极的表面用去离子水冲洗60 s,室温下晾干,重复操作2次.将电极片置于乙醇溶液中浸泡15 min,用去离子水冲洗晾干,除去电极表面的氧化膜以活化电极.将0.5%的壳聚糖和Pt NPs@Mn-MOF-74按体积比1∶1混合,取8 μL混合液滴加到电极表面,室温下晾干,然后在电极上滴加8 μL浓度为1 μmol/L修饰有巯基的OTA适体链,置于37℃恒温水浴箱中培育90 min,通过Pt NPs与OTA适体上的巯基形成化学键而将OTA适体固定在电极表面.培育完成后,用100 μL Tris-HCl缓冲溶液(pH=7.0)冲洗电极表面并于室温下晾干,以除去未结合的OTA适体,然后在电极上滴加8 μL 1%的β-巯基乙醇(MCH)并于37℃恒温水浴箱中培育90 min以封闭非特异性结合位点.用100 μL pH=7.0的Tris-HCl缓冲溶液冲洗电极并吹干,最后在电极表面滴加8 μL不同浓度的检测目标物OTA,于37℃恒温水浴箱中培育90 min后,取出电极并用Tris-HCl缓冲溶液冲洗,除去未结合的OTA小分子.将电极片插在U盘式小型电化学工作站上,并在电极上滴加100 μL Tris-HCl缓冲溶液,采用计时电流法测定Pt NPs@Mn-MOF对加入的2 μL浓度为1 mol/L的H2O2的电流响应值.
2 结果与讨论
2.1 Mn⁃MOF⁃74材料的表征
2.1.1 X射线衍射(XRD)分析采用XRD仪对Mn-MOF-74的结构进行了表征,其与标准XRD谱图的对比结果[23]如图1所示.可以发现,两者的出峰位置一致,证明确已制备出Mn-MOF-74.
2.1.2 傅里叶变换红外光谱(FTIR)表征通过FTIR对Mn-MOF-74的结构进行了表征,谱图如图2所示.Mn-MOF-74通过金属离子与有机配体中的羧酸盐配位形成,在1552 cm−1和1386—1409 cm−1处的吸收带归属于羧酸化配体(COO—)的对称和不对称特征伸缩振动,与文献[25]报道中Mn-MOF-74的COO—的振动模式一致,证明Mn-MOF-74的成功合成.

Fig.1 XRD patterns of Mn⁃MOF⁃74(a)and the simulated(b)
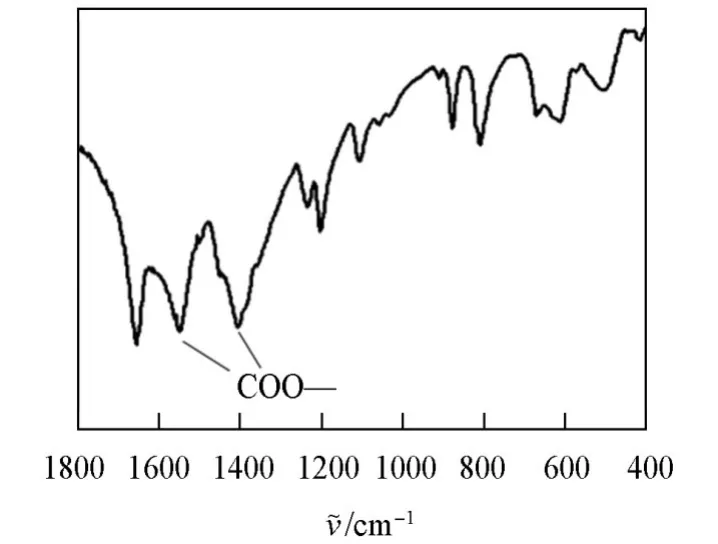
Fig.2 FTIR spectrum of Mn⁃MOF⁃74
2.1.3 微观形貌表征采用扫描电子显微镜(SEM)对Mn-MOF-74的微观形貌进行了表征,同时通过透射电子显微镜(TEM)观察了复合材料Pt NPs@Mn-MOF-74的微观形貌,结果如图3所示.图3(A1~A3)和(B1,B2)显示,Mn-MOF-74呈现花状、正方体状及尖端棒状等多种形貌.由图3(C1)可见,Mn-MOF-74在掺杂Pt NPs后其晶体结构有所改变,由掺杂前大小不等、形貌不一的晶体颗粒变成了细小颗粒,且从图3(C2)可以观察到Pt NPs均匀地负载到了Mn-MOF-74的表面,其粒径约为1 nm.

Fig.3 SEM images of Mn⁃MOF⁃74(A1—A3,B1,B2)and TEM images of Pt NPs@Mn⁃MOF⁃74(C1,C2)
2.2 可行性分析
对本实验设计的方案进行了可行性验证实验.图4(A)示出了所制备的无标记电化学适体传感器在pH=7.0的Tris-HCl缓冲溶液中,采用计时电流法测得的有、无检测目标物OTA时的电流响应信号变化曲线.曲线a为不加检测目标物OTA时的电流响应信号曲线(空白实验),曲线b是加入浓度为200 ng/mL的检测目标物OTA时的电流响应信号曲线,可见,传感器对H2O2还原的催化电流响应信号明显降低,可以归因为当体系中加入检测目标物OTA后,由于OTA与适体链特异性识别,形成闭环式结构,封闭了电极上纳米模拟酶Pt NPs@Mn-MOF-74的催化活性位点.以上结果证明本实验方案具有可行性.在相同条件下又分别对Pt NPs,10 mg/mL的Mn-MOF-74及10 mg/mL的Pt NPs@Mn-MOF-74纳米模拟酶的催化活性进行了测定,结果如图4(B)所示.可见,掺杂了Pt NPs后的Mn-MOF-74具有更好的催化活性,这可能是由于两者掺杂后,协同提高了纳米酶的催化作用,同时也证明实验采用的纳米酶掺杂联用策略有效提高了纳米模拟酶的催化活性.
2.3 不同修饰电极表面的交流阻抗行为与循环伏安行为

Fig.4 Feasibility analysis of the experimental scheme(A)and catalytic activity analysis of nanomimetic enzyme(B)

Fig.5 AC impedance curves(A)and cyclic voltammetryvolt⁃ampere curves(B)measured at 5 mmol/L[K3Fe(CN)6]/[K4Fe(CN)6]with different modified electrodes
为了探究该传感器是否修饰成功,采用电化学交流阻抗法(EIS)和循环伏安法(CV)表征了电极表面的层层修饰过程.图5为在5 mmol/L的K3Fe(CN)4/K4Fe(CN)6溶液中测得的不同电极修饰界面的EIS曲线[图5(A)]及CV曲线[图5(B)].图5(A)中曲线a为裸丝网印刷电极的EIS曲线(Rct=1600 Ω);曲线b为修饰了Pt NPs@Mn-MOF-74纳米复合材料的电极的EIS曲线,由于Pt NPs@Mn-MOF-74的导电性较好,因而阻抗值最小(Rct=800 Ω);曲线c为在基底上滴加了OTA适体链后的EIS曲线,由于DNA链不导电,导致阻抗值增大(Rct=2300 Ω);曲线d为使用MCH封闭非特异性结合位点后的EIS曲线,由于MCH不导电,因而阻抗值进一步增大(Rct=2800 Ω);曲线e是在曲线d的基础上滴加检测目标OTA后的EIS曲线,由于OTA是不导电小分子,且OTA与适体链特异性识别,形成闭环式结构,阻碍电子传递,因此阻抗值最大(Rct=3600 Ω).以上结果表明,该传感器层层修饰成功.
为进一步证实该传感器层层修饰成功,采用CV法对其进行了表征.图5(B)中曲线a为裸丝网印刷电极的CV曲线,曲线b为修饰了Pt NPs@Mn-MOF纳米酶的电极的CV曲线,纳米酶不仅具有催化性能,同时具有良好的导电性能,因而此时的电流值最大;曲线c是在修饰了纳米酶的电极上(Pt NPs@Mn MOF-74/SPE)滴加OTA适体链后的CV曲线,由于适体链不导电以及链中的带负电荷的磷酸基团对Fe(CN)63−/4−的负负排斥,因而电流值减小;曲线d为采用MCH封闭非特异性结合位点后的CV曲线,MCH是不导电物质,导致电流值进一步减小;曲线e为滴加OTA后的CV曲线,由于OTA不导电,所以此时的电流值最小,CV表征再一次证实所构建的传感器层层修饰成功.
2.4 实验条件的优化
2.4.1 纳米酶浓度的影响纳米酶的浓度是影响传感器性能的关键因素,因此对其进行了优化.取0.5%的壳聚糖分别与不同浓度(1,2,5,10,20 mg/mL)的Pt NPs@Mn-MOF-74按体积比1∶1混合后,取8 μL混合液滴加到电极表面,室温下晾干,然后在电极上滴加100 μL Tris-HCl缓冲溶液,采用计时电流法测定不同浓度的Pt NPs@Mn-MOF对加入的2 μL浓度为1 mol/L的H2O2的电流响应值.如图6(A)所示,当Pt NPs@Mn-MOF纳米酶的浓度较低时,传感器的电流值较小;随着纳米酶浓度的增加,电流值逐渐增大;当Pt NPs@Mn-MOF纳米酶的浓度达到10 mg/mL时,电流值最大;继续增加纳米酶浓度,传感器的电流值略有减小.因此,选择10 mg/mL作为纳米酶的最优浓度.
2.4.2 测量电位的影响为获取最优实验条件,对该传感器的测量电位进行了优化.如图6(B)所示,当测量电位达到−0.6 V时,传感器的响应电流值(ΔI=I0-Ix,I0为无OTA时的电流值,Ix为有OTA时的电流值)最大.因此,选择−0.6 V作为该传感器的最优测量电位.

Fig.6 Optimization of experimental conditions
2.4.3 缓冲溶液pH值的影响由于缓冲溶液pH值会对传感器的响应电流产生较大影响,因而对使用的Tris-HCl缓冲溶液的pH值进行了优化.由图6(C)可见,当缓冲溶液pH在4~7范围内时,随着pH值的增大,传感器的响应电流ΔI也增大,并在pH=7.0时达到最大值;当继续增大缓冲溶液的pH值时,传感器的响应电流反而降低.因此,选择pH=7.0作为缓冲溶液的最优pH值.
2.4.4 OTA适体链浓度的影响为获取最优实验条件,对OTA适体链的浓度进行了优化,实验结果如图6(D)所示.在OTA适体链浓度较低的情况下,增大适体链的浓度有助于增大传感器的响应电流,当适体链浓度增大到1 μmol/L时,传感器响应电流ΔI最大;继续增加适体链的浓度,传感器的响应略有降低.因此,选择1 μmol/L作为该传感器OTA适体链的最优浓度.
2.5 OTA电化学适体传感器的响应性能
在最优实验条件下,使用该传感器对一系列不同浓度的OTA进行了测定,结果如图7所示.其中,图7(A)为该传感器对不同浓度OTA的计时电流(i-t)曲线,图7(B)为该传感器的校正曲线.由图7可见,在0.01~300 ng/mL浓度范围内,传感器的响应电流与OTA的浓度成正比,线性方程为ΔI=5.64lgc+12.71,相关系数R2=0.9921,检出限为3.33 pg/mL.
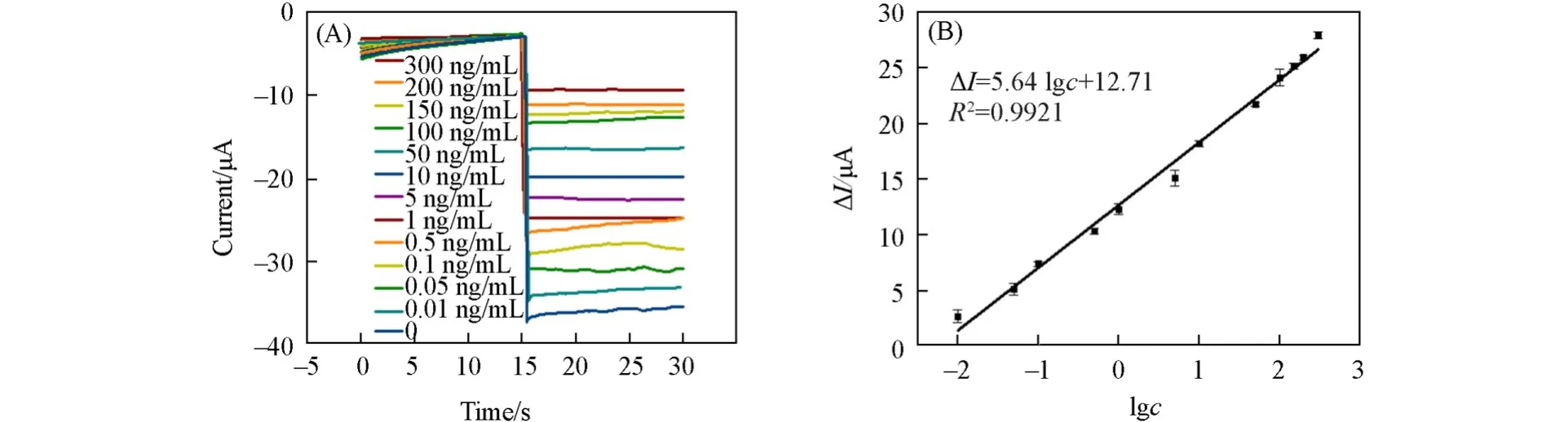
Fig.7 Chronoamperometry curves(A)and calibration curves(B)of aptasensor to different concentrations of OTA
2.6 OTA电化学适体传感器的抗干扰能力
采用混合溶液法考察了该传感器的抗干扰能力.实验中选择了5种可能存在的干扰物,包括黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、赭曲霉毒素B(OTB)、伏马毒素B1(FB1)和玉米赤霉烯酮(ZEN).将200 ng/mL的OTA分别与2000 ng/mL的上述5种干扰物等体积混合,并使用该传感器进行测定,结果如图8所示.可见,与单独的OTA对传感器的响应性能相比,OTA与干扰物混合后响应电流值几乎保持一致,可见该传感器具有良好的抗干扰能力.
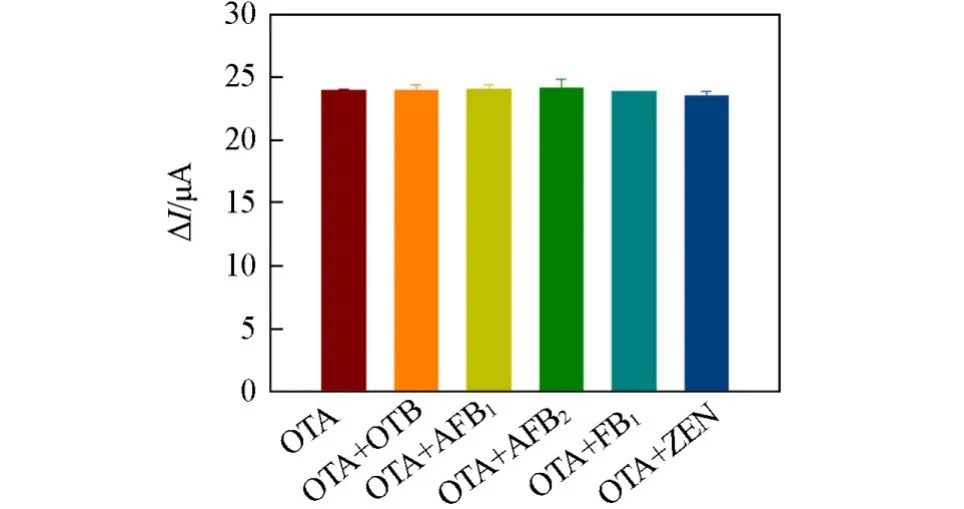
Fig.8 Anti⁃interference ability of OTA electro⁃chemical aptasensor
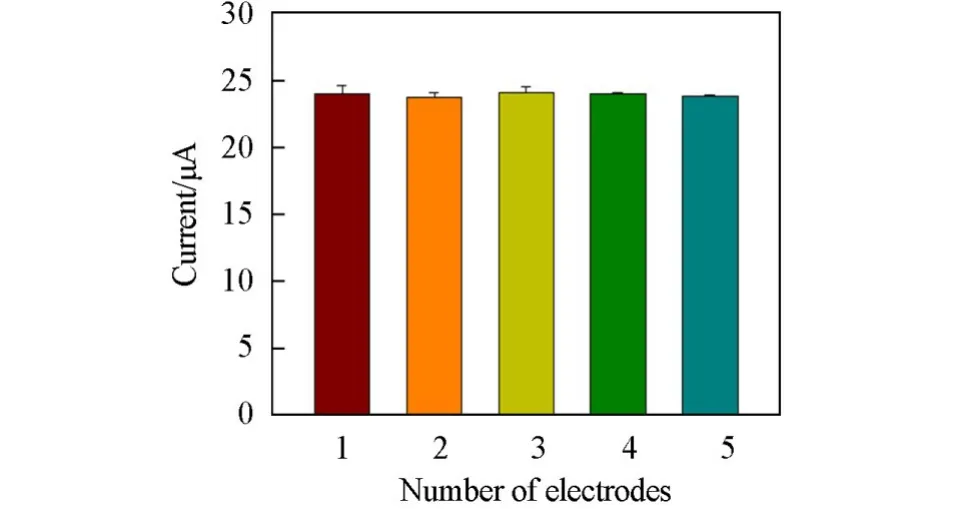
Fig.9 Reproducibility of OTA electrochemical aptasensor
2.7 OTA电化学适体传感器的重现性
使用5片单独制备的电极在相同条件下考察了该传感器的重现性,每片电极平行测定3次.结果如图9所示(RSD=0.57%,n=5),可见该传感器重现性较好.
2.8 回收率的测定
为探究该传感器在真实样品中的实用性能,使用该传感器对真实样品进行了回收率测定.采用标准加入法,分别将2.00,300.0,600.0 ng/mL的OTA与制备的玉米样品液(1∶20)按体积比1∶1混合,使玉米样品液的最终稀释比为1∶40,每组样品平行测定3次,结果如表1所示,可见其回收率在96.0%~103.0%之间,能够用于真实样品中的检测.

Table 1 Recovery of OTA electrochemical aptasensor
2.9 与商业化酶联免疫法(ELISA)及其它OTA检测方法的比较
采用商业化的酶联免疫试剂盒进行了回收率测定,并将测定结果与该传感器的测定结果进行比较,以评估该传感器的检测可信度.如图10所示,ELISA方法中随着检测目标物浓度的增加,吸光度逐渐增大,其检测线性范围为0.625~20 ng/mL,线性方程为y=0.1831x+0.345,R2=0.995.对比发现,本实验构建的传感器的检出限明显低于ELISA的检出限.此外,将2 ng/mL的OTA与1∶20的玉米样品液按体积比1∶1混合后,采用ELISA试剂盒平行测定3次,结果如表2所示,可见本实验研制的传感器与商业ELISA试剂盒一样,具有较高的准确度.
不同OTA检测方法的对比如表3所示,可见,所构建的无标记型电化学适体传感器与其它OTA检测方法相比,具有较宽的线性范围和较低的检出限.
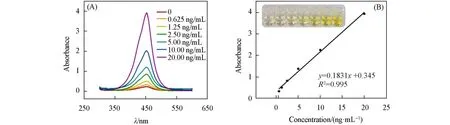
Fig.10 UV absorption spectra(A)and calibration curve(B)of ELISA kit for OTA at different concentrations
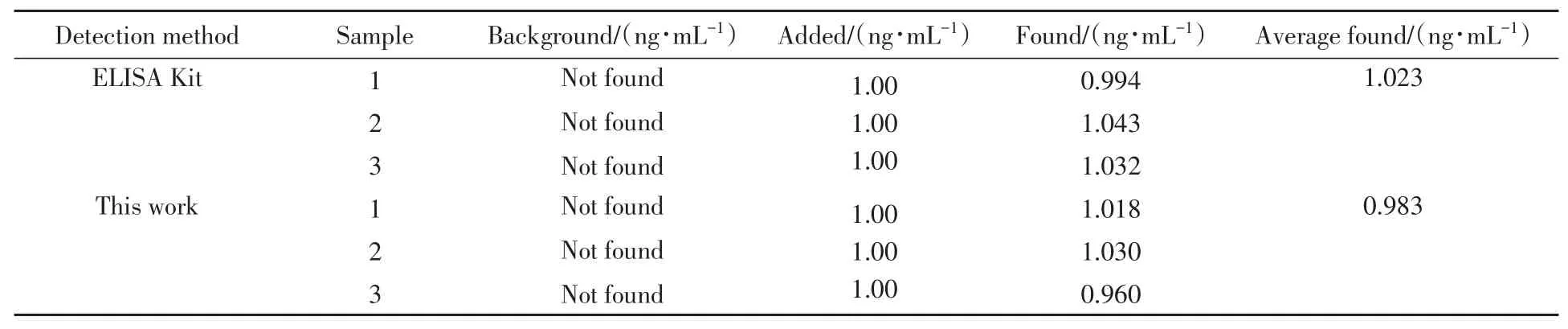
Table 2 Comparison of OTA detection results between the ELISA kit and the electrochemical aptasensor constructed in this paper in corn samples

Table 3 Comparison between the aptasensor constructed in this work and other OTA detection methods
3 结 论
基于负载铂纳米颗粒的金属有机骨架纳米酶(Pt NPs@Mn-MOF),采用丝网印刷电极构建了一种无标记型电化学适体传感器,用于OTA的定量检测.利用MnCl4·4H2O和2,5-二羟基对苯二甲酸在高压反应釜中制备了具有良好过氧化物酶活性的Mn-MOF-74,将其用于负载具有模拟酶活性的Pt NPs上,不仅有助于增强纳米酶的催化性能,还可用于固定大量的OTA适体,从而有效提高传感器的检测灵敏度,降低其检出限.该生物传感器不仅重现性好、灵敏度高,且采用的U盘式小型电化学工作站小巧方便,易于携带,可用于真实样品中的真菌毒素的现场检测,为保护食品安全提供了检测新方法.

