新辅助免疫治疗对局部晚期非小细胞肺癌术后免疫功能的影响
刘东,王俊波,李威风
(郑州市第六人民医院 胸外科,河南 郑州 450000)
非小细胞肺癌(NSCLC) 是肺癌的常见的类型之一,主要发病人群为老年人,多数患者早期并无明显症状,确诊时已耽误最佳的治疗时期[1]。局部晚期NSCLC 患者因肿瘤已经进一步发展,手术治疗难度大,术后易复发,且死亡率较高[2-3]。通常进行术前化疗,通过药物杀死部分癌细胞,以达到手术的标准,但化疗副作用较大,且效果较差。新辅助免疫治疗是指术前根据患者肿瘤发展具体情况进行综合性治疗,以期缩小病灶,降低分期,新辅助免疫治疗的出现,为部分晚期NSCLC 患者进行手术带来了新的方法[4-6]。早期肿瘤患者可以直接进行根治手术,而晚期患者无法达到手术标准,因此,局部晚期NSCLC 患者成为新辅助免疫治疗的主要适用人群,本研究旨在探究新辅助免疫治疗对局部晚期NSCLC 术后免疫功能的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年5月于郑州市第六人民医院收治的98 例晚期非小细胞肺癌(NSCLC) 患者为研究对象,根据《中国原发性肺癌诊疗规范(2015年版)》[7]中肺癌的诊断标准,诊断为NSCLC。根据随机数字表法将其分为两组,观察组48 例,男性25 例,女性23 例,年龄45 ~80 岁,平均(58.49±6.37) 岁;对照组50 例,男性26 例,女性24 例,年龄45 ~80 岁,平均(59.14±6.71) 岁。两组一般资料对比差异无统计学意义(P>0.05),该研究经本院医学伦理委员会批准。
纳入标准:(1) 根据《国际最新恶性肿瘤的TNM分类标准》[8]中,临床分期为Ⅲb 期及以上;(2) 符合NSCLC 的诊断标准;(3) 患者签署知情同意书。
排除标准:(1) 合并其他恶性肿瘤的;(2) 既往接受过NSCLC 相关治疗的;(3) 患有凝血功能障碍的;(4)患有严重心、肝、肾功能不全的;(5) 有精神病史或认知障碍的。
1.2 研究方法
1.2.1 术前辅助治疗
对照组采用化疗进行术前辅助治疗,方案:顺铂(齐鲁制药有限公司,国药准字H37021362,)20 mg/m2;长春瑞滨( 长春远大国奥制药有限公司,国药准字H20041927)25 mg/m2,两者均于第1 d、第8 d 静脉注射。
观察组采用新辅助免疫治疗联合化疗进行术前治疗,在对照组的基础上进行免疫治疗,使用帕博丽珠单抗(Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. 进口药品注册证号:S20180019,规格:100 mg/4 mL),每3 周一次,200 mg/ 次,使用5% 葡萄糖注射液100 mL 稀释,静脉注射,每次至少持续用药 30 min,14 d 给药1 次。
免疫治疗和化疗均以21 d 为1 个周期,2 个周期后疗效评估。化疗结束2 周后进行手术治疗。
1.2.2 肺叶切除手术
两组经治疗后可以接受手术的患者( 即新辅助治疗或化疗治疗客观有效的患者) 均接受肺叶切除术进行治疗。胸后外侧做约15 cm 切口,将前锯肌与部分背阔肌切断,通过第4 肋间或第5 肋间进胸,使用撑开器将肋骨大开,切除被癌细胞感染的肺叶,清扫周围扫淋巴结,放置引流管,止血缝合,术后给予常规药物进行抗感染的预防治疗。
1.3 观察指标
(1)疗效判定:行胸部CT 对患者进行复查,按照《实体瘤的评价标准1.1 版》进行疗效评估[9]。指标包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)、客观有效率(ORR)。ORR=(CR 例数+PR例数)/ 总例数×100%。
(2) 免疫功能指标检测:分别于治疗前、术前及术后第2 d,采集患者外周静脉血5 mL,冷冻保存,采用流式细胞仪(TG 公司,型号:FACScalibur 型) 对患者CD3+、CD4+水平及CD4+/CD8+进行检测等。
(3) 血管内皮指标检测:分别于治疗前、术前、术后2 d,采集患者空静脉血2 mL,离心后采用ELISA 试剂盒检测血管内皮生长因子(VEGF) 水平,试剂盒由上海江莱生物科技有限公司提供,严格按照VEGF 试剂盒说明书进行操作。
1.4 统计学方法
利用SPSS 22.0 软件处理数据。计量资料以±s表示,采用t检验,计数资料以n(%)表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 两组NSCLC 患者治疗后疗效比较
治疗2 个周期后观察组ORR 85.42% 高于对照组64.00%(P<0.05)。见表1。
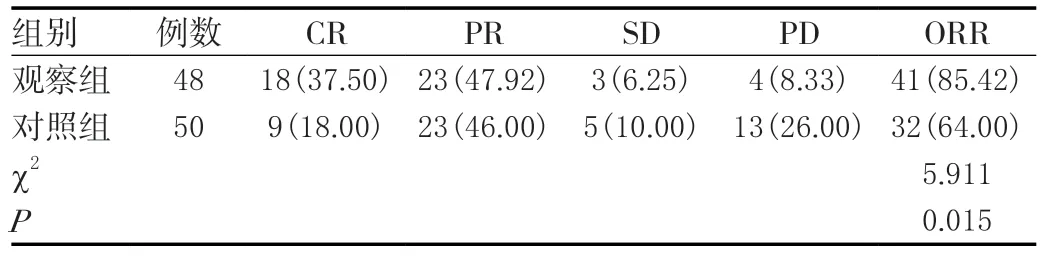
表1 两组NSCLC患者治疗后疗效比较[n(%)]Table 1 Comparison of curative effect between two groups of NSCLC patients after treatment [n(%)]
2.2 两组NSCLC 患者术后免疫功能指标比较
将观察组中7 例SD 与PD 患者剔除,剩余41 例患者接受后续手术治疗,将对照组中18 例SD 与PD 患者剔除,剩余32 例后续接受手术治疗。
两组患者治疗前CD3+、CD4+、CD4+/CD8+比较差异均无统计学意义(P>0.05);术前两组患者各项免疫功能指标与治疗前差异无统计学意义(P>0.05),观察组患者CD3+、CD4+水平及CD4+/CD8+高于对照组(P<0.05);术后,两组患者CD3+、CD4+水平及CD4+/CD8+与治疗前相比均降低,观察组CD3+、CD4+水平及CD4+/CD8+高于对照组(P<0.05),见表2。
表2 两组NSCLC患者术后免疫功能指标比较(± s )Table 2 Comparison of postoperative immune function indexes of two groups of NSCLC patients (± s )
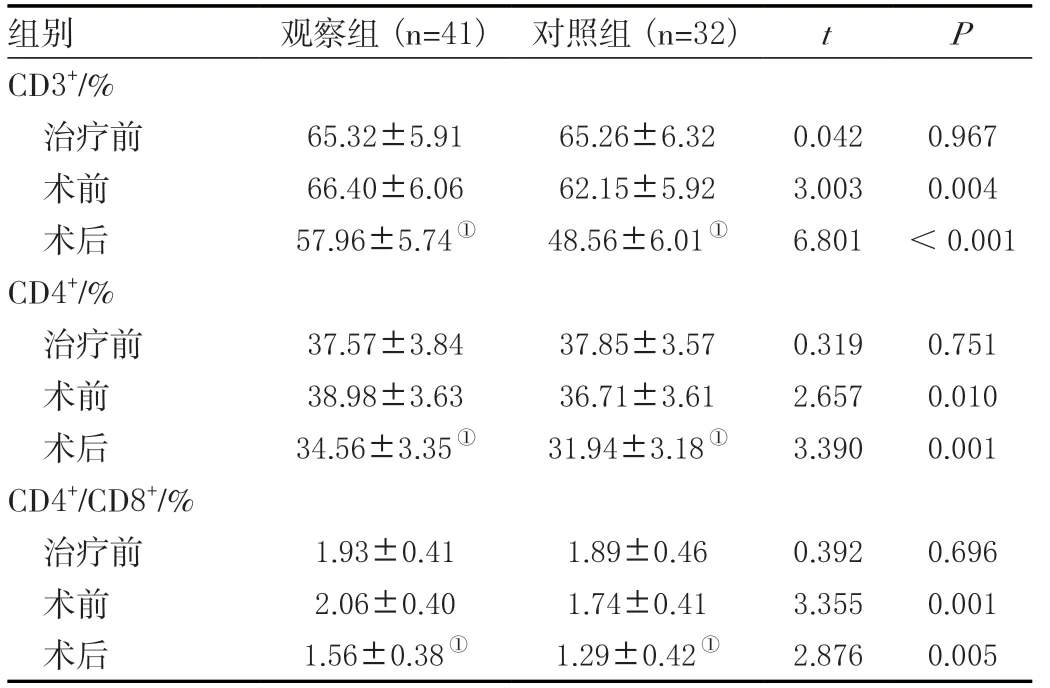
表2 两组NSCLC患者术后免疫功能指标比较(± s )Table 2 Comparison of postoperative immune function indexes of two groups of NSCLC patients (± s )
注:与同组治疗前比较,①P <0.05。
组别 观察组(n=41) 对照组(n=32) t P CD3+/%治疗前 65.32±5.91 65.26±6.32 0.042 0.967术前 66.40±6.06 62.15±5.92 3.003 0.004术后 57.96±5.74① 48.56±6.01① 6.801 <0.001 CD4+/%治疗前 37.57±3.84 37.85±3.57 0.319 0.751术前 38.98±3.63 36.71±3.61 2.657 0.010术后 34.56±3.35① 31.94±3.18① 3.390 0.001 CD4+/CD8+/%治疗前 1.93±0.41 1.89±0.46 0.392 0.696术前 2.06±0.40 1.74±0.41 3.355 0.001术后 1.56±0.38① 1.29±0.42① 2.876 0.005
2.3 两组NSCLC 患者血管内皮指标比较
两组患者治疗前VEGF 水平比较差异无统计学意义(P>0.05);术前观察组患者VEGF 水平低于治疗前,对照组与治疗前差异无统计学意义(P>0.05),观察组患者VEGF 水平低于对照组(P<0.05);术后,两组患者VEGF 水平与治疗前相比均降低,观察组VEGF 水平高于对照组(P<0.05),见表3。
表3 两组NSCLC患者血管内皮指标比较(± s ,ng/mL)Table 3 Comparison of vascular endothelial indexes between the two groups of NSCLC patients (± s ,ng/mL)
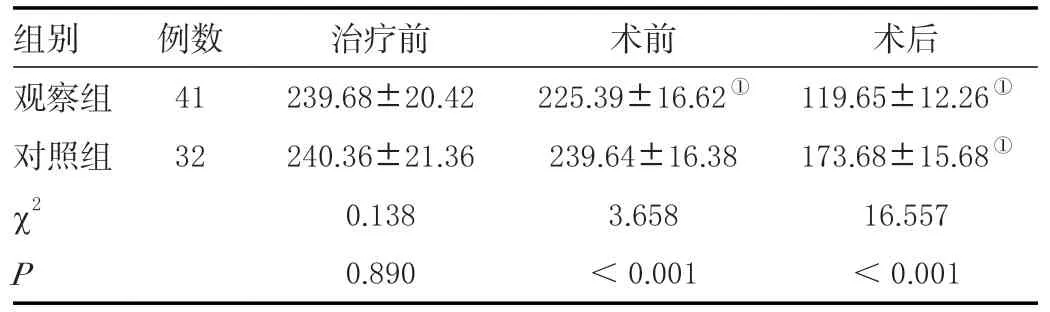
表3 两组NSCLC患者血管内皮指标比较(± s ,ng/mL)Table 3 Comparison of vascular endothelial indexes between the two groups of NSCLC patients (± s ,ng/mL)
注:与同组治疗前比较,①P <0.05。
组别 例数 治疗前 术前 术后观察组 41 239.68±20.42 225.39±16.62① 119.65±12.26①对照组 32 240.36±21.36 239.64±16.38 173.68±15.68①χ2 0.138 3.658 16.557 P 0.890 <0.001 <0.001
3 讨 论
NSCLC 占肺癌的4/5 以上,大部分NSCLC 患者确诊时已发展至局部晚期[10]。肺叶切除手术是控制肿瘤继续发展的最佳方式,但是局部晚期NSCLC 部分患者无法达到手术标准,且术后复发率和转移率较高,近期及远期生存率均不理想[11-12]。由于局部晚期NSCLC 肿瘤负荷远远高于早期,单纯化疗对控制或消灭肿瘤细胞的作用有限,无法作为主要治疗方法[10]。因此,新辅助免疫治疗成为局部晚期NSCLC 患者术前干预的有效手段。新辅助治疗主要为缩小肿瘤大小,降低临床分期,使患者能够达到进行肺叶切除术的指标,为无法进行手术的患者带来了更多希望[13]。免疫功能是抗肿瘤的重要部分,为了更好地对抗肿瘤,患者应具备更高的免疫功能,为探究新辅助免疫治疗对局部晚期NSCLC 术后免疫功能的影响,本文对此进行研究。
本研究中观察组进行手术的人数更多,提示新辅助治疗能够增加患者进行手术的可能,心腹之治了的目的就是为了利于控制肿瘤的继续恶化,并缩小病灶,降低分期,将肿瘤的增殖能力控制在较低的状态,控制肿瘤扩散,以减少手术难度,从而增加患者ORR[14-15]。研究结果显示,联合新辅助治疗后,观察组治疗后ORR 明显提升,手术成功率明显增加,表明免疫治疗为更多局部晚期NSCLC 患者带来手术的可能,有利于提高局部晚期NSCLC 患者的生存率,本研究结果与上述结论相符。
CD4+T 细胞为辅助性T 细胞,活化的CD4+T 细胞能够分泌细胞因子,辅助CD8+T 细胞消灭肿瘤细胞[16]。CD4+/CD8+是机体细胞免疫功能的重要指标,其比值越低,说明机体对肿瘤免疫应答能力越低,免疫功能越差[17]。本研究结果表明,两组术后CD3+、CD4+、CD4+/CD8+较治疗前有明显下降,术后患者免疫功能均下降,表明手术对患者的免疫功能具有一定程度的抑制作用,但观察组高于对照组,则表明新辅助免疫治疗对患者的免疫功能具有一定的保护作用,另外治疗后( 术前),观察组患者免疫功能较对照组上升,进一步说明辅助免疫治疗对患者免疫功能的保护作用,分析原因为细胞免疫是抗肿瘤免疫功能的主力军,CD3+、CD4+可以免疫反应中的辅助物质,当CD3+、CD4+被激活后能够转化为膜攻击复合物,攻击肿瘤细胞的细胞膜,从而导致癌细胞的死亡,虽然经过化疗后,患者机体免疫功能均受损,但观察组的免疫功能指标水平高于对照组,因此新辅助免疫治疗对于NSCLC 患者的ORR 更高[18-19]。
手术降低了患者的免疫功能,因此肿瘤转移的可能会相对提高,VEGF 是一种特殊的细胞因子,参与形成血管,同时对于肿瘤的发展与发生具有一定的调控作用。临床研究显示,VEGF 水平能够影响肿瘤细胞的增殖、转移能力,与其特异性受体结合发挥作用[20]。本研究对患者治疗前,术前及术后VEGF 水平进行检测,结果显示治疗后( 术前),观察组观察组患者VEGF 水平低于治疗前,对照组与治疗前差异无统计学意义,术后,两组患者VEGF 水平均降低,其中观察组低于对照组。表明新辅助治疗对于改善血管内皮水平效果更明显。
综上所述,新辅助免疫治疗能够提高NSCLC 患者提高手术率同时提高患者治疗后的ORR,更好的保护患者术后的免疫功能,改善血管内皮功能,对后续治疗具有积极意义。

