氧化条件下精氨酸对肌原纤维蛋白结构及凝胶性能的调控
马文慧,邝吉卫,李保玲,高 翔,曹云刚,黄峻榕
(陕西科技大学食品与生物工程学院,陕西 西安 710021)
肉及肉制品在满足人体对营养素的需要中占有重要地位,是蛋白质、脂肪、B族维生素和多种矿物质的良好来源[1]。在加工和贮藏过程中蛋白质氧化是导致原料肉及肉制品品质下降的重要原因。肌原纤维蛋白(myofibrillar protein,MP)约占肌肉总蛋白的55%~65%,决定肉制品加热过程中三维网络结构的形成,对肉制品质地的形成起至关重要的作用[2]。现有研究表明诱发蛋白氧化的物质包括活性氧物质、活性氮物质以及脂肪氧化应激的二级产物等[3],这些物质主要来源于肌肉本身及加工贮藏过程中。其中羟自由基是活性氧自由基中氧化能力最强的自由基,羟自由基氧化体系也是肉制品加工中最普遍存在的一种氧化体系[1]。大量研究表明羟自由基会诱导蛋白结构发生变化,引起溶解度降低,交联聚集情况加剧,进而影响其凝胶特性及消化率,并导致肉及肉制品的质地及口感劣变[2,4-5]。因此,调控肉蛋白氧化稳定性、改善蛋白的凝胶性能已成为近年来的研究热点。
现有研究聚焦于采用不同饲料喂养[6]、不同包装技术[7]、添加抗氧化剂[8-10]等手段提高原料肉的氧化稳定性、降低储藏过程中原料肉的脂肪和蛋白氧化。其中添加抗氧化剂的策略简便经济,主要包括添加人工合成抗氧化剂[8]、天然抗氧化剂(植物多酚、复合磷酸盐)等[9-10]。然而现有添加剂对于抑制肉蛋白氧化效果有限,且人工合成抗氧化剂的摄入对人体健康具有潜在危害,比如诱发癌症和畸形等[11-12];复合磷酸盐过量摄入会打破人体钙磷比平衡,导致高血钙症、低血钙症及佝偻病等疾病[13]。
精氨酸(L-(+)-arginine,L-Arg)作为一种多用途、多功能的氨基酸,在许多领域均有重要应用。对人体而言,L-Arg是条件必需氨基酸,具有抗氧化[14]、治疗肠道损伤、增强机体免疫力等[3,15]作用。对肉制品加工而言,L-Arg可以改善肉制品色泽和质构,提高出品率,增加肉制品嫩度,改善肉品品质[16-18]。然而,关于氧化条件下L-Arg对MP结构及凝胶性能调控方面的研究鲜见报道。因此,本研究采用FeCl3-VC-H2O2体系构建羟自由基模拟氧化体系[2],探究L-Arg添加量对MP化学及结构变化、交联和聚集情况、热诱导凝胶性能及微观结构的影响,明晰L-Arg对MP氧化稳定性及凝胶性能的调控机制,为提高肉蛋白的氧化稳定性、改善肉品品质提供理论依据。
1 材料与方法
1.1 材料与试剂
猪外脊肉(Longissimus lumborum)购买自陕西西安润家超市。
水溶性VE(Trolox) 美国Sigma-Aldrich公司;5,5’二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid,DTNB)、哌嗪-N,N’-双(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES)、L-Arg 上海源叶生物科技有限公司;二硫苏糖醇(dithiothreitol,DTT)、丙烯酰胺-甲叉双丙烯酰胺30%溶液(29∶1,V/V)、过硫酸铵(ammonium persulfate,APS)、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、甘氨酸、溴酚蓝 生工生物工程(上海)股份有限公司;牛血清蛋白(bovine albumin,BSA)、H2O2(30%)、FeCl3、抗坏血酸(均为分析纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
HR/T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;CP213电子天平 奥豪斯仪器(常州)有限公司;UV2900紫外-可见分光光度计 上海舜宇恒平科学仪器有限公司;TA.Plus物性测试仪 英国Stable Micro System公司;Fluoro Max-4荧光分光光度计日本Horiba公司;Mastersizer 2000激光粒度分析仪英国Malvern Instruments有限公司;Mini-PROTEAN 3 Cell电泳仪 美国Bio-Rad公司;CM-5分光测色计柯尼卡美能达(中国)投资有限公司;Haake-Mars 60流变仪、DXR2显微共聚焦拉曼光谱仪 德国Thermo Fisher Scientific公司;Q45+EDAX Octane Prime环境扫描电子显微镜 美国FEI公司。
1.3 方法
1.3.1 样品处理
猪外脊肉样品排酸24 h,剔除可见脂肪、结缔组织,垂直于肌纤维走向切成100~120 g的肉片,真空密封于-20 ℃冰箱中冷冻储存,3 个月内用完。使用前,将单片冷冻肌肉样品解冻并切成小条称量,MP的提取参照Park等[19]方法。全部提取过程保持在0~4 ℃,提取的MP在48 h内用完。蛋白浓度采用双缩脲法测定,以BSA作为标准蛋白。
1.3.2 MP的氧化处理
用含有15 mmol/L pH 6.25 PIPES缓冲液将MP稀释至45 mg/mL,调节稀释液NaCl浓度为0.6 mol/L,制备含有不同浓度L-Arg(1、3、5 mmol/L和10 mmol/L)的样品,添加氧化体系(10 μmol/L FeCl3,100 μmol/L抗坏血酸,10 mmol/L H2O2),将最终体系蛋白质量浓度调至30 mg/mL。MP样品在4 ℃氧化12 h,通过添加Trolox(1 mmol/L,终浓度)终止氧化。未经L-Arg处理的未氧化(NonOx)MP样品作为空白组,氧化(Ox)MP样品作为对照组。
1.3.3 总巯基及内源性色氨酸荧光的测定
总巯基测定:按照Cao Yungang等[20]的DTNB法。
内源性色氨酸荧光测定:用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将MP样品稀释为0.4 mg/mL,利用Fluoro Max-4 荧光分光光度仪于283 nm激发,记录290~400 nm的发射光谱,激发和发射狭缝宽度均设置为1.5 nm。相同条件下记录溶剂发射光谱,并从样品发射光谱中扣除以排除干扰。
1.3.4 交联聚集情况的测定
粒径分布的测定:使用Mastersizer 2000型激光粒度分析仪在25 ℃采用静态光散射分析MP样品的粒径分布。用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将样品稀释为2 mg/mL(避免多重散射),去除测量背景后,将MP稀释液分散在800 mL蒸馏水中,直到光遮光度达到10%~13%时,测量得出粒径分布范围。
溶解度测定:用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将MP样品稀释为2 mg/mL,4 ℃、5 000×g离心15 min。上清液蛋白质量浓度(双缩脲法测定)占2 mg/mL的百分比即为溶解度[1]。按式(1)计算:

十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE):参考Laemmli[21]的方法适当调整。采用SDS-PAGE分析法对还原和非还原条件下蛋白交联和聚集情况进行分析。浓缩胶和分离胶浓度分别选用4%和12%,2 mg/mL MP样品与样品缓冲液(含20%甘油、4% SDS和0.5 mol/L pH 6.8 Tris)进行等比例混合,沸水浴3 min,每孔上样量25 μL。染色脱色后拍照并对电泳条带进行分析。
1.3.5 凝胶性能的测定
动态流变学特性分析:参考Cao Yungang等[22]的方法稍加修改。使用Haake-Mars 60型流变仪进行振荡温度连续扫描,分析MP样品在凝胶化过程中的流变行为。流变仪使用前调零,MP样品(30 mg/mL)离心脱气(1 000×g,1 min)后,取约2.0 mL样品均匀涂布于平板上,将转子(型号P 35)降至1 mm时去除周围多余样品,并在边缘涂上硅油层以防止水分散失。将MP样品在20 ℃平衡3 min,以1 ℃/min的速率从20 ℃加热至75 ℃。振荡模式选择CD-AutoStrain,以固定频率(0.1 Hz)剪切MP样品,控制应变为0.02,监测样品凝胶化过程。通过储能模量(G’)和黏弹比(tanδ)评价MP样品的动态流变特性。
热诱导凝胶制备:准确称取5 g MP样品(30 mg/mL)置于小玻璃瓶中,用保鲜膜轻轻密封后,置于水浴锅中,从20 ℃加热至75 ℃,并在75 ℃保温10 min。取出放入冰水浴中冷却30 min后置于4 ℃冰箱过夜。测定凝胶性能前,需将凝胶样品在室温条件下平衡2 h。
蒸煮损失测定:用小铲将凝胶轻轻地与小玻璃瓶壁分开(避免瓶壁的牵引力),倒置于滤纸上20 min,待蒸煮汁液流尽后称量凝胶质量[1]。蒸煮损失按式(2)计算:

凝胶白度测定:参照Xia Xiufang等[23]方法略作修改。分光测色计经自检及零点、白板校正后,进行样品测定。每个样品3 组平行,取平均值。凝胶白度值按式(3)计算:
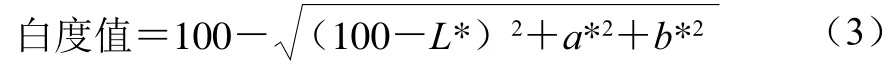
式中:L*为亮度值;a*为红度值(正值表示偏红,负值表示偏绿);b*为黄度值(正值表示偏黄,负值表示偏蓝)。
凝胶强度测定:MP样品凝胶强度用TA-XT Plus物性分析仪进行测定。测定模式:测前速率为5 mm/s;测中速率为1 mm/s;测后速率为5 mm/s;下压距离为8 mm;探头型号为P/0.5。凝胶强度定义为刺破凝胶所需的初始压力(N)[24]。
1.3.6 凝胶中蛋白的二级结构测定
参考Cao Yungang等[25]的方法稍加修改。利用DXR2显微共聚焦拉曼光谱仪和DXR 785 nm激光光源对MP凝胶的二级结构进行分析,配件选择785 nm激光器和10×/0.25 BD的显微镜。其他参数设置如下:激光功率30 mW;孔径50 μm;光斑直径3.1 μm;分辨率4.7~8.7 cm-1;收集曝光时间30 s;样品曝光次数3 次,选择智能背景去除背景干扰。光谱数据由OMNIC软件收集,使用LabSpec软件对所得光谱进行平滑、基线校正,使用pickfit软件对1 600~1 700 cm-1处去卷积拟合得出MP凝胶的α-螺旋、β-折叠、β-转角、无规卷曲相对含量。
1.3.7 凝胶微观结构观察
将制备的MP凝胶切块(3 mm×3 mm×1 mm),用含2.5%戊二醛的磷酸盐缓冲液(0.1 mol/L,pH 7.4)固定4 h后,pH 7.4的磷酸盐缓冲液清洗3 次,在一系列乙醇溶液(50%、70%、90%、95%和100%)中进行梯度脱水,每次30 min,-70 ℃冷冻干燥后溅射喷金,使用环境扫描电子显微镜对凝胶微观结构进行观察,加速电压15 kV,放大倍数4 000 倍[25]。
1.4 数据统计
每组实验均重复2~3 次,使用Statistix 9.0分析软件的线性模式进行方差分析,采用LSD模式比较多组数据进行显著性分析,P<0.05,差异显著,通过SigmaPlot 12.5软件进行数据绘图。
2 结果与分析
2.1 氧化条件下不同浓度L-Arg对MP化学及结构变化的影响
2.1.1 总巯基含量
巯基含量的变化常用于衡量蛋白氧化程度,MP富含巯基,尤其是肌球蛋白,每个肌球蛋白中约有40 个巯基,这些巯基易受羟自由基攻击而转化成分子内或分子间二硫键,直接影响蛋白质的结构,进一步影响其功能特性[26]。氧化条件下不同浓度L-Arg对MP巯基含量的影响如图1A所示,未氧化MP的总巯基含量为62.0 nmol/mg,氧化12 h后MP的总巯基含量下降至52.6 nmol/mg,下降幅度高达15.2%。氧化条件下,当L-Arg添加量为1、3 mmol/L和5 mmol/L时,总巯基含量损失分别减少了2.3、0.3 nmol/mg和3.5 nmol/mg;然而,当L-Arg添加量为10 mmol/L时会进一步促进总巯基的损失(P<0.05)。氧化条件下不同浓度L-Arg添加对MP巯基的影响主要归因于以下两个方面:1)L-Arg自身的—NH2等基团先与羟自由基进行反应,从而阻止了MP巯基的损失;2)L-Arg的加入引起了MP分子解折叠,使埋藏在其中的巯基基团暴露到了蛋白分子表面,因而更容易受到羟自由基的攻击。
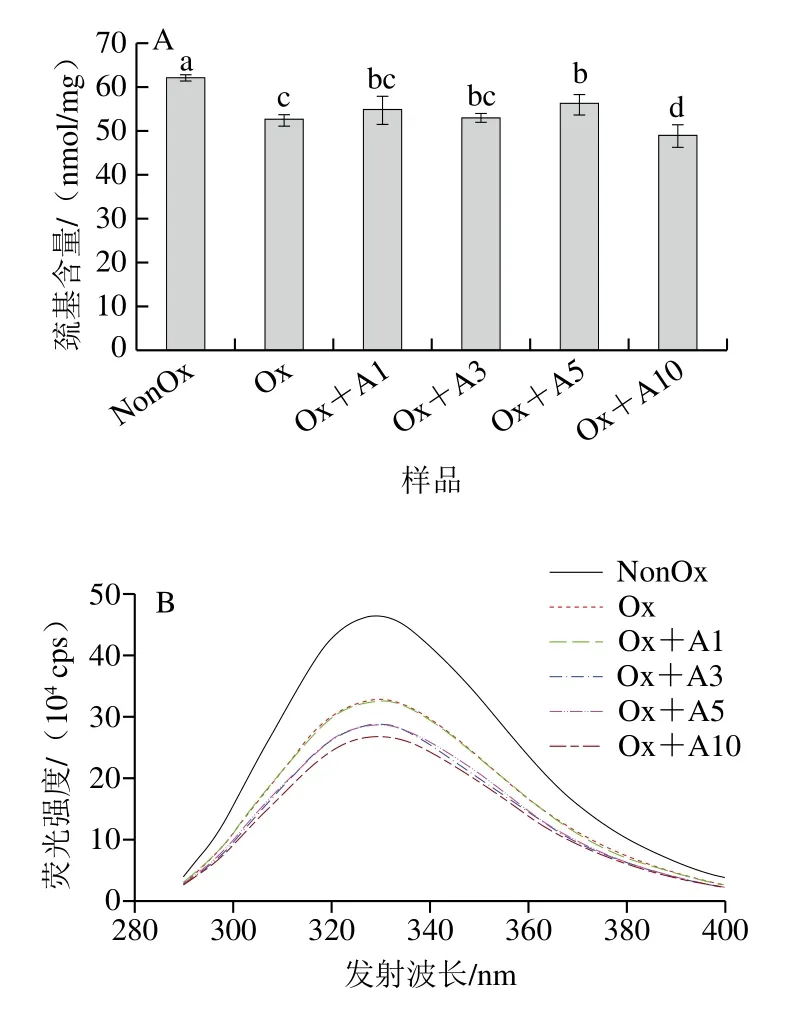
图1 氧化条件下L-Arg浓度对MP化学及结构变化的影响Fig.1 Effects of different concentrations of L-Arg on the chemical and structural changes of myofibrillar protein under oxidative conditions
2.1.2 内源色氨酸荧光
蛋白质内源色氨酸荧光对色氨酸残基周边的微环境特别敏感,是表征蛋白质构象的一种有效方法。当蛋白质在折叠状态时,其色氨酸荧光强度较强;当处于部分或完全展开的状态时,其荧光强度会明显降低[27]。如图1B所示,未氧化的MP显示出较强的荧光强度,在最大发射波长处的荧光强度约为46.4×104cps,氧化诱导蛋白质结构展开,使色氨酸暴露在极性环境中,导致MP荧光强度显著降低。L-Arg的加入并没有阻止氧化引起的MP色氨酸荧光强度降低,相反,随着L-Arg添加量的增加,内源色氨酸荧光强度逐步降低。一方面可能是由于L-Arg处理使MP分子进一步展开[28],使得更多的色氨酸残基暴露于溶剂中导致其荧光猝灭;另一方面可能是由于L-Arg中多个亲水基团(—COOH和—NH2)的存在使得色氨酸残基的微环境极性增强,导致荧光强度进一步降低。
2.2 氧化条件下不同浓度L-Arg对MP中交联聚集程度的影响
2.2.1 粒径分布
蛋白质的粒径通常反映蛋白质的聚集程度,氧化条件下不同浓度L-Arg对MP粒径分布的影响如图2所示,与未氧化MP相比,氧化MP的峰形未发生明显变化,但其粒径分布明显向更大粒径转变。这与Bao Yulong等[29]报道的在次氯酸钠氧化应激下,MP颗粒尺寸增大结果类似。经L-Arg处理后,MP样品的粒径分布图变为了双峰,说明L-Arg的添加导致了MP大分子聚合物的生成。当L-Arg浓度为1~5 mmol/L时,大分子聚合物形成随L-Arg浓度的增加呈下降趋势,但当L-Arg浓度为10 mmol/L时,大分子聚合物的形成急剧增强。这可能是由于L-Arg的添加进一步促进了氧化诱导的MP结构的展开,使得巯基和疏水性基团暴露,蛋白分子间二硫键及疏水相互作用增强[28],导致蛋白-蛋白交联形成聚集体,向更大粒径转变。
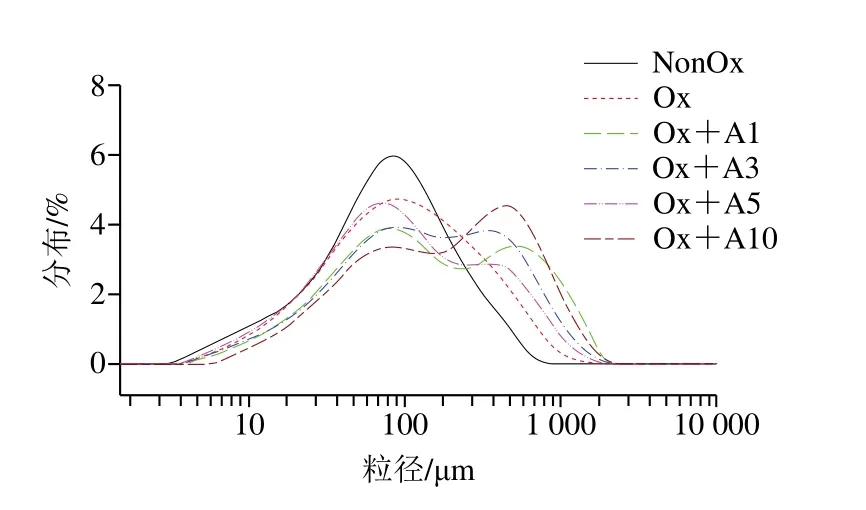
图2 氧化条件下L-Arg浓度对MP粒径分布的影响Fig.2 Effects of different concentrations of L-Arg on particle size distribution of myofibrillar protein under oxidative conditions
2.2.2 交联聚集程度
氧化条件下添加不同浓度L-Arg对MP交联聚集的影响如图3A、B所示。在非还原条件下(图3A),与未氧化处理MP样品相比,分离胶中氧化处理MP样品的肌球蛋白重链和肌动蛋白条带变浅,说明氧化导致肌球蛋白重链和肌动蛋白发生交联聚集。与氧化处理MP样品相比,当L-Arg浓度在1~5 mmol/L时,L-Arg添加对MP的交联聚集无显著影响,当L-Arg浓度为10 mmol/L时,肌球蛋白重链条带明显变浅,说明高浓度L-Arg添加促进了MP的交联聚集。在还原条件下(加入还原剂DTT后,图3B),所有处理MP样品浓缩胶顶端的聚合物条带几乎完全消失,肌球蛋白重链和肌动蛋白条带明显加粗,说明这些聚合物主要是通过巯基氧化产生的二硫键交联形成的。综合上述分析可知,在氧化条件下,低浓度L-Arg(1~5 mmol/L)对MP的交联聚集影响不明显,但高浓度L-Arg(10 mmol/L)会明显促进MP的交联聚集。
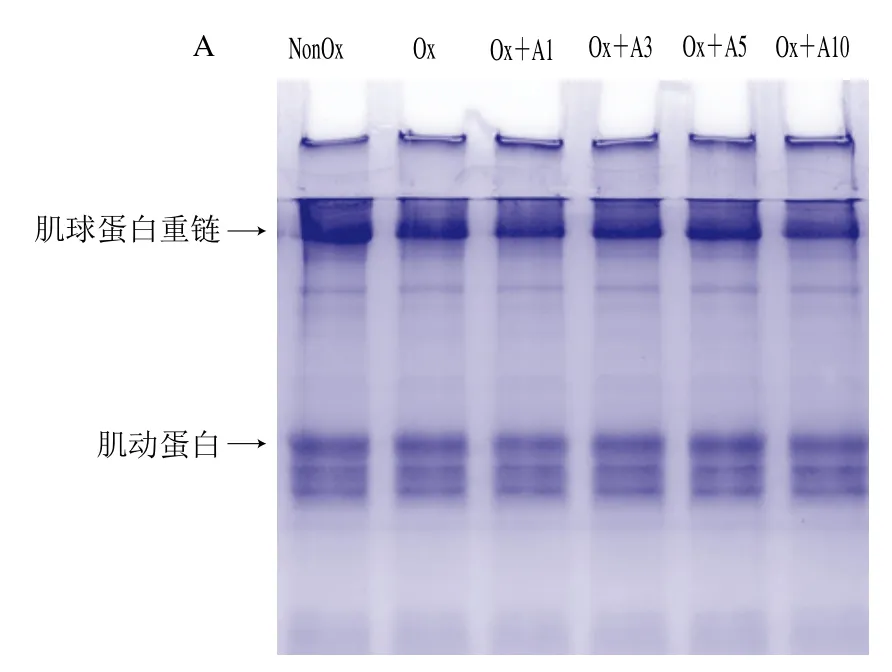

图3 氧化条件下L-Arg浓度对MP SDS-PAGE图谱及溶解度的影响Fig.3 Effects of different concentrations of L-Arg on SDS-PAGE pattern and solubility of myofibrillar protein under oxidative conditions
2.2.3 溶解度
如图3C所示,未氧化MP的溶解度为63.4%,氧化12 h后,MP样品的溶解度下降了约43.7%(P<0.05),这主要是由于氧化导致MP结构的展开从而引起蛋白质聚集体的形成(图2、图3A)。当L-Arg添加量为1~5 mmol/L时,氧化MP的粒度增大(图2),溶解度略有下降但无显著差异(P>0.05)。与本研究类似,郭秀云[30]研究发现在不同NaCl浓度(0.1、0.15、0.6 mol/L)下,添加5 mmol/L的L-Arg对肌球蛋白溶解度无显著影响(P>0.05)。当L-Arg浓度为10 mmol/L时,溶解度显著降低(P<0.05),这可能是由于高浓度L-Arg的加入使得MP分子链过度展开,导致羟自由基更容易攻击其中的反应基团,促进二硫键的形成,交联聚集情况加剧,平均粒径增大(图2),从而导致溶解度急剧降低。
2.3 氧化条件下不同浓度L-Arg对MP凝胶性能的影响
2.3.1 动态流变行为
MP凝胶的特征在于它的动力学黏弹流变特性[31]。在热诱导凝胶过程中动态流变行为的变化主要通过G’和tanδ体现。G’描述的凝胶体系的弹性特征如图4A所示,未氧化MP样品的G’在约41 ℃开始显著增加,在约49 ℃达到转变峰,在约53 ℃到达波谷,随后弹性模量持续升高至最终加热温度。这种流变学转变在MP加热诱导凝胶过程中广泛存在,49 ℃的转变峰主要是由肌球蛋白头部(S1)的变性和聚集引起;49~53 ℃时,G’显著降低,这归因于肌球蛋白尾部(S2)的展开导致蛋白质网络暂时性崩溃;53 ℃后,G’持续上升,这是由于随温度升高蛋白质进一步交联聚集,形成了永久性、不可逆、更强的网络结构[32]。与未氧化的MP相比,氧化后的MP在49 ℃处的转变峰峰值明显降低,说明肌球蛋白头-头相互作用被抑制,但其最终G′值高于未氧化MP,说明尾-尾相互作用被促进[33]。L-Arg浓度在1~5 mmol/L时没有改变G′曲线的类型,但在10 mmol/L时MP样品在49 ℃时的转变峰几乎消失。L-Arg浓度为1 mmol/L时,最终G′值增加了8.9%,当L-Arg添加量为3、5 mmol/L和10 mmol/L时,最终G′值分别下降了15.9%、19.6%和54.2%,说明随着L-Arg添加量的增加,并不能改善凝胶网络的形成甚至对凝胶网络的形成产生负面影响。这可能是由于未加热时L-Arg的添加促进了蛋白质分子内和分子间的相互作用,形成大的蛋白质聚集体(图2),导致温度上升时蛋白结构的展开速率低于交联速率,阻碍了蛋白凝胶网络的顺利形成。
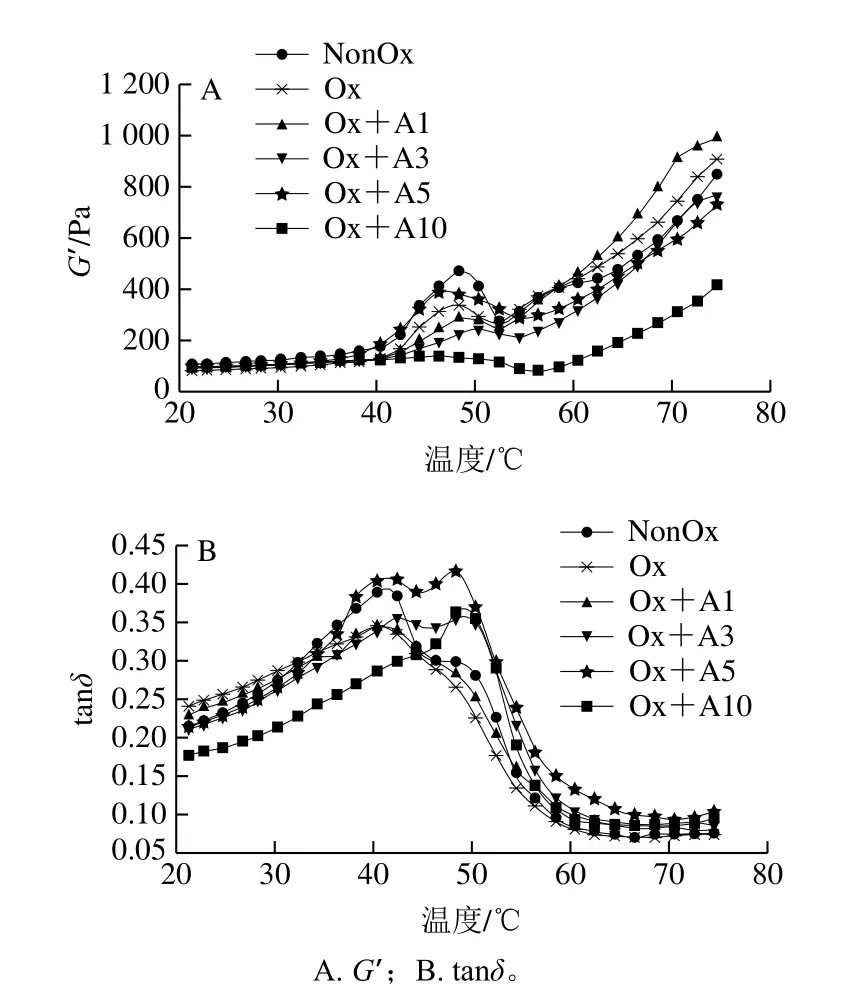
图4 氧化条件下不同浓度L-Arg对MP流变性能的影响Fig.4 Effects of different concentrations of L-Arg on rheological properties of myofibrillar protein under oxidative conditions
tanδ是凝胶网络形成过程中“黏度”与“弹性”的比值,其比值越高说明体系黏性越强或弹性越低[31]。氧化条件下不同浓度L-Arg的添加对MP凝胶过程中tanδ值的影响如图4B所示。未氧化MP的tanδ值从20~42 ℃持续上升,在约42 ℃达到高峰后,随后随温度的上升急剧下降,说明在20~42 ℃时黏性在凝胶体系占主导地位,42 ℃后弹性在凝胶体系占主导地位。氧化并不影响tanδ值的发展趋势,但氧化MP的初始tanδ值增高,且tanδ值在20~32 ℃高于未氧化的MP,说明氧化导致MP在低温时的黏性增大;32 ℃后tanδ明显低于未氧化MP,说明氧化导致MP在高温阶段的黏度降低。添加低浓度L-Arg(1 mmol/L)在整个凝胶过程中对氧化MP的tanδ值影响并不显著。添加较高浓度L-Arg(3 mmol/L和5 mmol/L)MP的tanδ值与氧化MP相比,其峰形发生了明显变化。tanδ值在20~43 ℃持续上升,在43~47 ℃有一个临时的下降,在51 ℃达到高峰后,随后随温度的上升急剧下降。在高浓度L-Arg(10 mmol/L)下,tanδ值从20~51 ℃持续上升,在约51 ℃达到高峰后,随后随温度的上升急剧下降。这说明较高浓度及高浓度L-Arg的添加显著改变了凝胶过程中MP体系的黏弹性。
2.3.2 蒸煮损失
如图5所示,未氧化MP凝胶的蒸煮损失约为12.2%,氧化使MP凝胶的蒸煮损失增加了77.9%。添加L-Arg后,MP凝胶的蒸煮损失随L-Arg浓度的增加明显降低,当L-Arg浓度达到10 mmol/L时,与氧化MP相比其蒸煮损失降低了约41.5%(P<0.05),这与Guo Xiuyun等[34]报道的在高盐浓度下,L-组氨酸、L-赖氨酸及HL-低钠盐提高了肌球蛋白凝胶保水性一致。
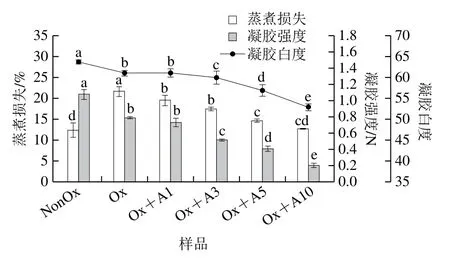
图5 氧化条件下L-Arg浓度对MP凝胶性能的影响Fig.5 Effects of different concentrations of L-Arg on gel properties of myofibrillar protein under oxidative conditions
2.3.3 凝胶白度
未氧化MP凝胶白度约为63.7,氧化使凝胶白度略有降低(图5)。与本研究结果类似,李银等[35]发现随着氧化强度增强,猪肉MP热诱导凝胶白度呈下降趋势。在氧化条件下,当L-Arg浓度为1 mmol/L时,凝胶白度并无显著差异(P>0.05),而后凝胶白度随L-Arg浓度的增加显著降低,当浓度为10 mmol/L时,凝胶白度为52.9,与氧化后MP凝胶相比降低了约13.3%(P<0.05),这是由于L-Arg自身的颜色,导致MP凝胶白度随L-Arg添加量增大而下降。
2.3.4 凝胶强度
如图5所示,未氧化MP样品的凝胶强度约为1.08 N,氧化使得凝胶强度降低了约26.9%(P<0.05),L-Arg的加入促进了氧化引起的凝胶弱化,随着L-Arg浓度的增加,凝胶强度逐渐降低;在10 mmol/L时,MP样品的凝胶强度降至0.20 N,与氧化MP样品的凝胶强度相比,降低约74.7%(P<0.05)。Zhang Yinyin等[18]报道加入0.4%的L-Arg,可有效提高肌原纤维断裂指数,从而增加肉的嫩度。肉嫩度提高的原因主要是肌原纤维和肌膜的连接被破坏,从而使得肌原纤维易于断裂,凝胶强度降低但肌肉变嫩[36]。
2.4 氧化条件下不同浓度L-Arg对MP凝胶二级结构的影响
图6显示:未氧化MP凝胶的α-螺旋、β-折叠、β-转角和无规卷曲结构相对含量分别为43.9%、27.6%、6.6%和21.9%。氧化MP凝胶中蛋白的α-螺旋和β-折叠相对含量减少,而β-转角和无规卷曲相对含量增多。Xia Minquan等[37]也报道了类似的结果。当L-Arg添加量为1 mmol/L和3 mmol/L时,α-螺旋相对含量显著降低(P<0.05),而后随着L-Arg添加量的增加α-螺旋相对含量无明显变化。当L-Arg添加量为1~5 mmol/L范围时,β-折叠相对含量显著增加,当L-Arg添加量为10 mmol/L时,β-折叠相对含量略有下降但无明显差异。L-Arg的添加对β-转角相对含量的影响并不明显,但随着L-Arg添加量的增加,无规卷曲相对含量明显降低。研究表明,蛋白质凝胶持水性能与β-折叠的相对含量呈正相关[38]。因此,L-Arg的添加导致MP凝胶中蛋白的α-螺旋向β-折叠转变,大量的β-折叠可能通过分子内和分子间的相互作用提高了MP的保水能力,降低了蒸煮损失(图5)。
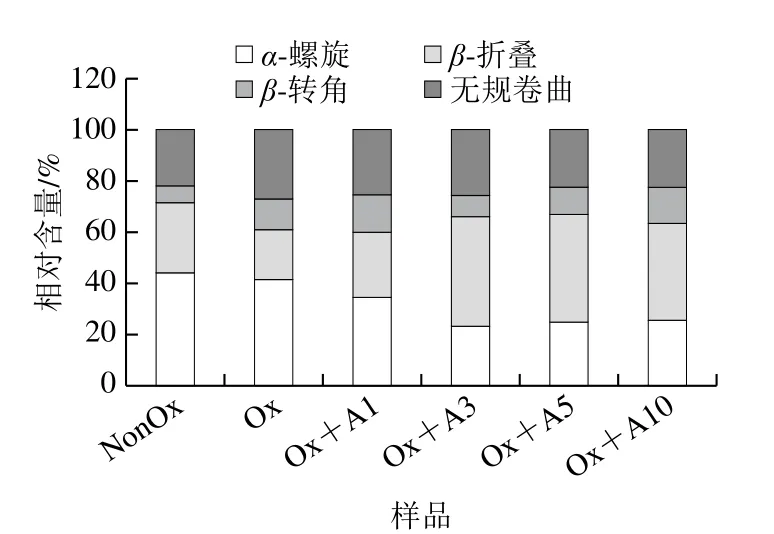
图6 氧化条件下L-Arg浓度对MP凝胶二级结构的影响Fig.6 Effects of different concentrations of L-Arg on secondary structures of myofibrillar protein gels under oxidative conditions
2.5 氧化条件下不同浓度L-Arg对MP凝胶微观结构的影响
蛋白凝胶的微观结构是表征凝胶结构的直观手段。如图7所示,未氧化MP凝胶的微观网络结构连续、均匀、致密。相比之下,氧化MP凝胶的微观网络结构粗糙、不规则,且具有大团聚体和较大的不规则孔隙[39],这也是其凝胶强度降低、蒸煮损失增加(图5)的原因。氧化条件下,当L-Arg添加量≤3 mmol/L时,MP凝胶的微观结构变化不明显,而后随着L-Arg浓度的增加,凝胶网络更加均匀规则、蛋白聚集体颗粒逐渐变小。这也解释了L-Arg的添加有效改善了氧化诱导的蒸煮损失降低(图5)。
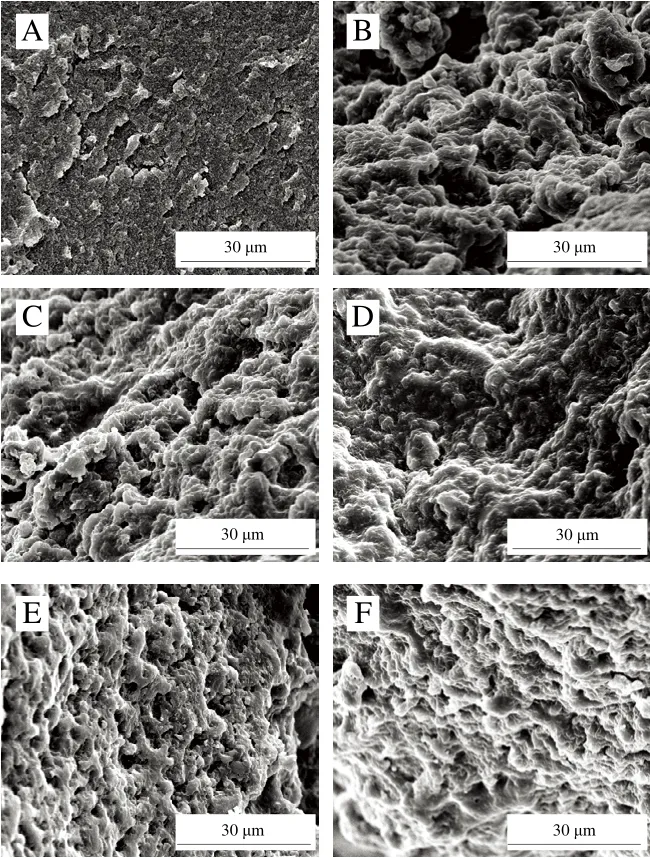
图7 氧化条件下L-Arg浓度的MP凝胶微观结构图Fig.7 Microstructure of myofibrillar protein gels with different concentrations of L-Arg under oxidative conditions
3 结 论
氧化条件下低浓度L-Arg(1~5 mmol/L)对MP中巯基有一定的保护作用,但无法阻止氧化诱导的蛋白结构展开、交联聚集和溶解度降低;高浓度L-Arg(10 mmol/L)则会显著促进巯基损失和蛋白结构展开,导致蛋白交联聚集加剧、粒度增大、溶解度降低。随L-Arg添加量增加,MP凝胶的微观结构更加细腻、凝胶强度和白度逐渐降低、凝胶得率逐渐升高。因此,添加低浓度L-Arg有望在一定程度上提高肉蛋白的氧化稳定性,改善肉制品的嫩度和持水性。此外,本研究是在高盐(0.6 mol/L NaCl)凝胶体系中进行的,低盐条件下以及实际肉体系中L-Arg的影响需要进一步深入研究。

