聚乙二醇1000维生素E琥珀酸酯-皂皮皂素微乳液的制备、表征及活性
吕奇晏,林诗叶,米亚妮,钱跃威,滕 慧,陈 雷
(1.福建农林大学食品科学学院,福建 福州 350002;2.广东海洋大学食品科技学院,广东 湛江 524025)
微乳液是一种透明或半透明、低黏度、各向同性和热力学稳定的油水混合物体系,由水相、油相和表面活性剂和助表面活性剂自发形成[1]。微乳液的粒径为1~100 nm,主要包括“油包水(W/O)”型和“水包油(O/W)”型两大类[2]。微乳液能够以相对简单的成分自发形成,增溶和递送亲水性和亲脂性药物并通过小液滴尺寸改善药物的生物利用度和稳定性。由于微乳液中油水分散体系可在消化系统中充分扩散,因此,作为药物递送介质时可提高被包载成分的消化吸收[3-4]。大部分微乳液体系中的乳化剂多为合成乳化剂,而合成乳化剂存在毒性大、刺激性强的问题[5],随着可持续发展观念在消费者心中日益加深,微乳液中常见的合成乳化剂很难满足消费者对天然绿色食品的追求。
聚乙二醇1000维生素E琥珀酸酯(D-α-tocopheryl polyethylene glycol 1000 succinate,TPGS)是一种毒性小、刺激性低的表面活性剂[6],通过亲水性聚乙二醇和疏水性α-生育酚琥珀酸酯(维生素E衍生物)酯化合成,因此含有疏水性烷基尾部和亲水极性头部,具有两亲性[7]。由于其独特的两亲性结构,故而可以作为优异的疏水性物质增溶剂、稳定剂和乳化剂[8]。此外,TPGS也被证实具有抑制P-糖蛋白(P-glycoprotein,P-gp)(药物外排泵蛋白)外排的作用[9],可以通过抑制P-gp外排达到改善某些天然植物化合物或药物在体内的吸收利用[10],增强亲脂性药物在肠道淋巴运输中的功能,促进肠道上皮细胞分泌乳糜微粒[11]。在食品领域中,采用TPGS包被食品活性成分可延长其在体内的循环时间,从而增强溶解性和口服生物利用度[12-14]。基于TPGS的特殊属性和对药物的增溶、乳化、促吸收作用,本研究拟以TPGS为基底乳化剂,开展功能性复配乳化剂研究,从营养学角度探索能适用于食品科学的微乳液递送载体。
皂皮皂素(quillaja saponin,QS)是一种源自智利皂皮树的天然植物化学物质[15],QS分子较小,由糖苷配基(疏水)和一个或多个糖链(亲水)形成,具有两亲性,从而具有表面活性和良好的乳化特性[16]。QS作为天然乳化剂,具有来源丰富、易提取的优势,通常较合成表面活性剂具有更好的可持续性、生物降解性和生物相容性[17]。有研究表明,QS在亲水性和疏水性环境中显示出对自由基的抗氧化活性[18],具有很强的界面自组装行为,与其他乳化剂复配时可明显减小纳米乳液的粒径,提高乳液的物理稳定性[19-20]。此外,QS可降低合成乳化剂在食品中的使用量,对于喜爱天然或“绿色”食品的消费者而言更为理想,天然乳化剂的毒性通常也较合成表面活性剂低[21]。虽然TPGS与QS在增强活性成分的吸收利用率方面优势较多,但较少应用于食品微乳液,将两者复配作为乳化剂在微乳液体系中发挥优势的研究鲜见报道。基于此,本研究选用TPGS及QS与具有优良乳化效果的聚氧乙烯氢化蓖麻油(RH40)共同作为乳化剂,再选择相应的油相和助乳化剂,配制具有一定生物活性且毒性小的微乳液,以期探索TPGS和QS复配在微乳液体系中的作用,研究其在分散度、粒径、细胞毒性、酶活性及抗氧化活性等方面的特性,为改善食品中重要活性成分的生物利用度提供解决方案。
1 材料与方法
1.1 材料与试剂
TPGS、尼罗红 阿拉丁生化科技股份(上海)有限公司;QS(纯度≥99%,皂苷质量分数20%~35%)美国Sigma公司;RH40 上海源叶生物科技有限公司;油酸乙酯 上海麦克林生化科技有限公司;异丙醇国药集团化学试剂有限公司;亚甲基蓝 天津市恒兴化学试剂制造有限公司;噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)德国Biofroxx公司;MEM非必需氨基酸溶液 美国Gibco公司;其他化学药品和试剂均为分析纯。
1.2 仪器与设备
BSA124S电子分析天平 德国Sartorius公司;KQ-300DE超声机、ZNCLB恒温数控磁力搅拌器 厦门致辉仪器有限公司;ZEN3700 Zetasizer Nano ZS纳米粒度仪英国Malvern公司;Model-Eclipse Ts2倒置光学显微镜日本尼康公司;HT-7700透射电子显微镜(transmission electron microscope,TEM) 日本日立公司;HMSY96酶标仪 加拿大美谷分子公司;SW-CJ-1D超净工作台 苏州安泰空气技术有限公司;CCL-170B-8 CO2培养箱 新加坡艺思高科技有限公司。
1.3 方法
1.3.1 TPGS-QS微乳液的制备及配方筛选
根据陈小威[22]的研究结果,QS临界质量分数为1.5%制备的纳米乳滴乳液呈良好单分散性和稳定性,大于此质量分数时皂苷分子分散于水相中。考虑TPGS及QS在整个微乳液体系中所占比例,选择质量分数1.5% QS溶液和质量分数0.2%、0.02% TPGS溶液与RH40复配作为乳化剂,异丙醇为助乳化剂,油酸乙酯为油相;所用溶液均以纯水配制。其中乳化剂(QS∶TPGS)∶RH40=(1∶1)∶3(m/m),乳化剂与助乳化剂质量比为3∶1,乳化剂与助乳化剂总质量与油相的质量比分别为5∶5、6∶4、7∶3和8∶2。均质1 min后,取一定量混合物于纯水中稀释100 倍,再用磁力搅拌器190 r/min常温搅拌15 min,然后根据微乳液粒径、聚合物分散性指数(polymer dispersity index,PDI)及Zeta电位选择最优配方。
1.3.2 微乳液粒径、PDI及Zeta电位的测定
将纯水稀释100 倍的微乳液充分摇匀,采用激光粒度仪测定粒径、粒径分布及Zeta电位。折光系数设定为1.468,吸光指数为0.001。
1.3.3 乳液类型判断
将尼罗红(油溶性染料)和亚甲基蓝(水溶性染料)分别滴入相同体积纯水稀释100 倍的微乳液中,观察液滴在微乳液中的扩散速率及颜色变化。滴入尼罗红后,若乳液皆为染料颜色且染料在乳液中扩散速率快,则该乳液为W/O型,若乳液出现分层,则为O/W型。滴入亚甲基蓝(水溶性染料)与尼罗红相反,若滴入后快速扩散,则为O/W型,否则为W/O型。
1.3.4 TPGS-QS微乳液的形貌观察
TPGS-QS微乳液用纯水稀释5 倍,采用倒置光学显微镜观察其基本形貌。
取经适量纯水稀释10 倍后的微乳液滴加到200 目铜网表面,滤纸吸取多余液体,2%磷钨酸溶液负染2 min,再用滤纸吸取多余液体,待完全干透后置于TEM下观察微乳液,进行形态学评价。
1.3.5 TPGS-QS微乳液相关活性测定
1.3.5.1 DPPH自由基清除能力
参考Teng Hui等[23]的方法并稍作修改,测定样品对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率。将200 μL微乳液与800 μL 1 μmol/L DPPH-乙醇溶液振荡充分混合后于室温下避光保存30 min,用酶标仪在517 nm波长处测定吸光度。重复测定3 次。DPPH自由基清除率按式(1)计算:
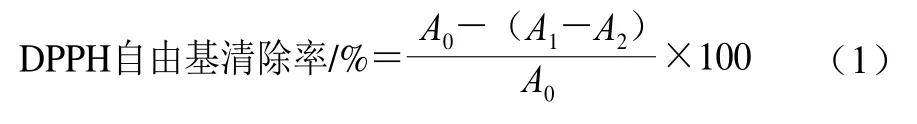
式中:A0为蒸馏水代替样品溶液的吸光度;A1为待测溶液吸光度;A2为无水乙醇代替DPPH溶液的吸光度。
1.3.5.2 ABTS阳离子自由基清除能力
参考Chen Lei等[24]的方法并稍作修改,测定样品对2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基的清除率。取10 mL 7 mmol/L ABTS溶液与10 mL 2.45 mmol/L K2S2O4溶液充分混匀制备ABTS工作液,置于无光照室温环境下保存12~16 h。用磷酸盐缓冲液(phosphate buffered saline,PBS)稀释ABTS工作液至其在734 nm波长处的吸光度为0.70±0.05。将微乳液与稀释后的ABTS工作液按体积比1∶19混合,涡旋1 min,于室温条件静置6 min后,用酶标仪于734 nm波长处测定溶液吸光度。实验重复测定3 次,ABTS阳离子自由基清除率按式(2)计算:
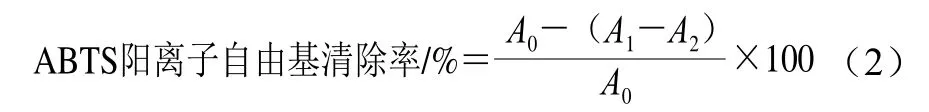
式中:A0为蒸馏水代替样品溶液的吸光度;A1为待测液吸光度;A2为无水乙醇代替ABTS工作液的吸光度。
1.3.5.3 FRAP
铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)法是通过测定样品将Fe3+还原为Fe2+的能力反映样品的总抗氧化能力[25]。取0.775 g C2H9NaO5于4 mL冰醋酸中溶解,定容至25 mL,再用1 mol/L HCl溶液调节pH值至3.6配制成A液;取7.8 mg三吡啶基三嗪于50 ℃下溶解于2.5 mL 40 mmol/L HCl溶液中,配制得B液;取13.5 mg FeCl3·6H2O溶于2.5 mL水,配制得C液。然后按V(A液)∶V(B液)∶V(C液)=10∶1∶1混合得FRAP工作液,现配现用。测定时,待测样品与FRAP工作液按照体积比1∶19混合,静置20 min,用酶标仪于593 nm波长处测定吸光度。选择不同质量浓度FeSO4·7H2O溶液绘制标准曲线,得到方程y=0.649 6x+0.071 2(R2=0.999 7),将所测吸光度代入方程计算FRAP,单位为mmol/L。实验重复测定3 次。
1.3.5.4α-葡萄糖苷酶抑制活性
采用4-硝基酚-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucoside,PNPG)比色法测定TPGS-QS微乳液对α-葡萄糖苷酶的抑制活性[26]。取100 μL不同质量浓度TPGSQS微乳水溶液,加入50 μL 0.1 mol/L PBS,摇匀后加入50 μL 2 U/mLα-葡萄糖苷酶溶液,混合均匀后于37 ℃恒温水浴15 min,然后加入100 μL 5 mmol/L PNPG,37 ℃反应10 min后加入750 μL 0.2 mol/L Na2CO3溶液终止反应,混合均匀后将溶液移入96 孔板,每孔200 μL,用酶标仪于405 nm波长处测定吸光度。α-葡萄糖苷酶活性抑制率按式(3)计算。使用SPSS软件计算半抑制质量浓度(half inhibitory concentration,IC50)。
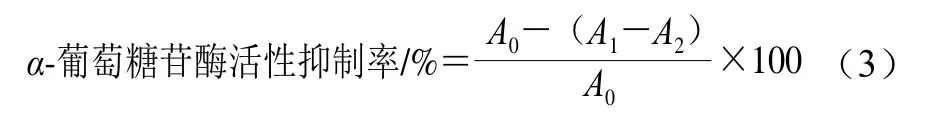
式中:A0为PBS代替样品溶液的吸光度;A1为待测液吸光度;A2为PBS代替酶溶液的吸光度。
1.3.6 TPGS-QS微乳液对HepG2细胞和Caco-2细胞的毒性测定
参考陈雷等[27]的方法并稍作修改,将HepG2细胞或Caco-2细胞置于DMEM培养基中,于5% CO2环境下培养。HepG2细胞培养基中含有10%加热灭活的胎牛血清和1%青霉素链霉素,Caco-2细胞培养基中含有10%胎牛血清、1%青霉素链霉素、1% MEM非必需氨基酸溶液和1%谷氨酸胺。采用MTT法[28],取培养至对数生长期的HepG2细胞或Caco-2细胞,用PBS清洗、胰酶消化后,接种于96 孔板中,细胞密度为5×104个/孔,于37 ℃、5% CO2培养箱中培养24 h。用二甲基亚砜(dimethyl sulfoxide,DMSO)配制质量浓度100 mg/mL的TPGSQS微乳溶液,再用PBS稀释至不同质量浓度,稀释后的样品溶液加入96 孔板,每孔20 μL,37 ℃培养24 h后,每孔加入20 μL 5 mg/mL MTT溶液,继续避光培养4 h。培养结束后,除去MTT,每孔加入150 μL DMSO,轻微振荡10 min充分溶解,使用酶标仪在490 nm波长处测定吸光度。以PBS替代样品溶液为对照孔,细胞存活率按式(4)计算:
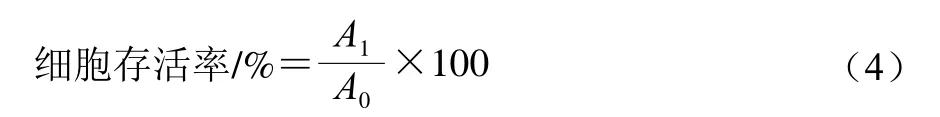
式中:A1为样品孔吸光度;A0为对照孔吸光度。
1.4 数据处理与分析
2 结果与分析
2.1 TPGS-QS微乳液乳化效果
不同比例TPGS-QS微乳液用纯水稀释100 倍磁力搅拌15 min后乳化效果如图1所示。溶液澄清透明或微泛蓝光,乳化等级可评定为A级;溶液略浑浊且泛蓝光,乳化等级为B级;溶液为亮白色不透明液体,无蓝光,乳化等级为C级;溶液呈灰白色,略带油状,乳化等级为D级;难乳化,存在大量油滴或有絮状物,乳化等级为E级。据此标准判断,油相质量分数20%且TPGS质量分数0.02%、0.2%的乳液可评定为A级,油相质量分数30%、40%且TPGS质量分数0.02%、0.2%的乳液为B级,油相质量分数50%且TPGS质量分数0.02%的乳液为C级。因此,在此微乳液体系中油相质量分数在30%以下时乳化效果较好,但由于一般乳化剂的毒性作用,油相质量分数越高,乳化剂越少的微乳液体系更适合用于后续的生物活性研究,因此结合乳化效果,选择油相质量分数30%的TPGS-QS微乳液。
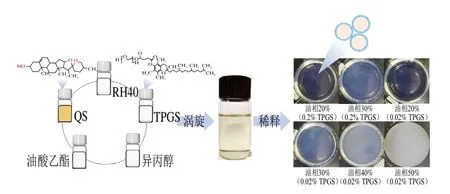
图1 TPGS-QS微乳液合成示意图及不同比例TPGS-QS微乳液的乳化效果Fig.1 Schematic diagram of microemulsion synthesis and emulsifying effect of a series of TPGS-QS microemulsion
2.2 TPGS-QS微乳液的粒径、PDI及Zeta电位
不同比例TPGS-QS微乳液的粒径、PDI及Zeta电位测定结果如表1所示。微乳液的粒径范围为10~100 nm,因此油相质量分数50%的TPGS-QS乳液不能称之为微乳液。油相质量分数为30%时,粒径较为合适,并且TPGS质量分数为0.02%与0.2%的微乳液粒径及PDI相差较小,其中0.02% TPGS微乳液的粒径和PDI相对较小,分别为(48.89±0.08)nm及0.125±0.006。6 组微乳液的Zeta电位均无显著差异,但粒径和PDI差异显著,这可能是由于QS与TPGS的两亲性结构在体系中产生的范德华力及纯水稀释后的氢键作用力使微乳液流动性增强。综合粒径和PDI结果可知,油相质量分数30%且TPGS质量分数0.02%的微乳液粒径最小,PDI也较小,相对稳定,因此最终选择m(油酸乙酯)∶m(质量分数0.02% TPGS溶液)∶m(质量分数1.5% QS溶液)∶m(RH40)∶m(异丙醇)=30∶6.6∶6.6∶39.4∶17.5为TPGS-QS微乳液作为最佳配方,并用于后续相关活性研究。
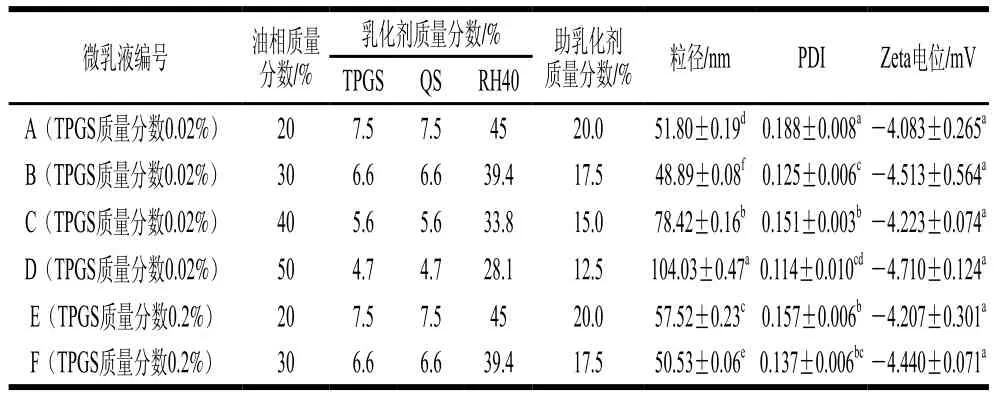
表1 不同比例TPGS-QS微乳液的粒径、PDI及Zeta电位Table 1 Particle size, PDI and zeta potential of different formulations of TPGS-QS microemulsion
2.3 TPGS-QS微乳液类型
尼罗红为油溶性染料,亚甲基蓝为水溶性染料。由图2可知,加入尼罗红的TPGS-QS微乳液出现分层现象,说明亚甲基蓝在TPGS-QS微乳液中的扩散速率较尼罗红快,由此可判断TPGS-QS微乳液为O/W型乳液。

图2 加入尼罗红和亚甲基蓝染色剂的TPGS-QS微乳液对比图Fig.2 Comparison of TPGS-QS microemulsion with added Nile red and methylene blue
2.4 TPGS-QS微乳液的形态
如图3A所示,TPGS-QS微乳液外观呈淡黄色、透明、流动性好的液体状;加入纯水稀释5 倍后在放大倍数20 倍下用光学显微镜进行形态观察,TPGS-QS微乳液表现为均匀分散的圆球形液滴(图3B)。TPGS-QS微乳液稀释10 倍,图3C、D分别为其放大倍数10 000 倍和20 000 倍的TEM图,TPGS-QS微乳呈规则球形,且粒径较均一。

图3 TPGS-QS微乳液实物及微观形貌Fig.3 Visual and microscopic observation of TPGS-QS microemulsion
2.5 TPGS-QS微乳液的体外抗氧化活性
TPGS是VE水溶性衍生物,QS是天然的植物化学物质,有报道称QS具有良好的抗氧化活性[29],为判断含TPGS和QS的微乳液是否具有抗氧化活性,分析其体外抗氧化活性。由图4A可知,随着TPGS-QS微乳液质量浓度的增加,其FRAP逐渐增强,但趋势较平缓,80 mg/mL的TPGS-QS微乳液可还原Fe3+浓度为(0.150±0.003)mmol/L。由图4B、C可知,TPGS-QS微乳液的ABTS阳离子自由基和DPPH自由基清除能力均随质量浓度的增加显著增强(P<0.05)。质量浓度200 μg/mL时,TPGS-QS微乳液的ABTS阳离子自由基清除率为(37.27±0.76)%;而TPGS-QS微乳液对DPPH自由基清除能力较弱,质量浓度200 mg/mL时,DPPH自由基清除率为(20.70±1.11)%。由于TPGS和QS在微乳液中含量较低,TPGS-QS微乳液的抗氧化活性远不及一般天然化合物,但作为药物递送介质,其仍然具有一定的抗氧化活性,且存在明显的剂量依赖性,推测其在药物负载量较低的情况下不会对药物的抗氧化活性产生较大影响。
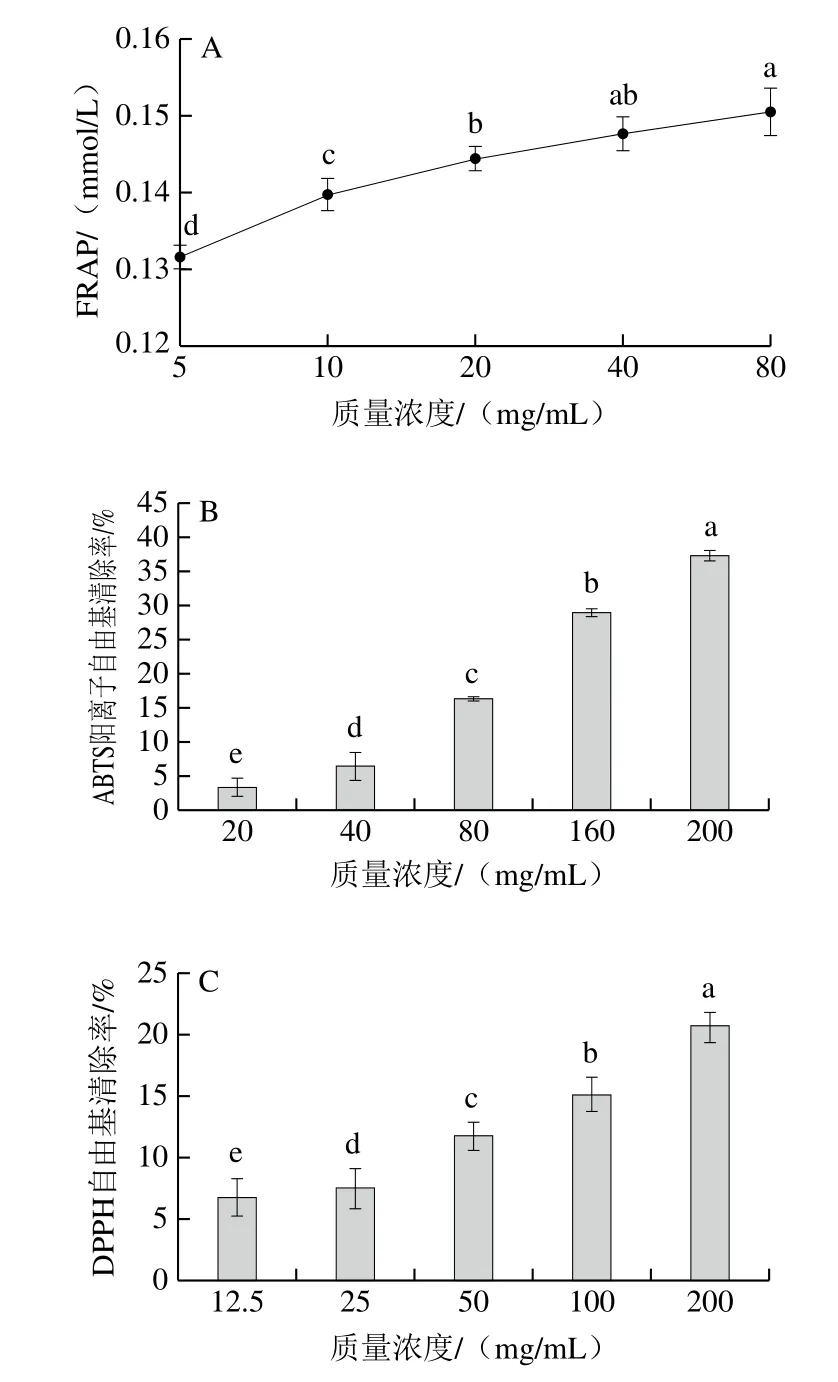
图4 TPGS-QS微乳液的体外抗氧化活性Fig.4 Antioxidant activity in vitro of TPGS-QS microemulsion
2.6 TPGS-QS微乳液对α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶可水解葡萄糖苷键,释放葡萄糖,主要通过抑制α-葡萄糖苷酶活性控制或降低血糖含量,治疗糖尿病[30]。测定α-葡萄糖苷酶抑制活性,可评估样品潜在的抗糖尿病能力,阿卡波糖为传统的糖尿病治疗药物。由表2可知,阿卡波糖对α-葡萄糖苷酶活性抑制作用的IC50为0.026 μg/mL。TPGS、QS及TPGS-QS微乳液也具有一定的α-葡萄糖苷酶抑制能力,且在一定范围内存在明显的剂量-效应关系,TPGS对α-葡萄糖苷酶活性抑制作用的IC50为21.58 mg/mL,QS为0.12 mg/mL,TPGS-QS微乳液为67.15 mg/mL,均高于阿卡波糖的IC50,且0.02% TPGS与1.5% QS复配为TPGS-QS微乳液,与TPGS、QS相比,其IC50显著升高(P<0.05)。QS对α-葡萄糖苷酶抑制效果较好,由于用作微乳液乳化剂时含量较低,TPGS-QS微乳液的α-葡萄糖苷酶抑制活性较QS降低。
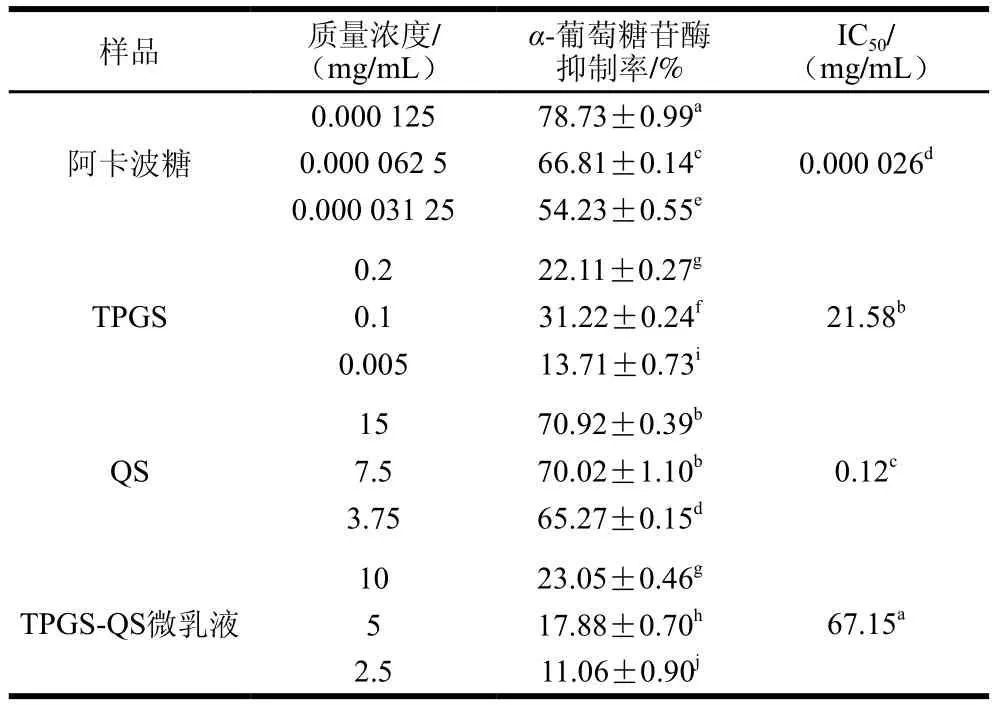
表2 TPGS-QS微乳液及其组分的α-葡萄糖苷酶抑制能力Table 2 α-Glucosidase inhibitory activity of TPGS-QS microemulsion and its components
2.7 TPGS-QS微乳液对HepG2细胞和Caco-2细胞的毒性作用
传统乳化剂毒性较大,TPGS-QS微乳液中TPGS作为乳化剂时具有毒性小的特点,而QS也是一种天然植物化合物,这两种物质与RH40复配为乳化剂,可相对降低该微乳液的毒性。为验证TPGS-QS微乳液的毒性作用,采用MTT法测定其对HepG2及Caco-2细胞的毒性作用,结果如图5所示。TPGS-QS微乳液对HepG2细胞毒性很小,微乳液质量浓度5~500 μg/mL时,HepG2细胞存活率均高于90%,且对HepG2细胞表现出一定的增殖效果,500 μg/mL时增殖效果最明显,细胞存活率可达(115.16±4.35)%。此外,质量浓度10、40、80 μg/mL的TPGS-QS微乳液对HepG2细胞虽无增殖作用,但此时的细胞存活率也达98%以上,几乎对HepG2细胞无损伤。
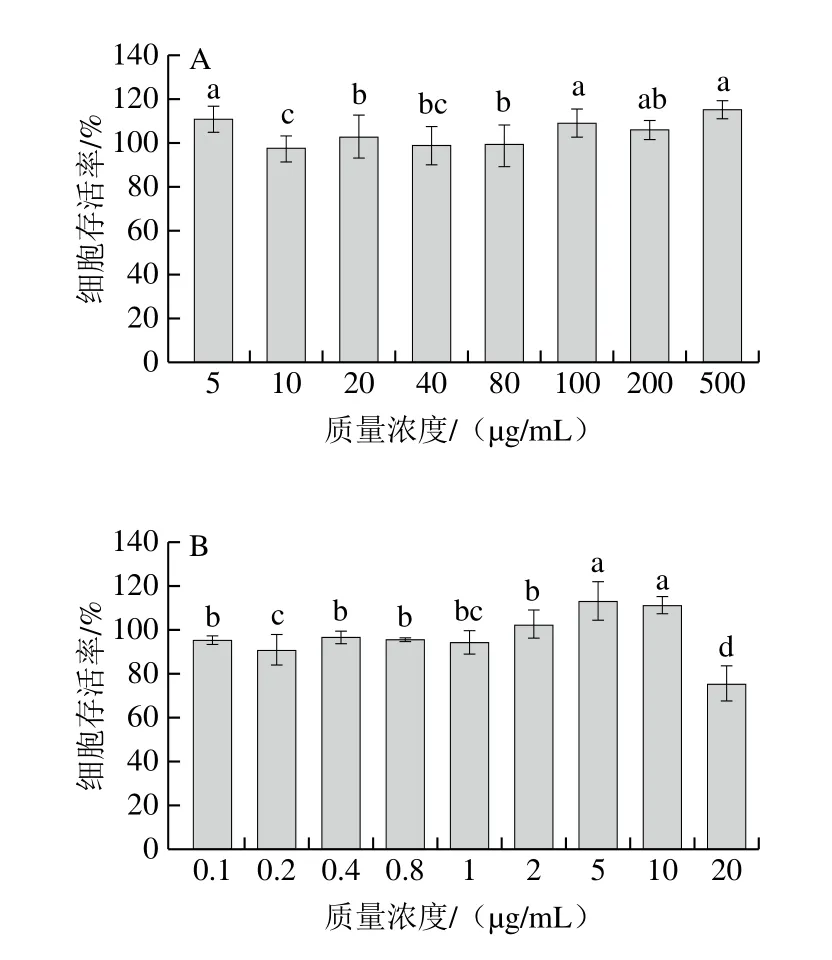
图5 TPGS-QS微乳液对HepG2细胞(A)和Caco-2细胞(B)的毒性作用Fig.5 Toxicity of TPGS-QS microemulsion on HepG2 cells (A) and Caco-2 cells (B)
对于Caco-2细胞,TPGS-QS微乳液质量浓度20 μg/mL时,细胞存活率低于80%,为(75.34±8.53)%,质量浓度低于20 μg/mL时,细胞存活率均在90%以上,其中2、5、10 μg/mL的TPGS-QS微乳对Caco-2细胞有增殖效果,5 μg/mL时细胞增殖作用最强,存活率为(113.38±8.76)%。
综上所述,由于TPGS和QS毒性较小,以此作为乳化剂的TPGS-QS微乳液对细胞几乎无毒性作用,在作为药物递送介质时,可忽略其对细胞的损伤,为更好、更安全地提高药物吸收利用度且不破坏细胞结构提供了良好基础。
3 结 论
本研究提供一种可提高食品活性物质生物利用率且具有一定生物活性的微乳液制备方法。基于TPGS和QS强大的生物活性及溶液相容性原则,选择质量分数1.5% QS、质量分数0.02% TPGS与RH40复配为乳化剂,再与油酸乙酯及异丙醇结合制备外观淡黄、澄清透明、流动性强的TPGQ-QS微乳液,该微乳液具体配制方法为m(油酸乙酯)∶m(质量分数0.02% TPGS溶液)∶m(质量分数1.5% QS溶液)∶m(RH40)∶m(异丙醇)=30∶6.6∶6.6∶39.4∶17.5。通过滴加水溶性染料和油溶性染料可知该微乳液为O/W型。对其进行粒径和Zeta电位检测,发现该微乳液粒径较小,聚合程度较高且较为稳定。经过光学显微镜及TEM观察可知,TPGS-QS微乳液为均一规则的圆球形液滴,证明乳液成分分散程度低,状态稳定。TPGS-QS微乳具有一定的α-葡萄糖苷酶抑制活性和体外抗氧化活性。TPGS-QS微乳液对HepG2及Caco-2细胞的生长几乎无抑制作用,甚至表现出对两种细胞的增殖效果,可见TPGS-QS微乳液不会影响细胞的正常生长。该研究为天然成分代替合成成分作为乳液基质提供了思路,也为改善食品活性成分的生物利用度奠定基础。

