多巴胺激活Kv通道抑制胰岛素分泌的电生理机制
薛 欢,钟向琴,刘萌萌,路志红,温芝潼,崔丽娟,石晓媛,邢皓杰,赵 昕,张语珊,章 毅
(山西医科大学基础医学院药理学教研室,山西 太原 030001)
多巴胺(dopamine,DA)具有调节神经元活性,执行中枢神经系统各种功能的作用,是最重要的神经递质之一[1]。研究表明多巴胺也可以在胰腺、肾脏和肺等外周组织中合成并释放,发挥非神经功能[2-3]。目前发现有5种不同的多巴胺受体(DR)亚型(D1R-D5R),根据生物化学和药理学特性,分为D1样受体(D1受体和D5受体)和D2样受体(D2-D4受体)[4]。临床研究显示,长期接受多巴胺前体左旋多巴治疗的帕金森氏病患者的糖耐受力明显降低,发展为2型糖尿病的概率增高[5]。研究表明多巴胺能够调控葡萄糖刺激的胰岛素分泌[6]。电生理的改变是影响β细胞分泌胰岛素的重要原因[7],然而,多巴胺对β细胞电生理的影响目前还没有系统的研究。本研究通过胰岛素分泌实验、DiBAC4(3)荧光染色、全细胞膜片钳,研究多巴胺调控胰岛素分泌的电生理机制,并深入探讨D1样受体和D2样受体在其中的作用。
1 材料与方法
1.1 实验动物SD大鼠,♂,体质量(180-250)g,7~8周龄,由山西医科大学实验动物中心提供。饲养条件:(20~22)℃,湿度(50±5)%,给予标准啮齿动物食物及饮用水。生产许可证号:SCXK(晋)2015-0001。
1.2 实验试剂DA(美国Sigma,批号:11104222),胶原酶P(瑞士Roche,批号:11104222),Dispase Ⅱ(美国Amresco,批号:10888700),血清白蛋白(中国 Solarbio,批号:83100513),Histopaque-1077(美国Sigma,批号:RNBF 1783),RPMI 1640培养基(加拿大BBI,批号:E600025),D-葡萄糖(中国Solarbio,批号:405A0918),HEPES(中国Solarbio,批号:710B048),Eticlopride(美国 Sigma,批号:00055132),Quinpirole(美国Sigma,批号:00069336),SKF38393(美国Sigma,批号:00055189)。
1.3 实验仪器CO2细胞培养箱(德国Eppendorf,型号:CellXpert C170i),倒置显微镜(日本OLYMPUS,型号:AE2000),PP-380垂直电极拉制仪(日本Narishige,型号:PP-380),MF-200微电极抛光仪(日本Narishige,型号:MF-200),EPC10全自动膜片钳(德国HEKA,型号:LAMBDA 10-B)。
1.4 实验方法
1.4.1大鼠胰岛和β细胞的制备 首先将SD大鼠断头,在无菌实验台上剪开腹腔,找到胆总管,然后将含有1 g·L-1胶原酶P(5 mL)的插管插入,胰腺充盈后轻轻剥离,于37 ℃水浴槽中进行约13 min的振荡消化,离心后弃除上清,加入Histopaque-1077液(10 mL),离心后挑取分散在分离液中胰岛组织。所获胰岛再用Dispase Ⅱ(5 g·L-1)消化约5 min,则得到胰岛β细胞。
1.4.2INS-1细胞的培养 大鼠胰岛β细胞系(INS-1)购自国家实验细胞资源共享服务平台(北京总部)。将INS-1细胞置于含50 μmol·L-1β-巯基乙醇、10%胎牛血清、1%青霉素以及1%链霉素的RPMI 1640培养基中,放在37 ℃、5%CO2细胞培养箱中培养。细胞密度到达80%后,按照1 ∶3比例进行传代培养。
1.4.3胰岛素分泌实验 配制KRBH溶液和待测样品溶液,每组标记7个Ep管。首先向每个Ep管中加入500 μL 2.8 mmol·L-1葡萄糖溶液,然后放入5个大小均一且边缘光滑的胰岛,在培养箱内孵育30 min;吸除上清,根据不同实验要求,分别加入500 μL 2.8 mmol·L-1葡萄糖溶液(即2.8G组)、16.7 mmol·L-1葡萄糖溶液(即16.7G组)、16.7 mmol·L-1葡萄糖+10 μmmol·L-1DA混合液(即16.7G+10 μmol·L-1DA组)、16.7 mmol·L-1葡萄糖+10 μmol·L-1SKF38393混合液(即16.7G+10 μmol·L-1SKF组)、16.7 mmol·L-1葡萄糖+10 μmmol·L-1Quinpirole混合液(即16.7G+10 μmol·L-1Quin组)、16.7 mmol·L-1葡萄糖+10 μmmol·L-1Eticlopride混合液(即16.7G+10 μmol·L-1Eti组)、16.7 mmol·L-1葡萄糖+10 μmmol·L-1DA+10 μmmol·L-1Eticlopride混合液(即16.7G+10 μmol·L-1DA+10 μmol·L-1Eti组),置于细胞培养箱中孵育30 min;将上清液吸出,保存到对应的Ep管中,4 ℃冰箱保存;各组上清液中胰岛素含量通过酶联放射免疫法检测。
1.4.4膜片钳实验 将培养24 h的β细胞玻片放在浴槽内,在显微镜下找到β细胞(≥7 pF),抛制电极并入液,当电阻增加0.5-1 MΩ时进行高阻封接。在电压钳模式下,钳制细胞膜电位在-70 mV并进行快电容补偿,破膜后通过慢电容补偿将细胞膜电容调至≥7 MΩ;每10 mV一个步阶,记录在-70 mV~+80 mV电压刺激下400 ms内的电流。在电流钳模式下,给予150 pA、4 ms的电流刺激,把从去极化开始到复极化至静息电位以上10 mV的这段时间作为动作电位时程。
1.4.5DiBAC4(3)荧光染色 DiBAC4(3)是能够感受电压变化的荧光染料。将INS-1细胞均匀接种在96孔板中,待细胞密度达到75%左右,更换培养液为2 μmol·L-1DiBAC4(3)荧光染料的2.8 mmol·L-1葡萄糖混合液(现配现用),于孵箱中培养30 min;孵育结束后用2.8 mmol·L-1葡萄糖溶液清洗;然后依次用16.7 mmol·L-1葡萄糖溶液(即16.7G)和16.7 mmol·L-1葡萄糖+10 μmmol·L-1DA混合液(即16.7G+DA)孵育。使用Cytation 5细胞成像多功能系统(美国BioTek公司)检测489 nm和525 nm波长下的细胞荧光强度,检测出的荧光强弱对应于细胞膜电位的大小。
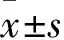
2 结果
2.1 DA对胰岛素分泌的影响以及D1样受体和D2样受体在其中的作用与基础葡萄糖(2.8G)相比,高糖(16.7G)明显促进了胰岛素分泌(P<0.01)。与单独给予高糖相比(16.7G),DA(16.7G+10 μmol·L-1DA)明显抑制了胰岛素分泌(P<0.01)。分别使用D1样受体激动剂(SKF38393)和D2样受体激动剂(Quinpirole)进行干预,结果显示SKF38393(16.7G+10 μmol·L-1SKF)对胰岛素分泌没有明显影响;而Quinpirole(16.7G+10 μmol·L-1Quin)明显抑制了胰岛素分泌(P<0.01)。以上结果初步表明DA可能通过D2样受体发挥抑制葡萄糖刺激的胰岛素分泌作用。见Tab 1。

Tab 1 Effect of DA, SKF38393 and Quinpirole
2.2 D2样受体阻断剂Eticlopride对胰岛素分泌的影响为了进一步阐明D2样受体在DA抑制胰岛素分泌中的作用,使用D2样受体阻断剂(Eticlopride)进行干预。结果显示Eticlopride(16.7G+10 μmol·L-1DA+10 μmol·L-1Eti)很大程度上消除了DA(16.7G+10 μmol·L-1DA)对胰岛素分泌的抑制作用(P<0.01)。结合以上数据表明DA主要通过D2样受体发挥抑制胰岛素分泌的作用。见Tab 2。
2.3 DA对Kv通道的影响及D1样受体和D2样受体在其中的作用与对照组相比较,DA(10 μmol·L-1DA)明显增加了β细胞膜上Kv通道电流(P<0.01)。分别使用D1样受体激动剂(SKF38393)和D2样受体激动剂(Quinpirole)进行干预,结果显示SKF38393(10 μmol·L-1SKF)对Kv通道电流没有明显影响;而Quinpirole(10 μmol·L-1Quin)则明显增加了β细胞的Kv通道电流(P<0.01)。初步表明DA通过D2样受体抑制Kv通道。见Tab 3和Fig 1。

Tab 2 Effect of Eticlopride on insulin eecretion n=7)

Fig 1 Effects of DA(10 μmol·L-1), SKF38393(SKF,10 μmol·L-1) and Quinpirole(Quin,10 μmol·L-1) on Kv currents of β cells

Tab 3 Effects of DA, SKF38393 and Quinpirole on Kv currents of β cells pA/pF, n=7)
2.4 D2样受体阻断剂Eticlopride对β细胞电压依赖性钾(Kv)通道的影响为了进一步阐明D2样受体在DA调控Kv通道中的作用,使用D2样受体阻断剂(Eticlopride)进行干预。与单独给予DA(10 μmol·L-1DA)相比,Eticlopride(10 μmol·L-1DA+10 μmol·L-1Eti)明显地消除了DA对Kv通道电流的促进作用(P<0.01)。结合以上数据表明,DA主要通过D2样受体激活Kv通道,进而抑制胰岛素分泌。见Tab 4和Fig 2。

Tab 4 Effect of Eticlopride on Kv currents of β cells pA/pF, n=7)

Fig 2 Effect of Eticlopride (Eti,10 μmol·L-1) on Kv currents of β cells
2.5 DA以及D2样受体阻断剂Eticlopride对β细胞动作电位时程的影响与对照组相比,DA(10 μmol·L-1DA)明显缩短了β细胞的动作电位时程(P<0.01)。进一步使用D2样受体阻断剂(Eticlopride)干预,结果显示Eticlopride(10 μmol·L-1DA+10 μmol·L-1Eti)很大程度上消除了DA对β细胞动作电位时程的抑制作用(P<0.01)。见Tab 5。

Tab 5 Effects of DA and Eticlopride on action potential duration of β cells n=7)
2.6 DA对INS-1细胞膜电位的影响结果表明,给予INS-1细胞16.7 mmol·L-1葡萄糖(16.7G)刺激,细胞膜电位明显升高;而DA(16.7G+10 μmol·L-1DA)干预后,细胞膜电位明显降低。见Fig 3。

Fig 3 Effect of DA on action potential duration of INS-1 cells (n=3)
3 讨论
越来越多的研究表明多巴胺不仅对中枢神经系统有着非常重要的作用,而且还具有调节脂质和葡萄糖代谢的作用。本课题组前期研究认为多巴胺抑制葡萄糖刺激的胰岛素分泌[8],但也有研究表明多巴胺能够促进胰岛素分泌[9]。本次实验结果显示多巴胺对高糖(16.7G)刺激下的胰岛素分泌有着明显的抑制作用,与我们前期实验结果一致,也验证了Rubí等[10]的研究报道。
多巴胺受体在INS-1E细胞、鼠和人离体胰岛组织中也广泛存在[11]。在本次实验中,使用D1样受体激动剂(SKF38393)和D2样受体激动剂(Quinpirole)特异性激动两类受体,发现SKF38393干预后胰岛素分泌量没有明显变化;而Quinpirole则表现出显著的降低胰岛素分泌的作用;Eticlopride特异性阻断D2样受体后,发现胰岛素分泌增多,多巴胺的作用被明显削弱。表明多巴胺通过D2样受体发挥抑制葡萄糖刺激的胰岛素分泌作用。
胰岛β细胞是可兴奋细胞,电生理的改变是调控其胰岛素分泌的重要原因[7,12]。葡萄糖代谢产生的ATP使β细胞膜发生去极化,促使胰岛β细胞以胞吐的方式释放胰岛素,值得注意的是电压依赖性钾(Kv)通道在细胞膜去极化时也被激活。Kv通道的作用是抑制细胞膜的去极化,是阻碍胰岛素分泌的一个重要因素[13-14]。多巴胺能够影响中枢神经系统中K+、Na+和Ca2+等多种离子通道[15-16]。此外,有报道称多巴胺可以降低环磷酸腺苷(cAMP)含量[17]。而本课题组前期关于大鼠胰岛β细胞的研究发现cAMP信号通路可以通过Kv通道影响胰岛素分泌[18]。因此本次实验着重研究了多巴胺对Kv通道的调控以及两类多巴胺受体在其中的作用。结果显示多巴胺明显增加了Kv通道电流;SKF38393对Kv通道没有明显影响,而Quinpirole则明显增加Kv 通道电流;Eticlopride特异性阻断D2样受体后,多巴胺对Kv通道的激活作用被明显削弱。表明多巴胺通过D2样受体激活Kv通道。
动作电位是激发β细胞释放胰岛素不可或缺的条件。我们发现多巴胺干预后,β细胞的动作电位时程明显缩短;进一步使用Eticlopride 特异性阻断D2样受体后,β细胞的动作电位时程明显增加,多巴胺的抑制作用被明显逆转。以上表明多巴胺能够通过D2样受体缩短β细胞的动作电位时程。此外,DiBAC4(3)染色显示多巴胺也能够降低INS-1细胞膜电位。
综上所述,多巴胺对葡萄糖刺激的胰岛素分泌有着明显的抑制作用,机制是作用于D2样受体,激活Kv通道,缩短动作电位时程,降低膜电位。本研究有助于更深入理解多巴胺调控胰岛素分泌的机制。
——从一道浙江选考生物学试题谈起

