腺苷预处理对脑缺血再灌注损伤大鼠脑组织中微RNA-29b及凋亡蛋白B细胞淋巴瘤-2、磷酸化蛋白激酶B、人髓细胞白血病1表达的影响
曹武璟,季 禾,谭 军,栗延伟,秦全凯
(1.新乡医学院第三临床学院,河南 新乡 453003;2.新乡医学院第三附属医院神经内科,河南 新乡 453003;3.新乡医学院第三附属医院功能检查科,河南 新乡 453003)
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)的治疗主要是通过阻止缺血半暗带神经元的凋亡来减轻脑缺血时脑损伤程度、缩小梗死体积。凋亡的发生主要通过促凋亡和抗凋亡蛋白的调控,在这一过程中微RNA(microRNA,miRNA)-信使RNA(messenger RNA,mRNA)轴发挥重要作用[1-2]。外界环境变化可使miRNA的表达发生变化,通过参与基因的转录后调控实现对靶基因的表达调节,从而调控细胞分化、增殖、凋亡以及细胞信号传导途径,在肿瘤发生发展、生物发育、器官形成、病毒防御、表观调控以及代谢等方面发挥调控作用[3]。在神经系统中miRNA大量表达,参与神经系统的生长、发育及病理损伤和修复[4];miRNA可通过直接作用于靶基因促进或抑制细胞的凋亡来参与脑血管疾病的发生、发展[5-6]。有研究报道,在神经系统中miR-124、miR-29b、miR-125表达水平较高[7];高英英[8]研究报道,miR-29b可通过调控靶基因蛋白激酶B(protein kinase B,Akt)磷酸化水平降低心肌细胞凋亡水平来保护心脏,探讨miR-29b在CIRI及损伤修复过程中的调控模式,对推动脑血管疾病的防治和针对CIRI治疗药物的研发具有重大意义[9-10]。近年来在缺血性脑梗死治疗的临床实践中,提出了脑缺血药物预处理的治疗理念,其中腺苷预处理(adenosine preconditioning,AP)被证实可减轻CIRI,减小脑梗死体积,起到神经保护作用,但AP的确切机制仍存在争议[11]。本研究通过观察AP对脑缺血再灌注(ischemia reperfusion,IR)大鼠脑组织miR-29b表达水平的影响,探讨miR-29b在CIRI中的作用及AP发生保护作用的机制,从基因组学层面上探讨在大鼠脑IR过程中腺苷能否通过miR-29b对脑组织起到保护作用,以期发现靶向治疗缺血性脑梗死的新思路、新途径。
1 材料与方法
1.1 实验动物健康成年雄性Sprague Dawley大鼠135只由新乡医学院动物中心提供,动物合格证号:SCXK(鲁)20190003,体质量250~280 g。将所有大鼠均分笼饲养于通风良好的动物房,室内温度控制在25 ℃左右,相对湿度40%~70%,设置12 h/12 h的光/暗周期,普通大鼠饲料喂养,可随意获得水和食物。
1.2 试剂与仪器大脑中动脉栓塞模型(middle cerebral artery occlusion model,MCAO)栓线(型号2636-A4)购自北京西浓科技有限公司,miR-29b、U6引物购自美国Invitrogen公司,腺苷、2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)购自美国 Sigma 公司,苏木精染料购自上海碧云天生物技术有限公司,B细胞淋巴瘤-2(B-cell lymphoma 2,Bcl-2)单克隆抗体、兔抗小鼠磷酸化蛋白激酶B(phosphorylated protein kinase B,p-Akt)、Akt单克隆抗体、人髓细胞白血病1(myeloid cell leukemia-1,MCL-1)单克隆抗体购自美国Bcam公司,广谱型miRNA 提取试剂、cDNA反转录试剂盒、miRNA cDNA第一链合成试剂盒(Mir-X miRNA first-strand synthesis)反转录试剂盒、TB Green染料法定量试剂盒购自北京宝日医生物技术有限公司,异丙醇购自上海化学试剂公司,放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)裂解液购自上海申能博彩生物科技有限公司;二喹啉甲酸 (bicinchoninic acid,BCA)蛋白定量试剂盒购自上海易色医疗科技有限公司,实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)仪、电泳仪和转膜仪购自美国Bio-Rad公司,Z216MK 型冷冻离心机购自德国HERMLE公司,全波长读数仪购自美国Thermofisher公司,脱水机、包埋机、石蜡切片机购自上海徕卡仪器有限公司,正置光学显微镜、成像系统购自日本尼康株式会社。
1.3 方法
1.3.1 动物分组及预处理将135只大鼠按随机数字表法分为假手术组、IR组、AP组, 每组45只。AP组大鼠在手术前3 d腹腔注射2 mL腺苷注射液(1.5 mg·kg-1),每日1次;假手术组和IR组大鼠在手术前3 d每日相同时间点腹腔注射2 mL生理盐水。
1.3.2 大鼠CIRI模型制备及神经功能损伤评分IR组和AP组大鼠参考LONGA等[12]方法,采用改良线栓法制备大鼠MCAO模型,具体步骤:大鼠术前禁食、水2 h,腹腔注射100 g·L-1水合氯醛溶液(3 mL·kg-1)进行麻醉,当大鼠对疼痛刺激反应迟钝后,备皮切开颈部皮肤,钝性分离皮下组织、神经,暴露左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA),用MCAO栓线依次结扎ECA分叉部和同侧CCA近心端,在距离颈总动脉末端约5 mm的位置剪一约0.2 mm的小口,将直径为0.2 mm的栓线沿CCA方向插入,直至MCA的起始部,深度由分叉部计算,至约(18.5±0.5)mm处即开始计时。栓塞2 h后由2名实验者根据5分制神经行为学评分标准[13]对大鼠进行神经功能损伤评分。0分:无明显神经功能障碍;1分:左侧前爪不能完全伸展;2分:行走时,大鼠向左侧(瘫痪侧)转圈;3分:行走时,大鼠身体向左侧(瘫痪侧)倾倒;4分:无自主活动能力;5分:死亡。将评分为 1~3分的大鼠纳入后续实验,轻轻向外拔栓线使大鼠大脑动脉Willis环和MCA恢复血供。假手术组大鼠不做ECA和CCA结扎,其余手术方法同IR 组和AP 组。手术过程中3只大鼠因线栓插入过深导致蛛网膜下腔出血剔除,5只大鼠因麻醉药物剂量过大或者对麻醉药物个体差异导致麻醉死亡,随时补充各组大鼠保证每组大鼠造模数量一致。术后单笼饲养大鼠,给予充足的饮水和饲料。
1.3.3 TTC染色法观察大鼠脑梗死体积手术后24 h,随机选取每组造模成功大鼠3只,腹腔注射100 g·L-1水合氯醛溶液(3 mL·kg-1)进行麻醉,麻醉成功后,断头器处死大鼠,剪开颅顶皮肤,将颅骨与颈椎交界处分开,用剪刀剪开颅骨,用组织钳向两侧分离颅骨,最后用小弯镊拨取脑组织,冰生理盐水冲洗后-20 ℃冷冻20 min;将脑组织切成2 mm的冠状切片,生理盐水冲洗,加TTC 磷酸盐缓冲液,37 ℃孵育30 min,每隔5 min翻动1次,30 min后镜下观察,正常脑组织呈红色,梗死脑组织呈现白色,数码相机拍照,计算各组大鼠脑梗死体积占比,脑梗死体积占比=(∑梗死面积×切片厚度)/(∑全脑面积×切片厚度)× 100%。
1.3.4 HE染色观察大鼠脑皮质神经元细胞存活情况每组大鼠手术后24 h随机选取3只,腹腔注射100 g·L-1水合氯醛溶液(3 mL·kg-1)进行麻醉,打开胸腔,撕去心包,腹主动脉及下腔静脉用文氏钳夹住,经左心室给予200 mL生理盐水灌注,40 g·L-1多聚甲醛液200 mL进行心脏灌流固定,随即断头、开颅,于视交叉后1~4 mm冠状切取脑组织,于40 g·L-1多聚甲醛固定液中固定24 h,行石蜡包埋,在海马平面冠状连续切片,厚度4 μm,在体积分数100%、95%、85%、75%的梯度乙醇溶液中分别脱水5 min,流水冲洗后,苏木精染色10 min,伊红液染色3 min,然后依次于体积分数 75%、85%、95%、100%梯度乙醇溶液中脱水2 min,二甲苯透明处理,中性树胶封片,显微镜观察大鼠海马脑组织病理学变化。
1.3.5 qRT-PCR法测定大鼠脑海马组织miR-29b的表达每组大鼠于手术后2、6、24、48 h随机取4只,断头、开颅,取脑海马组织,应用广谱型miRNA提取试剂提取总miRNA,用全波长读数仪测定总miRNA浓度及纯度,选取miRNA的光密度值(optical density,OD)260/OD280值在1.8~2.1之间的样本。按cDNA反转录试剂盒说明书合成cDNA,按qRT-PCR试剂盒说明书进行检测,以U6为参照,引物设计如下: miR-29b上游引物序列为5′-TCCCTGAGACCCTAACTTGTGA-3′,下游引物序列为5′-AGCATGAATCGTACCGTGAGT-3′;U6上游引物序列为5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物序列为 5′- CGCTTCACGAATTTGCGTGTCAT-3′。配制总体积为25 μL的qRT-PCR反应液:ddH2O 9.0 μL,TB Green Advantage Premix (2×) 12.5 μL,ROX Dye(50×)0.5 μL,上游引物 0.5 μL,下游引物0.5 μL,cDNA 2.0 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s;60 ℃变性20 s,62 ℃退火10 s,72 ℃延伸30 s,共40个循环。扩增完毕后进行熔解曲线分析,每个样本重复检测3次,应用2-△△Ct法计算miRNA-29b相对表达量。
1.3.6 靶基因预测软件对miR-29b凋亡相关靶基因进行预测应用TargetScan、miRDB、mirBase靶基因预测软件进行交叉分析,寻找miRNA-mRNAs轴下游与miR-29b相关的凋亡蛋白,经预测筛选出与miR-29b可能相关的凋亡蛋白为Bcl-2、Mcl-1和p-Akt蛋白,将此3种蛋白用于后续实验。
1.3.7 Western blot法检测大鼠海马组织中Bcl-2、Mcl-1和p-AKt蛋白的表达每组大鼠于手术后2、6、24、48 h随机取4只,断头、开颅,取脑海马组织,充分研磨后,取80 mg研磨组织加入蛋白裂解液,在冰上反应30 min,3 000 r·min-1离心10 min后取上清,应用BCA蛋白定量试剂盒测定蛋白浓度,制备质量分数5%分离胶、质量分数10%浓缩胶,取40 μg蛋白进行电泳,电泳开始时电压设置为80 V,进入分离胶后,电压调整为120 V,电泳结束后转移蛋白凝胶至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,电压设置为260 mA,转膜反应90 min,加入三乙醇胺缓冲盐水溶液(tris buffered saline + tween 20,TBST)清洗后,加入体积分数5%的脱脂牛奶,室温下封闭1 h,TBST清洗PVDF膜,加入甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(15 000)、p-Akt(11 000)、Akt(11 000)、Bcl-2(11 000),4 ℃孵育过夜,加入二抗室温孵育2 h,TBST洗膜3次,应用化学发光试剂显影、曝光。以GAPDH 蛋白条带作为内参,应用Bio-Rad 凝胶成像系统扫描,Image J图像软件定量分析条带灰度值,以目的蛋白的灰度值与内参蛋白灰度值的比值表示目的蛋白相对表达量。

2 结果
2.1 3组大鼠神经行为学评分及脑梗死体积比较假手术组、IR 组和AP组大鼠神经行为学评分分别为0.000±0.000、2.158±0.431、1.249±0.539,脑梗死体积占比分别为(0.000±0.000)%、(0.352±0.041)%、(0.272±0.052)%;3组大鼠神经行为学评分和脑梗死体积占比比较差异有统计学意义(F=186.500、191.300,P<0.05),IR 组和AP组大鼠神经行为学评分和脑梗死体积占比显著高于假手术组,AP组大鼠神经行为学评分和脑梗死体积占比显著低于IR 组,差异有统计学意义(P<0.05)。
2.2 3组大鼠脑皮质病理学表现假手术组大鼠脑皮质神经元形态结构正常(图1A);IR组大鼠脑皮质神经元排列紊乱、数目明显减少、结构疏松,细胞体积变小,细胞核溶解、出现空泡,细胞膜完整性破坏,细胞呈三角形或梭形,间质水肿(图1B);与IR组比较,AP组大鼠神经元损伤显著减轻(图1C)。

A:假手术组;B:IR组;C:AP组。
2.3 3组大鼠海马组织中 miR-29b相对表达量比较结果见表1。手术后2、6、24、48 h,IR组和AP组大鼠海马组织中 miR-29b相对表达量显著高于假手术组,AP组大鼠海马组织中 miR-29b相对表达量显著高于IR 组,差异有统计学意义(P<0.05)。假手术组大鼠手术后2、6、24、48 h海马组织中 miR-29b相对表达量比较差异无统计学意义(P>0.05);IR组大鼠手术后2、6、24 h海马组织中 miR-29b相对表达量呈增高趋势,手术后48 h开始降低(P<0.05);AP组大鼠手术后2、6、24 h海马组织中 miR-29b相对表达量呈增高趋势,手术后48 h开始降低(P<0.05)。
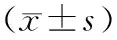
表1 3组大鼠海马组织中 miR-29b相对表达量比较
2.4 3组大鼠海马组织中Bcl-2、Mcl-1及p-Akt蛋白表达水平比较结果见表2和图2。假手术组大鼠手术后2、6、24、48 h海马组织中Bcl-2、Mcl-1和p-Akt相对表达量比较差异无统计学意义(P>0.05);IR组和AP组大鼠手术后2、6、24 h海马组织中Bcl-2、Mcl-1和p-Akt相对表达量呈显著增高趋势(P<0.05),手术后48 h开始降低。手术后2、6、24、48 h,IR组和AP组大鼠海马组织中Bcl-2相对表达量显著高于假手术组,AP组大鼠海马组织中Bcl-2相对表达量显著高于IR组,差异有统计学意义(P<0.05)。IR组大鼠后手术后2、6、24 h海马组织中Mcl-1相对表达量显著高于假手术组,手术后48 h显著低于假手术组,差异有统计学意义(P<0.05);AP组大鼠手术后2、6、24 h海马组织中Mcl-1相对表达量显著高于假手术组,差异有统计学意义(P<0.05);AP组与假手术组大鼠手术后48 h海马组织中Mcl-1相对表达量比较差异无统计学意义(P>0.05);AP组大鼠手术后2、6、24、48 h海马组织中Mcl-1相对表达量显著高于IR组,差异有统计学意义(P<0.05)。IR组大鼠手术后2、6、24、48 h海马组织中p-Akt相对表达量显著高于假手术组,差异有统计学意义(P<0.05);AP组大鼠手术后2、6、24 h海马组织中p-Akt相对表达量显著高于假手术组,手术后48 h海马组织中p-Akt相对表达量显著低于假手术组,差异有统计学意义(P<0.05);AP组大鼠手术后2、6、24、48 h海马组织中p-Akt相对表达量显著低于IR组,差异有统计学意义(P<0.05)。
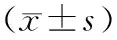
表2 3组大鼠手术后海马组织中Bcl-2、Mcl-1及p-Akt蛋白相对表达量比较

1:假手术组;2:IR组;3:AP组。
3 讨论
目前,缺血再灌注仍然是缺血性脑梗死的主要治疗措施,但是脑组织血液的再次供应会启动一系列复杂的信号级联反应,诱导迟发性神经细胞凋亡,因此,如何减轻脑梗死后迟发性神经细胞的凋亡是目前临床CIRI防治中亟待解决的难题。在近年来缺血性脑梗死治疗的临床实践中,逐渐提出了脑缺血预处理(cerebral ischemia preconception,CIP)的治疗理念[13],它是指脑组织在适应了1次或多次短暂的缺血状态后,脑组织被诱导产生多种内源性保护机制,由此提高神经元对较长时间缺血的耐受[14-15];随后又出现了药物预处理,临床实践中在发生脑缺血之前给予患者短暂性缺血预处理是不合实际的,而药物预处理更容易被患者接受,且使用范围广、成本低。AP被证实能够从扩张脑部血管、抑制血小板聚集、降低细胞代谢等途径等多方面来减轻CIRI,减小脑梗死体积,起到神经保护作用[16],但其确切机制仍然存在争议[17]。
本研究结果显示,IR组和AP组大鼠神经行为学评分和脑梗死体积占比显著高于假手术组,AP组大鼠神经行为学评分和脑梗死体积占比显著低于IR 组。脑皮质病理学检查结果显示,假手术组大鼠脑皮质神经元形态结构正常;IR组大鼠脑皮质神经元排列紊乱、数目明显减少、结构疏松,细胞体积变小,细胞核溶解、出现空泡,细胞膜完整性破坏,细胞呈三角形或梭形,间质水肿;与IR组比较,AP组大鼠神经元损伤显著减轻。这一结果与文献[16-17]报道一致,进一步证实,IR可造成大鼠脑组织坏死、导致神经功能损伤;AP预处理可显著改善脑梗死大鼠的神经行为学评分,提高梗死区脑细胞的存活率,减轻IR造成的神经功能损伤。
miRNA是参与基因表达调控的短链RNA序列,其与靶基因结合后抑制mRNA的翻译或促进mRNA的降解,对多种下游靶蛋白进行激活或抑制,从而调控细胞死亡过程[18-19]。EISENREICH等[20]研究发现,在血管紧张素Ⅱ诱导的人足细胞损伤中,miR-29b可以通过降低Akt的磷酸化调控足细胞的凋亡。以往研究多关注miR-29b对肿瘤的调控作用。而有研究报道,miR-29b在CIRI患者神经细胞中显著上调,认为miR-29b可通过改变大脑皮层中通常高表达的关键信号元件参与CIRI[21-22];激活的miR-29b在神经元成熟过程中通过靶向BH3蛋白表达促进神经细胞凋亡[23]。本研究结果显示,假手术组大鼠术后各个时间点海马组织中miR-29b相对表达量比较差异无统计学意义,说明在正常脑组织细胞内,miR-29b的表达量较低,且维持在一个较稳定的水平;IR组和AP组大鼠海马组织中miR-29b相对表达量在术后各时间点均显著高于假手术组,且AP组大鼠海马组织中miR-29b相对表达量在术后各时间点均显著高于IR组,IR组和AP组大鼠海马组织中miR-29b的相对表达量在手术后2、6、24 h呈增高趋势,之后缓慢降低。这说明,当正常脑细胞受到缺血再灌注损伤刺激时,会迅速引起细胞内miR-29b的表达增加,参与到调控细胞凋亡的过程,在脑梗死发病24 h内的miRNA-mRNA轴表达活跃,miR-29b的相对表达量持续增高,在发病24 h达到高峰;腺苷可能作为一种miR-29b诱导剂促使大鼠海马组织miR-29b相对表达量显著增高,进而通过降低细胞凋亡发挥脑保护作用。
Akt具有CIRI后抗神经细胞凋亡的作用,并在多器官缺血再灌注损伤中均能发挥保护功能,是已被证实且广泛存在的参与细胞凋亡信号通路的关键蛋白。Akt被激活后一方面本身能抑制多种不同凋亡传递物和神经细胞死亡,另一方面,形成p-Akt后,能够增强神经细胞的抗凋亡能力,在神经元损伤的再生和修复中起决定性作用[24-25]。Bcl-2作为Akt信号通路下游的关键物质,是一种重要的内源性神经保护因子,与CIRI后神经元的存活有着密切的联系。Mcl-1是Bcl-2家族中重要的抗凋亡蛋白,可通过线粒体途径发挥抗细胞凋亡作用,促进细胞的存活。陈浩等[26]研究表明,miR-29b通过靶向下调Mcl-1表达促进脑缺血缺氧时神经细胞凋亡。本研究结果提示,假手术组大鼠手术后各时间点间海马组织中Bcl-2、Mcl-1和p-Akt相对表达量比较差异无统计学意义,与海马组织内miR-29b的变化趋势较为一致,说明在正常海马组织细胞内Bcl-2、Mcl-1、p-Akt维持在一个较稳定的水平。IR组和AP组大鼠手术后2、6、24 h海马组织中Bcl-2、Mcl-1和p-Akt相对表达量呈显著增高趋势,手术后24 h开始降低。手术后2、6、24、48 h,IR组和AP组大鼠海马组织中Bcl-2相对表达量显著高于假手术组,AP组大鼠海马组织中Bcl-2相对表达量显著高于IR组。IR组大鼠手术后2、6、24 h 海马组织中Mcl-1相对表达量显著高于假手术组,手术后48 h显著低于假手术组;AP组大鼠手术后2、6、24 h 海马组织中Mcl-1相对表达量高于假手术组,而2组大鼠手术后48 h海马组织中Mcl-1相对表达量比较差异无统计学意义;AP组大鼠术后各时间点海马组织中Mcl-1相对表达量均高于IR组。IR组大鼠手术后各时间点海马组织中p-Akt相对表达量显著高于假手术组,AP组大鼠手术后2、6、24 h海马组织中p-Akt相对表达量显著高于假手术组,而手术后48 h海马组织中p-Akt相对表达量显著低于假手术组;AP组大鼠手术后各时间点海马组织中p-Akt相对表达量显著低于IR组。以上结果说明,当正常脑细胞受到IR损伤时,由于细胞的自我保护机制,细胞内抗凋亡蛋白Bcl-2、Mcl-1的表达量增加,参与到抗细胞凋亡的过程;而IR本身也会引起促凋亡蛋白p-Akt的上升;经过AP后,梗死区海马组织抗凋亡蛋白Bcl-2、Mcl-1相对表达量显著升高,促凋亡蛋白p-Akt相对表达量降低。因此,推测腺苷可能作为一种miR-29b诱导剂使大鼠海马组织miR-29b相对表达量显著增高,而miR-29b可能通过降低脑细胞内Akt磷酸化水平,促进Bcl-2、Mcl-1抗凋亡蛋白的表达,抑制IR后神经细胞凋亡,缩小脑梗死体积,起到神经保护作用,从而减轻CIRI。
综上所述,AP能够在再灌注早期增加miR-29b的表达,且与脑缺血的严重程度及再灌注时间相关,其通过抑制Akt磷酸化水平、促进抗凋亡蛋白Bcl-2和Mcl-1的表达调控细胞凋亡,从而发挥对CIRI的保护作用;因此,miR-29b可以作为缺血性卒中早期诊断的生物标志物和早期治疗的有效靶标,且可以通过人工合成miR-29b模拟物和抑制剂改变内源性miRNA水平。

