基于血管内皮细胞代谢途径探讨莪蚕健胃方治疗大鼠胃癌前病变的机制*
黄柳向, 廖小年,贺玉琼
(湖南中医药大学第一附属医院,湖南 长沙 410007)
胃癌是来源于胃黏膜上皮的恶性肿瘤[1]。据2015年癌症统计报告显示:中国胃癌的发病率及病死率位居肿瘤排行第2位,仅次于肺癌[2]。胃癌是我国癌症防治的重点,其被认可的进展模式为:正常胃黏膜→慢性浅表性胃炎→慢性萎缩性胃炎→肠上皮化生→异型增生→胃癌[3]。胃癌前病变(precancerous lesions of gastric cancer,PLGC)是指胃黏膜具有恶性倾向的病理改变,主要包括肠上皮化生(intestinal metaplasia,IM)和异型增生(dysplasia,Dys),是发展成胃癌的必经阶段。胃癌的发病机制尚不明确,尽早干预及治疗PLGC以阻止其进展,甚至使异常的胃黏膜逆转为正常的胃黏膜对降低胃癌发病率至关重要。肿瘤的生长、转移加速了肿瘤患者的死亡,而肿瘤细胞不断生长的能量来源依靠新血管的生成。肿瘤的一个重要特点是血管新生[4],肿瘤的生长、转移均离不开新生血管的生成[5]。近年来,抗新生血管生成药物的研究日渐兴起,新生血管形成的相关因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)成为研究热点。目前,抗VEGF药物的有效性仍有待考察[6]。新血管生成是胃癌发展的关键,而血管内皮细胞代谢通过各个方式影响着血管的生成。血管内皮细胞代谢途径与肿瘤血管的形成密不可分,学者们试图从途径方面研制新药运用于临床抗肿瘤,但目前PLGC与血管内皮细胞代谢的关系研究尚未涉及。前期实验研究[7-8]表明,PLGC胃黏膜组织中血管生成活跃,莪蚕健胃方可通过降低VEGF、缺氧诱导因子-1a(hypoxia inducible factor-1ɑ,HIF-1ɑ)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)在蛋白和信使核糖核酸(mRNA)上的表达量影响新血管生成,从而逆转PLGC。本研究在前期研究的基础上,通过观察莪蚕健胃方对PLGC模型大鼠胃黏膜磷酸果糖激酶-2/果糖-2,6-二磷酸酶3(phosphofructokinase-2/fructose-2,6-bisphosphatase 3,PFKFB3)、肉碱脂酰转移酶1A(carnitine palmityl transferase A,CPT1A)及谷氨酰胺酶1(glutaminase1,GLS1)蛋白表达的影响,探讨莪蚕健胃方对PLGC可能的作用机制,为莪蚕健胃方的临床应用提供理论依据。
1 材料与方法
1.1 动 物
Wistar雄性大鼠60只,SPF级,4周龄,体质量100~120 g,购于湖南长沙市天勤生物技术有限公司,动物生产许可证号为SCXK(湘) 2014-0011。饲养于湖南中医药大学动物实验中心实验室,适应性喂养1周,室温20~25 ℃,湿度50 %~65 %,自然采光,通风安静。笼具及垫料每2天更换1次,笼具清洗消毒。
1.2 药品、试剂与仪器
莪蚕健胃方处方组成:黄芪 30 g,莪术10 g,僵蚕10 g,太子参30 g,炮山甲 3 g,百合15 g,白芍20 g,茯苓10 g,当归 10 g,枳壳10 g,鸡内金15 g,佛手10 g,炙甘草6 g。中药均购自湖南老百姓大药房,均经湖南中医药大学第一附属医院专业药师鉴定,符合《中国药典》标准。饮片先浸泡40 min,头煎加5倍水,先放炮山甲,大火先煎15 min,再下其他药材,大火煮沸后改文火煎40 min;第二次煎加3倍水,水沸后文火煎25 min;两次药汁混匀并过滤,使用旋转蒸发仪将药物浓缩至2 g/mL以备高剂量组使用,药液于4 ℃冰箱中存放。该药液稀释,待后即为低剂量组药液。胃复春片,0.36 g/片,60片/盒,杭州胡庆余堂药业有限公司产品。按照动物与人体的体质量比例折算,大鼠剂量为0.06 g/kg体质量,配制为0.1 g/mL的溶液,于4 ℃冰箱中备用。盐酸雷尼替丁胶囊,0.15 g/片,30粒/盒,上海现代哈森(商丘)药业有限公司产品,按照0.3 g/kg雷尼替丁的标准配制造模组鼠料。N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,MNNG),5 g/瓶,由梯希爱(上海)化成工业发展有限公司提供,批号CFFC-M0527-5G。MNNG溶液的配制:将蒸馏水175 mL和40 ℃ 体积分数为500 mL/L的乙醇75 mL充分搅匀,配成12 g/L的MNNG母液250 mL(每周配1次)。于4 ℃冰箱保存,使用前将母液稀释为120 mg/L的MNNG溶液,避光。氯化钠溶液的配置:用60 ℃蒸馏水将氯化钠液配成150 g/L的溶液10 μL/g,用以灌胃。苏木素-伊红(HE)染液、EDTA(pH值8.0)抗原修复液、EDTA(pH值9.0)抗原修复液、柠檬酸(pH值6.0)抗原修复液,均由武汉谷歌生物科技有限公司提供,批号分别为G1004、G1206、G1203、G1202。Hei-vap Advantage型旋转蒸发仪,德国海道夫公司产品;Nikon Eclipse E100型正置光学显微镜、 Nikon DS-U3型成像系统,均来自日本尼康。
1.3 分组与模型的建立
将60只大鼠随机分为正常对照组10只和造模组50只。正常对照组给予蒸馏水灌胃,1次/d,灌胃容积2 mL。造模组采用以MNNG为主的复合造模方法[9]。具体方法如下:每日自由饮用 质量分数为120 mg/L的MNNG溶液(饮水瓶用加厚黑色塑料袋包裹避光),进食含0.03%雷尼替丁的标准鼠料,采取饥饱失常饲养方法(饱食1 d后禁食1 d),禁食当天下午用温度60 ℃、质量分数 150 g/L 的盐水10 μL/g灌胃。自16周开始,每周选取2只大鼠,取胃黏膜送病理检查确定模型是否建立;至20周,确定造模成功后,随机取造模组2只大鼠检测以再次确认模型建立成功。将造模组剩余大鼠均分为模型对照组、胃复春组、莪蚕健胃方低剂量组、莪蚕健胃方高剂量组。
1.4 治疗方法
自第21周起,正常对照组、模型对照组给予2 mL蒸馏水灌胃。莪蚕健胃方低、高剂量组依次按8.05,16.10 g/(kg·d)灌胃莪蚕健胃方汤剂,灌胃容积为2 mL。胃复春组按0.06 g/(kg·d)量给予胃复春汤剂灌胃,灌胃容积2 mL。各组均1次/d,连续10周。
1.5 检测指标与方法
1.5.1 大鼠一般情况
仔细观察并记录各时期大鼠的精神状态、体质量、毛色、活跃度、饮食情况、排泄物等。
1.5.2 取材及样本处理
末次灌胃后,禁食24 h,不禁饮,称量体质量,按5 μL/g的剂量予100 g /L水合氯醛腹腔注射麻醉,剖腹,快速取出胃组织,沿胃小弯剖开,生理盐水冲洗。于胃窦、胃体处各取一小块组织,以40 g/L多聚甲醛液固定,石蜡包埋、切片,于4 ℃冰箱中冷藏,用于病理检测和免疫组化检测。
1.5.3 胃黏膜组织病理学检
将切片用HE染色,显微镜镜检,并进行图像采集分析。
1.5.4 MVD、PFKFB3、CPT1A及GLS1表达
采用免疫组化法对CD31进行检测,具体步骤:①石蜡切片脱蜡至水;②抗原修复;③阻断内源性过氧化物酶;④血清封闭;⑤加一抗;⑥加二抗;⑦DAB显色;⑧复染细胞核;⑨脱水封片;⑩显微镜镜检, 图像采集分析。
1.6 统计学方法
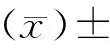
2 结 果
2.1 各组大鼠一般情况对比
正常对照组大鼠活泼好动,对外界刺激反应较敏感,食欲良好,体格健硕,皮毛有光泽,尾色淡红,体质量正常增长,粪便颗粒状,软硬适中。与正常对照组大鼠对比,模型对照组大鼠精神状态较差,懒动嗜卧,扎堆,对外界刺激反应较迟钝,皮毛粗糙、无光泽,食欲欠佳,形体瘦弱,大便多不成形,垫料异味较正常对照组重。与模型对照组对比,胃复春组、莪蚕健胃方高剂量组大鼠的一般情况有所好转,精神状态可,活动度增加,食欲改善,体质量增加,粪便逐渐转为成形,垫料异味减轻。莪蚕健胃方低剂量组大鼠的一般情况改善不明显。
2.2 各组大鼠胃黏膜形态及组织病理学变化
肉眼下:正常对照组大鼠胃黏膜光滑柔软,色泽粉红,皱襞排列规则,可见黏液附着。模型对照组大鼠胃黏膜颜色变浅,胃壁增厚,伸展性差,黏膜皱襞紊乱,部分可见糜烂。各治疗组大鼠胃黏膜色泽灰白,皱襞不规则,伸展性较差,少量黏液附着。
光镜下:正常对照组、胃复春组及莪蚕健胃方高剂量组胃底腺呈管状,排列紧密;组织形态结构基本正常,未见明显病理变化,部分组织纤维化区域内可见中性粒细胞弥散性浸润(图1白色箭头所示)。莪蚕健胃方高剂量组个别可见萎缩及低级别异型增生。模型对照组、莪蚕健胃方低剂量组可见不同程度的异型增生,主要表现为胃底腺大部分呈现萎缩(图1黑色箭头所示),腺管结构排列明显紊乱或不规则,甚至共壁,形状大小不规则、分支状。细胞核增大、粗杆状、深染、密集呈假复层腺体排列较乱、参差不齐,分泌明显减少或消失,顶部可见核分裂(图1虚线箭头所示)。少部分可见不同程度萎缩。见图1。

图1 各组大鼠胃黏膜组织病理学变化(HE染色,×200)
2.3 各组大鼠MVD表达对比
见图2。染色位于血管内皮细胞,呈棕黄色。MVD计数方法[10]:呈现棕黄色的内皮细胞或细胞簇同时有别于周围组织(剔除厚壁及管腔>8个红细胞大小的血管)的计为1条微血管。先在低倍镜下找血管高密集区,再以3个高倍镜下微血管计数的平均值作为最后的MVD值。见表1。
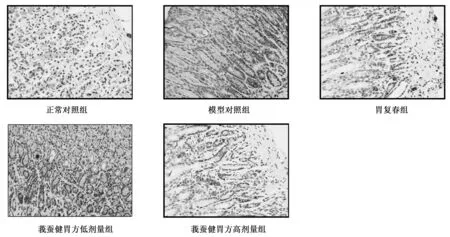
图2 各组CD31染色情况(免疫组织化学染色,×400)
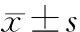
表1 各组MVD值结果
2.4 各组大鼠PFKFB3、CPT1A及GLS1蛋白表达对比
PFKFB3、CPT1A及GLS1蛋白表达量见图3、图4和图5。结果显示:与正常对照组对比,模型对照组中CPT1A及GLS1蛋白表达量均显著增高,差异有统计学意义(P<0.01);PFKFB3蛋白表达量增高,差异有统计学意义(P<0.05)。与模型对照组对比,胃复春组、莪蚕健胃方高剂量组CPT1A及GLS1蛋白表达量显著降低,差异有统计学意义(P<0.01);PFKFB3蛋白表达量降低,差异有统计学意义(P<0.05);而莪蚕健胃方低剂量组PFKFB3、CPT1A及GLS1蛋白表达量较之,差异无统计学意义(P>0.05)。胃复春组和莪蚕健胃方高剂量组之间的PFKFB3、CPT1A及GLS1蛋白表达量对比,差异无统计学意义(P>0.05)。见表2。

图3 各组PFKFB3的染色情况(免疫组织化学染色,×400)

图4 各组CPT1A染色情况(免疫组织化学染色,×200)

图5 各组GLS1的染色情况(免疫组织化学染色,×200)
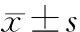
表2 各组PFKFB3、CPT1A及GLS1蛋白表达对比
3 讨 论
肿瘤生长、浸润和转移离不开新生血管的形成。肿瘤早期获取营养和氧气主要通过弥散作用;后期因肿瘤不断增长,弥散方式所获得的营养和氧气相对匮乏,肿瘤便启动新生血管形成以满足自身需求[11]。血管内皮细胞(endothelial cell,EC)作为血管的组成之一,既能参与营养和氧气的输送又能释放许多细胞因子,以满足肿瘤不断增长的需求[12]。在病理条件下,血管由静止状态转变为激活状态,在多种促新生血管生成因子的作用下,血管内皮细胞分裂、迁移并分化成为茎细胞和顶端细胞,从而完成血管出芽新生过程。EC的代谢影响着血管的生成,三羧酸循环(tricarboxylic acid,TCA)是体内三大营养物质(糖类、脂类、蛋白质)进行代谢的通路。EC通过TCA进行代谢,释放能量以满足肿瘤血管的生长。其中PFKFB3作为糖酵解的关键限速酶,影响着内皮细胞的增殖与转移,从而抑制血管出芽,影响肿瘤血管生成。CPT1A是脂肪酸β氧化(fatty acid β-oxidation,FAO)的关键酶。内皮细胞缺乏CPT1A则会影响细胞增殖和迁移,从而阻碍血管新生[13-14]。GLS1缺乏致使谷氨酰胺代谢受到抑制,进而损害顶端细胞的迁移和茎细胞增殖,导致体内血管萌芽缺陷[15]。
胃癌前病变是胃癌形成前的一个重要过程,在此过程中,胃黏膜血管内皮细胞的增生起着重要的作用。研究[16-17]表明,胃癌前病变阶段,血管生成就明显增多。相关实验[18]显示,上皮内瘤变与萎缩性胃炎的胃黏膜、肠上皮化生组织相比,MVD显著提高。当前有很多研究表明,PFKFB3在乳腺癌、结肠癌、胰腺癌、肝癌中存在高表达,可通过抑制PFKFB3的表达、干预血管内皮细胞的增殖达到抗血管生成从而阻断肿瘤的发生。有实验研究[19-20]表明,使用PFKFB3的抑制剂3PO[3-(3-pyridinyl)-1-(4-pyridinyl)-2-propen-1-one]干预患有视网膜病理性增生疾病的小鼠后,小鼠视网膜病理性血管的增生明显减少。CPT1A在许多恶性肿瘤中均出现异常高表达,CPT1A 转录水平的调控是其促肿瘤细胞增殖和转移的重要机制[21]。11q13-q14 的扩增是雌激素受体阳性乳腺癌的标志性基因组改变[22],而CPT1A基因是该扩增区重要的促增殖基因[23]。在卵巢癌中,异常高表达的CPT1A促使FAO和细胞内腺苷三磷酸水平增加,从而促进卵巢癌细胞的增殖[24]。在胶质母细胞瘤中,CPT1A表达水平与患者肿瘤细胞的高分化状态呈明显正相关[25]。有国外研究报道GLS1在肝癌、甲状腺癌的表达量显著上调[26-27]。另有研究[29]也发现,在肝癌组织中GLS1表达量上调,而 GLS2表达量下调,在肝癌进展过程中出现GLS2向GLS1表达的转变[28]。乳腺癌基质细胞GLS1表达量亦显著上调。在胶质母细胞瘤细胞中,敲除GLS1能够降低肿瘤细胞的生存及增殖能力,证明GLS1具有“促癌效应”[30]。
莪蚕健胃方是湖南中医药大学第一附属医院黄柳向教授治疗胃癌前病变的经验方,该方由13味药组成:黄芪 30 g,莪术10 g,太子参 30 g,僵蚕10 g,炮山甲 3 g,百合15 g,当归 10 g,白芍 20 g,茯苓10 g,枳壳10 g,佛手10 g,鸡内金 15 g,炙甘草 6 g。全方共奏益气健脾、化痰祛瘀之功,恰中胃癌前病变本虚标实,以脾胃虚为本,气滞、血瘀、痰瘀为标之病机。本方的前期实验研究[7-8]表明,PLGC阶段胃黏膜即存在新生血管生成,莪蚕健胃方可通过降低VEGF、HIF-1ɑ、MMP-2在蛋白和mRNA上的表达量,抑制新生血管生成,从而逆转PLGC。而现代药理学显示:黄芪中的黄芪皂苷[31]、莪术中的莪术油[32]、僵蚕中的麦角甾醇、β-谷甾醇和棕榈酸[33],以及当归与黄芪的配伍[34]等均可抑制肿瘤生长,具有抗肿瘤的作用。
本实验中,莪蚕健胃方具有改善PLGC模型大鼠的一般情况及胃黏膜组织病理学改变的作用。与正常对照组对比,模型对照组中MVD蛋白表达明显升高,说明在胃癌前病变中新生血管生成已明显增多;且在模型大鼠胃黏膜组织中的PFKFB3、CPT1A及GLS1蛋白均呈现高表达,表明三者的高表达均参与了PLGC的发生。肿瘤发生、生长及转移均离不开新生血管的生成,血管内皮细胞代谢影响着血管的生成,而PFKFB3、CPT1A及GLS1在血管生成中均起着关键作用。目前大多数研究显示,PFKFB3、CPT1A、GLS1在恶性肿瘤细胞中高表达量。PLGC是胃癌转化的关键步骤。本实验研究显示,PFKFB3、CPT1A及GLS1在PLGC模型大鼠胃黏膜组织中表达量均明显增加。因此,可认为PFKFB3、CPT1A及GLS1蛋白表达量上调是PLGC转化为胃癌的关键因素之一。
本实验研究显示,与模型对照组对比,莪蚕健胃方高剂量组可明显降低MVD蛋白表达量,说明抑制血管生成可能是莪蚕健胃方改善甚至逆转PLGC的治疗机制之一。两种剂量的莪蚕健胃方和胃复春在降低PFKFB3、CPT1A及GLS1蛋白表达量上效果各异:莪蚕健胃方低剂量组的降低效果不明显;莪蚕健胃方高剂量组和胃富春组的降低效果明显,且莪蚕健胃方高剂量组稍优于胃复春组。这表明莪蚕健胃方可能通过降低PFKFB3、CPT1A及GLS1蛋白表达量进而抑制血管生成,从而达到改善甚至逆转PLGC的治疗作用,其治疗作用与药物剂量有关。
综上所述,在胃癌前病变阶段新生血管生成活跃,且此阶段PFKFB3、CPT1A及GLS1蛋白均呈现高表达。莪蚕健胃方能明显降低胃癌前病变胃黏膜组织中的MVD、PFKFB3、CPT1A及GLS1蛋白表达量。莪蚕健胃方能有效治疗PLGC,可能通过下调PFKEB3、CPT1A及GLS1蛋白表达量来干预PLGC血管内皮细胞代谢,抑制血管生成,从而起到干预PLGC向胃癌发展的进程。

