重组羊痘病毒P32 蛋白的真核表达与间接ELISA 检测方法的建立
王健春,郭 宇,萨茹拉,高登军,刘占喜,曹际娟,葛忠源,李雷斌,孙 雨
(1.天津市动物疫病预防控制中心,天津 300000;2.内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特 010010;3.大连民族大学,辽宁大连 116600;4.中联瑞(北京)生物科技有限责任公司,北京 102600;5.广西大学动物科学技术学院,广西南宁 530004;6.中国动物疫病预防控制中心,北京 102600)
山羊痘和绵羊痘统称羊痘,分别由山羊痘病毒(goatpox virus,GPV)和绵羊痘病毒(sheeppox virus,SPV)引起。GPV 和SPV 均属于痘病毒科(Poxviridae)脊椎动物痘病毒亚科(Chordopoxvirinae)山羊痘病毒属(Capripoxvirus,CaPV)[1-2]。我国在新修订的《一、二、三类动物疫病病种名录》中将其列为二类动物疫病,世界动物卫生组织(WOAH)将其列入须通报动物疫病名录。感染动物表现为发热,皮肤、黏膜、器官表面广泛性丘疹或结节,皮肤水肿,淋巴结肿大,消瘦,产乳量大幅度降低,严重时死亡。羊痘给养殖业带来较大危害,严重阻碍国际贸易开展。山羊痘最早于公元前200 年在欧洲被发现,绵羊痘最早于13 世纪在英国被发现。羊痘是动物痘病中最为严重的一种,一般发病率为50%~80%,病死率20%~80%,其中对羔羊的致死率可达100%[2]。世界各地均有羊痘发病和流行的相关报道,目前在中东地区流行较为严重[1]。羊痘可通过节肢动物机械性接触传播,蚊子、苍蝇和蜱等均可能是疫情跨地域远距离扩散的“帮凶”,这无疑加大了羊痘的防治难度[3-4]。
P32 抗原是CaPV 的特有结构蛋白,由痘病毒的H3L同源基因所编码,是位于病毒膜表面的一种主要结构蛋白。P32 蛋白的相对分子质量约为32 ku,位于CaPV 基因组的64~65 kb 处,由第74号ORF 编码,具有多个抗原决定簇和B 细胞抗原表位[5]。动物感染CaPV 后,在感染早期先产生针对P32 蛋白的中和抗体,然后才产生针对其他结构蛋白的抗体。P32 蛋白是所有CaPV 分离株共有的,特异性高、免疫原性强的结构蛋白[4-6]。为获得在Sf9 细胞中高效表达的P32 蛋白,本研究将编码CaPV P32 抗原的核苷酸序列优化为适合在Sf9细胞中表达的偏好密码子,去除氨基酸序列跨膜区,利用昆虫杆状病毒表达系统,成功表达纯化、制备出了重组CaPV P32 蛋白,并建立了检测CaPV 抗体的间接ELISA(Indirect-ELISA,I-ELISA)方法。
1 材料和方法
1.1 主要材料
Sf9 昆虫细胞、DH10Bac 感受态大肠杆菌、CaPV-P32 pFastBacHTA 质粒,由中国动物疫病预防控制中心保存。
1.2 主要试剂
SF900 II SFM 昆虫细胞培养基、Cellfectin™II Reagen 转染试剂,购自美国Thermo Fisher 公司;2×PCR mix buffer、质粒提取试剂盒、DNA Marker、Plasmid Mini Kit,购自天根生化科技(北京)有限公司;庆大霉素、氨苄青霉素、X-gal、四环素、IPTG、6×His mAb、家兔抗山羊IgGHRP,购自北京索莱宝科技有限公司;BCA 蛋白定量试剂盒、镍琼脂糖凝胶,购自上海碧云天生物技术有限公司。
1.3 转染质粒设计与构建
利用SignalIP、TMHMM 跨膜区预测系统、GeneBank、DNAMan 和GenScript 等分子生物学软件,分析并预测了经典CaPV(Genbank 登录号AFH08294.1)P32 的跨膜区序列、疏水区序列和稀有密码子。优化稀有密码子为Sf9 细胞偏好的真核表达密码子,并合成P32 蛋白编码基因核苷酸序列;将合成的核苷酸序列转至pFastBacHTA 重组载体中,构建CaPV-P32-pFastBacHTA 重组质粒;使用DNAMan 软件设计P32 蛋白编码基因扩增引物CaPV-P32-F 和CaPV-P32-R(表1),由生工生物工程股份有限公司合成。

表1 P32 蛋白编码基因引物与M13 通用引物序列信息
1.4 重组质粒PCR 扩增与鉴定
分别使用合成的CaPV-P32-F/CaPV-P32-R为上下游引物,以重组构建的质粒CaPV-P32-pFastBacHTA 为模板进行PCR 扩增,对扩增产物进行测序。
1.5 重组穿梭质粒构建与蓝白斑筛选
使用LB 平板培养基(50 μg/mL 卡那霉素、10 μg/mL 四环素,7 μg/mL 庆大霉素、40 mg/L IPTG、100 mg/L X-GAL)。提取重组质粒CaPVP32-pFastBacHTA 并转化至DH10Bac 细菌感受态细胞,划线接种至LB 平板培养基中,37 ℃条件下避光培养48 h,挑取培养基中的白色菌落。将提取转座后的质粒,以1.3 中构建的CaPV-P32 上、下游引物扩增验证CaPV-P32-pFastBacHTA 质粒的转座情况,对鉴定为阳性的质粒进行测序。
1.6 包装重组杆粒病毒并传代
制备Sf9 昆虫细胞,将密度为2×106的对数生长期Sf9 昆虫细胞铺于细胞培养瓶中。细胞贴壁后,按照Bac-to-Bac 转座重组技术,将筛选白斑提取质粒后的Bacmid-CaPV-P32 转染至Sf9 昆虫细胞中,28 ℃条件下,培养96 h;将培养的细胞反复冻溶3 次,离心后取上清液体冻存,记为P1 代病毒;从P2 代病毒开始,每代病毒转染细胞培养72 h,细胞培养瓶中加入2 mL 的不含双抗的SF900 II 型细胞培养基;按照MOI 值为5 的标准传代接毒细胞,传至P5 代后反复冻溶离心区,取上清作为种毒备用,-80 ℃保存。
1.7 重组目的蛋白表达与鉴定
将构建的质粒转染Sf9 细胞后进行重组目的蛋白表达与鉴定。在收集培养的细胞沉淀中加入细胞裂解液,4 ℃条件下静置30 min;使用超声破碎仪超声破碎10 min,使用离心机4 ℃条件下,12 000 r/min 离心12 min;将离心后的上清液过滤后,使用Ni-Berpharose FF 纯化试剂盒,对蛋白进行初步粗纯化,用SDS-PAGE 电泳观察蛋白条带;根据蛋白条带的分子量大小、电泳后蛋白条带清晰度、电泳背景等情况,初步分析粗提蛋白的表达量以及蛋白纯度,并使用Nanodrop 和BCA 蛋白定量试剂盒检测粗提蛋白浓度。
1.8 重组蛋白AKTA 系统高效纯化
粗提后的大量重组蛋白需要通过AKTA 系统进行高效纯化。使用高压泵将细菌破碎后,以16 000 r/min、4℃条件高速离心40 min,收集上清液体,用0.22 μm 的滤膜过滤;将预装的镍柱连入AKTA 系统,使用20 mmol/L Tris、150 mmol/L Nacl,pH7.2 的缓冲液平衡预装镍柱;将过滤好的上清液体通过上样环上样进入AKTA 系统,使用20 个柱体积的含有50 mmol/L 咪唑溶液的杂质洗涤液清洗镍柱中的杂蛋白,用浓度为500 mmol/L的咪唑洗脱缓冲液收集目的蛋白;将收集后的目的蛋白上样AKTA 系统的分子筛,对粗纯后的蛋白进行精细纯化。
1.9 P32 抗体间接ELISA 检测方法建立与优化
1.9.1 基本检测条件建立与优化 将AKTA 精细纯化后的抗原进行梯度稀释并包被于ELISA 酶标板中,按照棋盘滴定法确定包被抗原的最优包被浓度与血清稀释度;将牛血清白蛋白(BSA)封闭液,按照不同浓度稀释后封闭ELISA 酶标板,确定最优封闭浓度;使用棋盘滴定交叉方法确定待检血清与酶标二抗的最佳稀释浓度与作用时间;计算阳性样本与阴性样本的P/N值,以P/N最大值所对应的检测条件作为P32 抗体间接ELISA 检测方法的最佳反应条件。
1.9.2 Cut-off临界值确定 使用本研究建立的CaPV-P32 ELISA 抗体检测方法,对经血清抗体中和试验鉴定的350 份临床阴性羊血清进行检测,并统计分析相应的血清抗体OD450值,使用SPSS 软件计算血清抗体的平均OD450值及对应的标准偏差值(SD)。Cut-off临界值确定:当OD450>+4SD 判为阳性,OD450<+4SD 时判为阴性。
1.9.3 特异性检测 使用小反刍兽疫病毒抗体阳性血清、羊O 型口蹄疫病毒抗体阳性血清、羊A型口蹄疫病毒抗体阳性血清、山羊关节炎与脑炎病毒抗体阳性血清、绵羊梅迪维斯纳病毒抗体阳性血清、羊口疮病毒抗体阳性血清,对本研究建立的间接ELISA 方法进行特异性验证,根据检测的OD450值与Cut-off临界值来判定建立的检测方法与其他羊病毒是否有非特异性交叉反应。
1.9.4 敏感性检测 使用建立的间接ELISA 检测方法,对购自英国WOAH 参考实验室的CaPV 标准抗体阳性血清(血清中和效价为1:512)进行检测。将CaPV 标准抗体阳性血清从1:8 的稀释度开始倍比稀释后检测,根据计算结果得出阳性临界值时的最大血清稀释度。计算结果同血清中和试验的中和效价结果进行比对。
1.9.5 重复性检测 使用建立的间接ELISA 检测方法,将10 份不同中和抗体效价的CaPV 抗体阳性血清,分别在同批次(批内)和不同批次(批间)的酶标板上进行重复性验证,每个试验平行验证5次,根据检测结果计算批内、批间变异系数(CV)。
1.9.6 临床血清样品检测 用建立的间接ELISA检测方法结合血清中和试验,对中国动物疫病预防控制中心(农业农村部兽医诊断中心)保存的480份临床血清样品进行检测,计算敏感性符合率、特异性符合率以及总符合率。
2 结果与分析
2.1 CaPV-P32-pFastBacHTA 重组质粒构建
使用特异性引物的PCR 扩增结果(图1)显示,扩增得到与预期大小一致的产物片段(354 bp)。通过测序验证,扩增产物与目的基因片段相符,表明成功构建了CaPV-P32-pFastBacHTA 重组质粒。
2.2 重组转座子Bacmid-CaPV-P32 PCR 扩增
将提取后的转座子质粒Bacmid-CaPV-P32 使用PCR 方法进行扩增验证,对鉴定为阳性的质粒进行测序。扩增结果(图2)显示,得到与预期大小一致的产物片段;测序验证结果(图3)显示,转座后阳性质粒与目的基因片段相符,表明重组穿梭质粒构建成功。
2.3 Bacmid-CaPV-P32 致细胞病变结果观察
在显微镜下观察P5 代次的Bacmid-CaPV-P32杆状病毒感染Sf9 细胞,发现未感染组的Sf9 细胞生长良好,而杆状病毒Bacmid-CaPV-P32 感染组Sf9 细胞发生了明显的增殖抑制,细胞聚拢呈拉链状,细胞变圆、变大,细胞质内出现黑色颗粒及杂质等细胞病变(图4)。
2.4 不同代次杆状病毒目的基因检测
使用杆状病毒的CaPV-P32-F/CaPV-P32-R 为上、下游引物,对P3、P4、P5 代重组杆状病毒感染的Sf9 细胞,提取基因组进行目的基因片段的PCR 扩增,以检测各代次病毒DNA 序列中是否包含P32 序列片段。通过检测发现,P32 蛋白编码基因目的序列已成功与杆状病毒基因组发生整合,并持续存在于各代次的病毒基因组中(图5)。
2.5 重组蛋白表达与Western Blot 鉴定
将纯化后的重组CaPV-P32 蛋白上样进行SDS-PAGE 电泳鉴定,经考马斯亮蓝染色、脱色液脱色后,获得了大小约32 ku 且纯度较高的重组CaPV-P32 蛋白(图6)。SDS-PAGE 电泳后,对纯化后的重组CaPV-P32 蛋白通过Western Blot试验鉴定反应原性。Western Blot 结果显示,重组CaPV-P32 蛋白在PVDF 转印膜上显示出相对分子质量约为32 ku 的目的条带(图7),显示了重组CaPV-P32 蛋白具有较好的反应原性。
2.6 CaPV-P32 间接ELISA 检测方法建立与优化
2.6.1 蛋白最佳包被浓度、一抗血清稀释度与二抗稀释度优化 经对包被蛋白CaPV-P32 浓度及一抗血清稀释度试验验证,在CaPV-P32 抗原浓度1 μg/mL、4 ℃条件下作用18 h,3%BSA、4 ℃条件下封闭24 h,一抗血清稀释度1:50,反应45 min 时,计算得出的P/N值最大;当酶标二抗稀释度为1:30 000,37 ℃条件下反应45 min,底物反应10 min 时,P/N值最高。
2.6.2 阴阳性临界值(Cut-off值)确定 使用本研究建立的CaPV-P32 ELISA 抗体检测方法,对经血清抗体中和试验鉴定的350 份临床阴性羊血清进行检测,得到OD450平均值(X)为0.130,SD 为0.051,Cut-off值为X+4SD=0.334。
2.7 ELISA 检测方法指标验证
2.7.1 特异性 使用建立的CaPV-P32 ELISA 抗体检测方法分别检测了小反刍兽疫病毒抗体阳性血清、羊O 型口蹄疫病毒抗体阳性血清、羊A 型口蹄疫病毒抗体阳性血清、山羊关节炎与脑炎病毒抗体阳性血清、绵羊梅迪维斯纳病毒抗体阳性血清、羊口疮病毒抗体阳性血清,检测得到的OD450值分别 为0.090、0.105、0.077、0.082、0.112、0.107,均小于Cut-off值0.334,说明重组CaPV-P32 抗原对上述羊病毒的抗体阳性血清无非特异性交叉反应,所建立的方法特异性较好。
2.7.2 敏感性 使用建立的CaPV-P32 ELISA抗体检测方法对购买自英国WOAH 参考实验室的CaPV 标准抗体阳性血清(血清中和效价为1:512)进行检测,发现稀释度在1:1 024 倍时仍为阳性,表明建立的ELISA 检测方法具有较高的敏感性,高于传统的血清中和试验。
2.7.3 重复性 使用建立的间接ELISA 检测方法将10 份不同中和抗体效价的CaPV 抗体阳性血清分别在批内和批间的酶标板上进行重复性验证,发现批内检测的重复性变异系数与批间重复性变异系数指标均小于10%(表2),表明所建立的ELISA检测方法变异较小、重复性好、抗原稳定性较高,可用于不同抗体效价样本不同批次的CaPV 抗体检测。
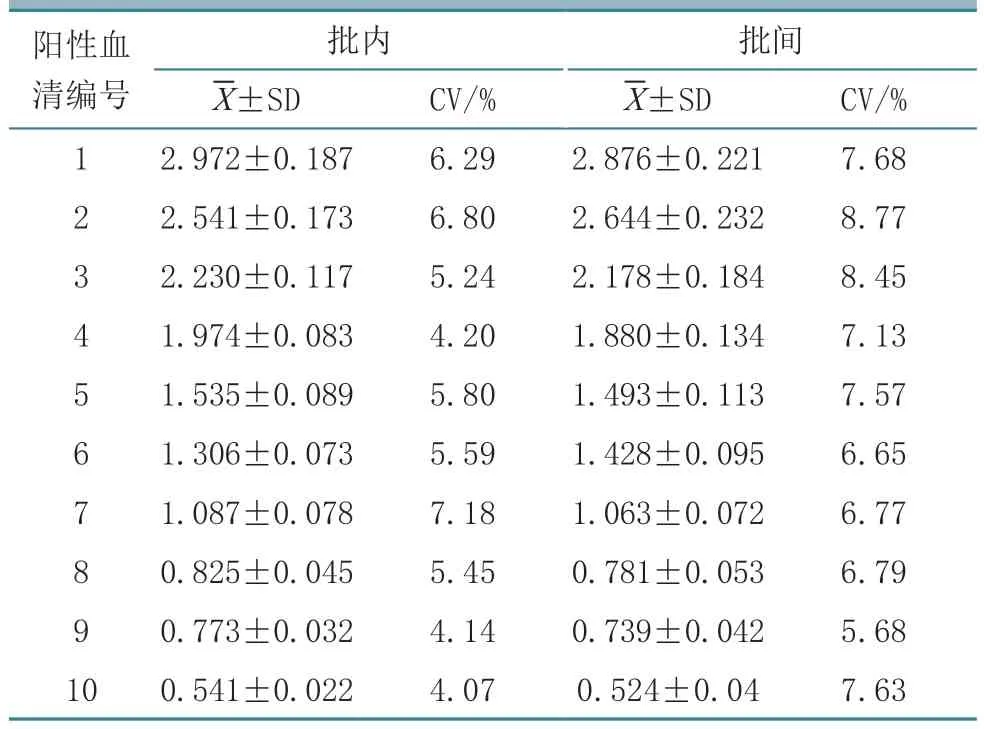
表2 间接ELISA 检测方法的重复性验证结果
2.7.4 临床样品测试 使用建立的间接ELISA 检测方法对中国动物疫病预防控制中心(农业农村部兽医诊断中心)保存的480 份临床血清样品进行检测,发现样本阳性率为67.50%,而用羊痘病毒血清中和试验检测的样本阳性率为68.75%,两种方法的敏感性符合率为98.18%;用ELISA 方法检测的样本阴性率为29.17%,而羊痘病毒血清中和试验检测的样本阴性率为31.25%,两种方法的特异性符合率为93.33%。两种方法的总符合率为96.67%。结果见表3。
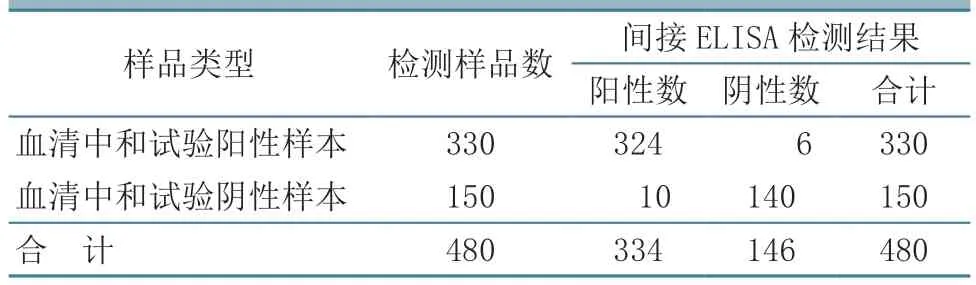
表3 临床血清样品的对比测试结果 单位:份
3 讨论
羊痘目前尚无有效药物治疗方法,对其防控国内外主要采取疫苗免疫、病原与抗体监测、种群净化等综合措施,因此疫苗免疫后的中和抗体监测与疫苗免疫效果评价尤为重要。针对羊痘诊断,WOAH 陆生动物手册(Manual of Diagnostic Tests and Vaccines for Terrestrial Animals)3.8.12 章羊痘诊断方法中涉及电镜观察、病毒分离、常规PCR检测、中和试验、间接免疫荧光抗体检测等。国内现行行标《绵羊痘和山羊痘诊断技术》(NY/T 576—2015),包含病毒分离、电镜检查、包涵体检查、中和试验、PCR 检测等技术。这些方法大多操作复杂,试验周期较长,敏感性不高,结果判定受人为主观性因素影响大[7-9];而常规PCR 检测方法对引物特异性要求较高,容易被污染。
血清抗体间接ELISA 方法,试验材料易获取,对试验环境、设备及人员要求较低,检测速度快,且敏感性高于中和试验,结果判定更为简单,在临床检测和大面积疫苗免疫抗体监测等方面具有重要价值,对疫情的紧急处理及防控意义重大,适合于大面积推广应用。本研究所建立的检测CaPV-P32抗体的间接ELISA 方法可准确检测动物血清中的保护性中和抗体水平,特异性强、准确性高,可较为客观地评价羊痘疫苗免疫动物的抗体免疫保护水平。建立敏感性高、特异性强、高通量、操作简便的CaPV-P32 中和抗体ELISA 检测方法,对于大批量临床样本抗体检测、基层样本筛查以及加快羊痘净化进程等方面具有重要价值[8-12]。
建立稳定的CaPV-P32 抗体ELISA 检测方法的核心是表达与纯化出具备天然结构的CaPV P32蛋白。原核表达系统虽然操作简单,蛋白表达量高,但是表达出的抗原往往是包涵体结构,不具有天然结构,因而使抗原与动物体内抗体结合的匹配性出现差异。因此,大肠杆菌等原核表达系统表达出的CaPV-P32 包涵体抗原无法较好地识别、亲和动物体内的中和抗体,很容易造成检测敏感性不高或者非特异性反应原因导致的假阳性样本增高等现象。昆虫杆状病毒表达系统作为经典的真核抗原表达系统具有原核表达系统无法比拟的优势,可以为表达的重组蛋白提供甲基化、糖基化、磷酸化、翻译折叠等翻译后修饰,从而使表达的蛋白质结构与生物活性更接近于病毒的天然结构蛋白。杆状病毒表达系统表达外源蛋白是通过多角体启动子发生作用,在大量表达外源插入目的蛋白的同时,不影响病毒在Sf9 细胞中的增殖。本研究将编码CaPV P32 抗原的核苷酸序列优化为适合在Sf9 细胞中表达的偏好密码子,去除输水的跨膜区序列,质粒转座后瞬时转染Sf9 昆虫细胞形成杆状病毒,利用昆虫杆状病毒表达系统成功表达制备出了更接近病毒天然结构的重组CaPV P32 蛋白,为开发商品化的CaPV中和抗体ELISA 检测试剂盒奠定了基础。
目前国内检测CaPV 抗体使用的ELISA 试剂盒大多为国外进口,成本高、进口周期长,给基层动物疫病防控工作带来了较大困难。本研究建立的CaPV-P32 抗体ELISA 检测方法与传统的血清中和抗体检测方法相比,符合率高达96.67%,在保证检测方法特异性的同时,检测敏感性比血清中和检测方法更高。同时本研究建立的CaPV-P32 抗体ELISA 检测方法适合于高通量检测,可进一步完善为成熟产品,用于基层羊痘疫苗免疫效果评价、疫情监控等,因而具有较好的市场应用前景。
——一道江苏高考题的奥秘解读和拓展

