筛选出芽短梗霉生产低聚果糖探究溶氧的影响
李成林,曹伟锋,秦林莉,刘郅骞,张静,刘思伽,竹源,梁欣泉*
(1.广西大学 轻工与食品工程学院,南宁 530004;2.中国科学院过程工程研究所,北京 100089)
短梗霉(Aureobasidiumspp.)是一种分布范围非常广泛的真菌。短梗霉的形态比较容易受到环境的影响,并且其生活史复杂的多形态腐生真菌分布在人们的生活中,通常分布在土壤、植物、花草、木材、混凝土等中。出芽短梗霉又称黑酵母,因为出芽短梗霉生长发育过程中,其细胞形态和部分生理特征非常相似,分离鉴定出芽短梗霉时通常会采用与酵母菌一样的研究方法。出芽短梗霉菌的菌落最初黏稠,呈现脏白色,然后转变为绿色,发育到最后菌落呈现黑色[1]。
低聚果糖又称寡果糖或蔗果低聚糖,是低聚糖中非常重要的一类。它广泛存在于自然界,是在蔗糖的果糖残基的C1位上通过β-(2-1)糖苷键与1~3个分子的果糖结合而成的低糖,主要是由蔗果三糖(1-kestose,简称GF2)、蔗果四糖(nystose,简称GF3)和蔗果五糖(1-F-β-fructofranosyl nystose,简称GP4)组成的混合物[2-3]。除了不含卡路里,低聚果糖还具有卓越的功能特性,例如调节肠道微生物菌群,改善胃肠道免疫功能,能够促进脂质的代谢和预防结肠癌的发生[4-5]。低聚果糖天然存在于水果、蔬菜和谷物中,自然界中大约有36000多种植物含有低聚果糖,如大麦、小麦、洋葱、香蕉和麦芽等[6]。
低聚果糖已经在两阶段或者一步过程中以生物发酵法生产[7]。在两阶段过程中,具有果糖基转移酶活性的酶首先从真菌中产生,例如出芽短梗霉菌[8]、曲霉属[9]和青霉菌属。然后使用蔗糖作为底物,在不同的控制条件下使用酶生产低聚果糖[10-11]。在一步法中,低聚果糖是在生物反应器中使用全细胞作为生物催化剂从真菌中生物合成的[12],无论是固定的还是游离的[13],一步法发酵生产低聚果糖是一种很好的方法,因其省去了从细胞提取物中纯化生产低聚果糖酶的步骤[14]。本文将通过发酵过程中的通气速率、氧分压和搅拌转速[15],探索溶氧对发酵生产的影响。
1 材料和方法
1.1 材料
试剂:甘露醇、硝酸铵、磷酸二氢钾、硫酸镁、柠檬酸、司班80、硝酸钠、氯化钾、七水合硫酸亚铁、蔗糖、琼脂、酵母粉;菌种:从土壤与枯叶中筛选的出芽短梗霉、出芽短梗霉IPE-1 No.3337、出芽短梗霉IPE-3 KY618121、出芽短梗霉IPE-5 KY621468,保存于中国科学院过程工程研究所生化工程国家重点实验室。
1.2 主要仪器与设备
高效液相色谱仪 日本岛津公司;蒸汽式灭菌锅 上海申安医疗器械厂;生化培养箱 上海一恒科学仪器有限公司;全温摇瓶柜 苏州培英实验设备有限公司;超净工作台 北京亚泰科隆仪器技术有限公司;发酵罐、高速冷冻离心机 艾本德生命科学公司。
1.3 培养基的配制
1.3.1 富集培养基
甘露醇10%,NH4NO30.1%,KH2PO40.05%,MgSO4·7H2O 0.02%,柠檬酸 0.2%,司班80 0.02%。
1.3.2 筛选培养基
NaNO30.3%,MgSO4·7H2O 0.05%,KCl 0.05%,FeSO4·7H2O 0.001%,蔗糖 3%,K2HPO40.1%,琼脂1.2%。
1.3.3 保藏培养基
NaNO30.3%,MgSO4·7H2O 0.05%,KCl 0.05%,FeSO4·7H2O 0.001%,蔗糖 3%,K2HPO40.1%,琼脂1.2%。
1.3.4 摇瓶种子培养基
蔗糖20%,NaNO30.5%,KH2PO40.4%,KCl 0.05%,K2SO40.035%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,酵母粉1%,消泡剂<0.001%。
1.3.5 发酵培养基
蔗糖 20%,NaNO30.5%,KH2PO40.4%,KCl 0.05%,K2SO40.035%,MgSO4·7H2O 0.05%,FeSO4·7H2O 0.001%,酵母粉1%,消泡剂<0.001%,pH为5.5。
1.4 实验方法
1.4.1 出芽短梗霉的富集
将土壤和枯叶样本分别置于富集培养基中进行富集培养,将几个锥形瓶置于全温摇瓶柜中进行富集培养,培养条件:30 ℃,100 r/min,培养2~4 d。
1.4.2 出芽短梗霉的初筛
将富集培养基置于超净工作台上,使用移液枪吸取100 μL富集培养液置入筛选培养基上,使用涂布棒涂抹,涂抹后再用涂布棒涂抹下一个空白筛选培养基,这样梯度稀释3次于筛选培养基上,然后将筛选培养基置于25 ℃恒温培养箱中倒置培养,培养5 d,选取培养基上类似出芽短梗的单菌落进行分离纯化。
1.4.3 出芽短梗霉菌的复筛
将分离纯化后的种子置于冰箱中保存,使用时将种子培养基置于25 ℃恒温培养箱中活化培养0.5 d,然后置于超净工作台上进行操作,从斜面种子培养基挑取1环菌体接种于100 mL种子培养基中,摇床设置条件为25 ℃、120 r/min下进行振荡培养,恒温培养2 d。
1.4.4 出芽短梗霉菌的摇瓶种子培养
从4 ℃冰箱中取出斜面种子培养基,将斜面种子培养基置于25 ℃恒温培养箱中培养0.5 d进行活化,用接种环均匀挑选大小接近的种子接种于100 mL种子培养基中,调节pH至5.5,并于121 ℃灭菌20 min,于超净工作台冷却后操作,每次配制6个种子培养基平行,置于25 ℃、120 r/min全温摇瓶柜中培养2 d。
1.4.5 5 L发酵罐发酵
对复筛低聚果糖含量前三的菌种进行进一步的发酵培养,配制培养基溶液于发酵罐内并于121 ℃高温灭菌锅内灭菌20 min,由于糖类和酵母粉高温下会产生反应,将其分开灭菌。将300 mL摇瓶种子液接种于灭菌后的培养基培养液中,发酵过程中维持pH为5.5,发酵温度为25 ℃,转速为400 r/min,初始通气量为3 L/min,通过发酵罐所连接的发酵控制系统对发酵过程及发酵参数进行监控。接入发酵罐后立即取发酵初始(0 h)的发酵样品,每12 h取1次发酵样品,将样品置于超低温冰箱中保存,发酵过程为期3 d,发酵罐接种时挑选6个平行摇瓶中3瓶种子培养基,将3瓶培养基接入发酵罐,保证每次接种量都为300 mL,接种量为10%,发酵结束后对超低温冰柜中的样品进行处理,测定菌体干重和发酵液中的蔗糖、果糖、葡萄糖、低聚果糖的含量。
1.5 分析方法
1.5.1 液相色谱测定分析糖
色谱柱为Shodex Asahipak NH2P-50 4E聚合物氨基色谱柱,流动相为70%乙腈和30%超纯水,柱温30 ℃,流速1 mL/min,进样量为20 μL。在上述条件下测量蔗糖、果糖、葡萄糖和低聚果糖色谱柱,由蔗糖、果糖、葡萄糖和低聚果糖标准品计算得出。
1.5.2 干重法测定菌体浓度
发酵液的菌体浓度采用干重法测定,在发酵开始前,提前准备好离心管并编号,放置于90 ℃烘箱中烘制12 h至恒重,取出烘干后的离心管,置入干燥器内放置1 h至冷却,冷却后用电子天平称量离心管的重量。发酵过程中每隔12 h取1次发酵样品,使用移液枪取3 mL发酵样品于烘干后的离心管内,在5000 g下离心10 min,倒掉上清液,沉淀物用3 mL的生理盐水洗涤2次,每次洗涤都在5000 g下离心10 min,倒掉洗涤离心后的上清液,将洗涤完成后的离心管置于90 ℃烘箱中烘至恒重,然后用电子天平称量。处理时,每个发酵样品的菌体浓度都采取干重法平行测定,取平均值。
1.5.3 酶活的测定
1.5.3.1 酶活的测定条件
pH 5.5、反应温度55 ℃、反应时间1 h、反应混合物包含以下组分:800 g/L蔗糖 7.5 mL,0.1 mol/L柠檬酸缓冲液(pH 5.5)2.3 mL,酶样品0.2 mL。
1.5.3.2 酶活的定义
在1.5.3.1条件下,每1 min产生1 μmol葡萄糖所需的酶活性的量定义为1 U。
1.5.3.3 酶活的处理
分别测定发酵液的细胞外酶活和细胞内酶活,发酵过程中每隔12 h取1次发酵样品,使用移液枪取3 mL发酵样品于离心管内,在5000 g下离心10 min,上清液用作细胞外酶活的测定。沉淀物用3 mL生理盐水洗涤2次,每次洗涤都在5000 g下离心10 min,倒掉洗涤离心后的上清液,最后用生理盐水重悬至3 mL用作细胞内酶活的测定。
2 结果与分析
2.1 摇瓶发酵结果
出芽短梗霉菌菌落共9株,经检测产低聚果糖的菌落为7株,复筛结果见表1。
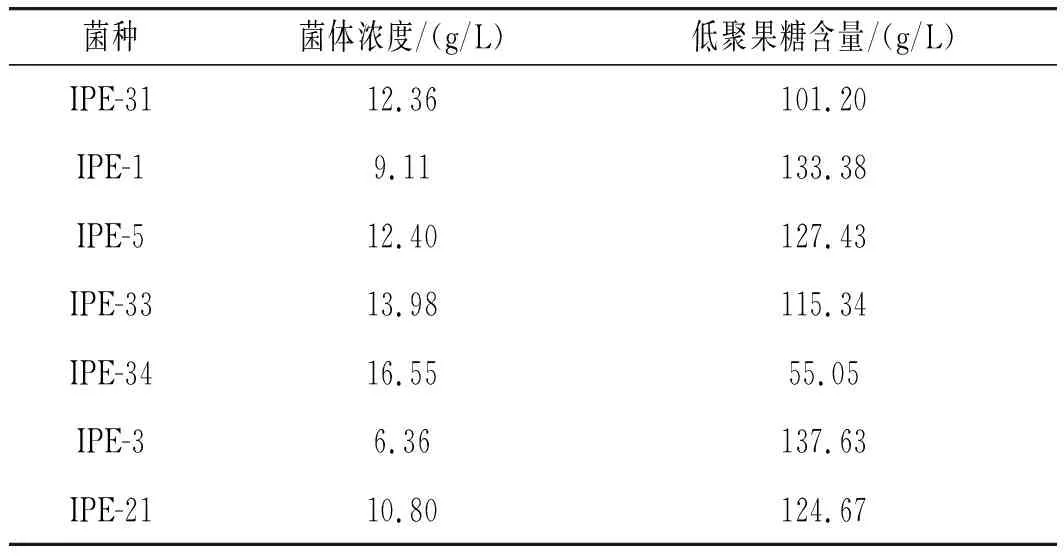
表1 菌株筛选结果Table 1 The selection results of strains
由表1可知,在12 h的摇瓶发酵周期内,菌体浓度最高的为IPE-34,但IPE-34的低聚果糖浓度反而最低,为55.05 g/L。菌体浓度最低的为IPE-3,而IPE-3的低聚果糖产量最高,为137.63 g/L。复筛结果中,低聚果糖含量前三的菌株为IPE-3、IPE-1和IPE-5,对复筛含量前三的菌株进行5 L发酵罐发酵,进一步了解菌株的发酵性能。
2.2 5 L发酵罐发酵结果
对复筛结果中低聚果糖产量最高的3株菌种进行发酵罐发酵实验,进一步对发酵性能进行比较,所得发酵性能曲线见图1。

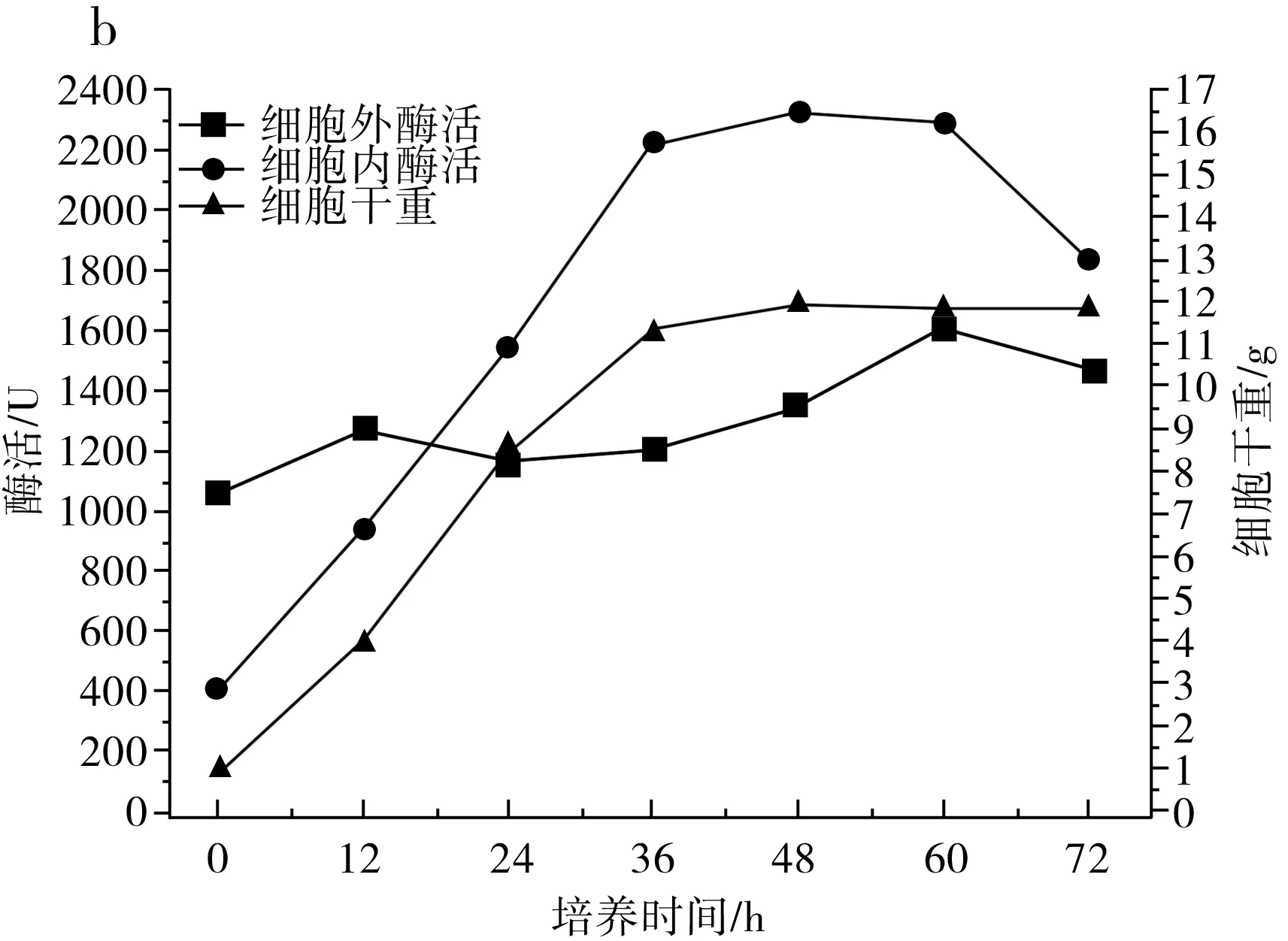
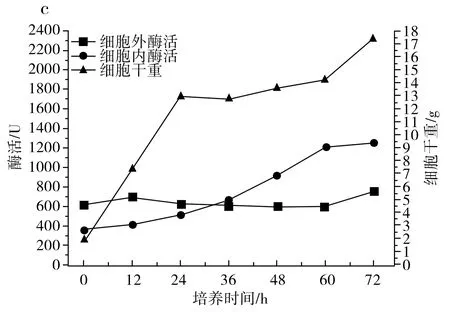
图1 IPE-1(a)、IPE-3(b)、IPE-5(c)发酵性能及细胞干重Fig.1 Fermentation performance and cell dry weight of IPE-1 (a), IPE-3 (b), IPE-5 (c)
由图1中a可知,在3 d的发酵周期内,菌体浓度在24~60 h内是一个比较明显的平稳期,IPE-1的细胞内酶活和细胞外酶活相差不大,比较接近。当3 d发酵周期结束时,IPE-1的菌体浓度为15.98 g/L,细胞外酶活为1771 U,细胞内酶活为1124 U,总酶活为2895 U。
由图1中b可知,在3 d的发酵周期内,IPE-3的菌体浓度在36 h后基本没有明显上涨,保持相对稳定的状态,细胞内酶活在24 h明显超过细胞外酶活,并在36~60 h时维持在较高状态,细胞外酶活一直维持在相对稳定的状态。当3 d发酵周期结束时,IPE-3的菌体浓度为11.91 g/L,细胞外酶活为1473 U,细胞内酶活为1833 U,总酶活为3306 U。
由图1中c可知,在3 d的发酵期内,IPE-5的菌体浓度在24 h前快速上涨,在36 h之后缓速上涨,36 h前细胞内酶活比较低,36 h后细胞内酶活超过细胞外酶活,但总体来说,细胞内酶活和细胞外酶活相差不大。当3 d发酵周期结束时,IPE-5的菌体浓度为17.51 g/L,细胞外酶活为758 U,细胞内酶活为1253 U,总酶活为2011 U。
进一步分析发酵数据,对比3株菌株,对发酵过程中糖的利用进行分析,得发酵性能曲线,见图2。
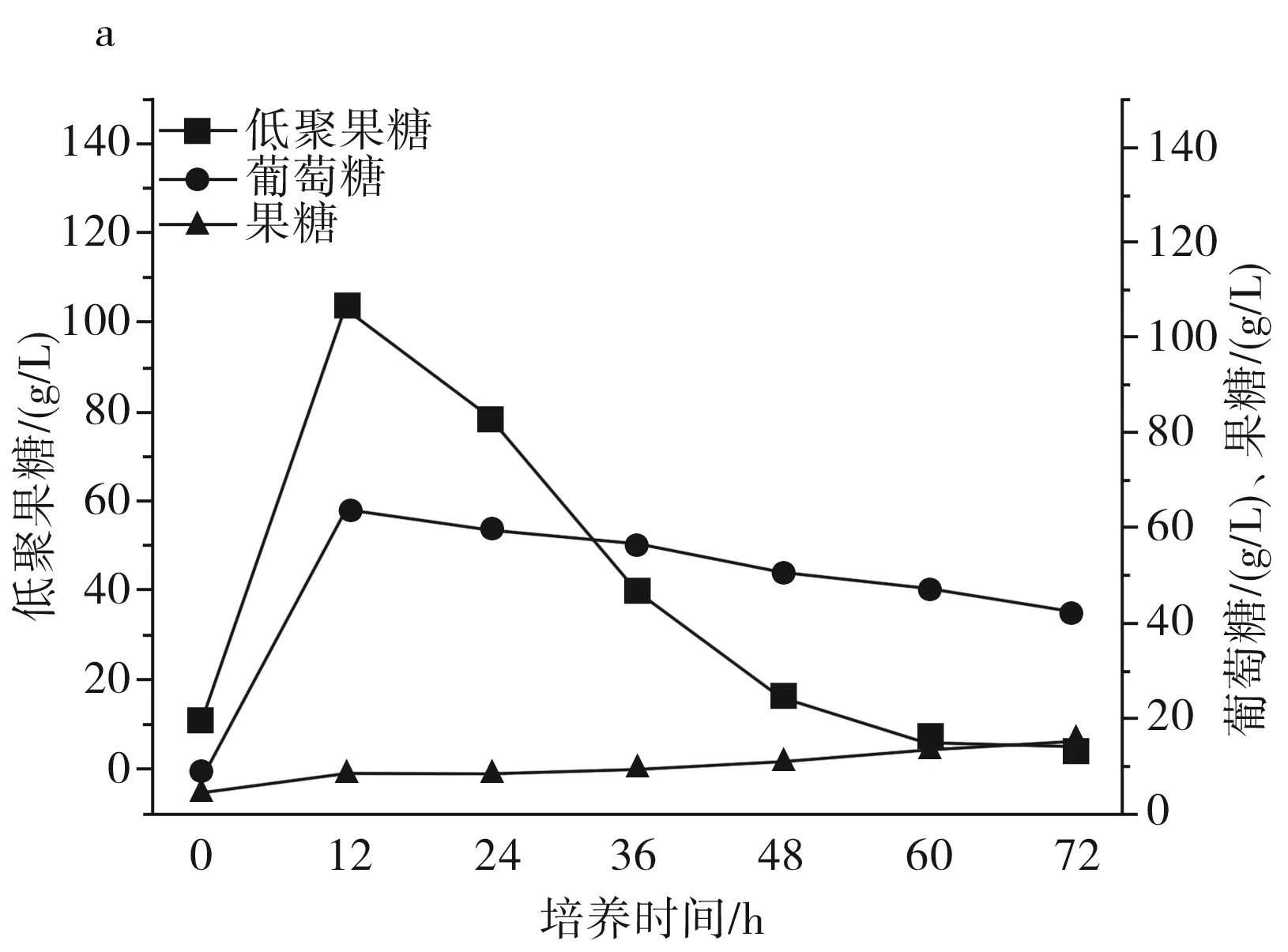
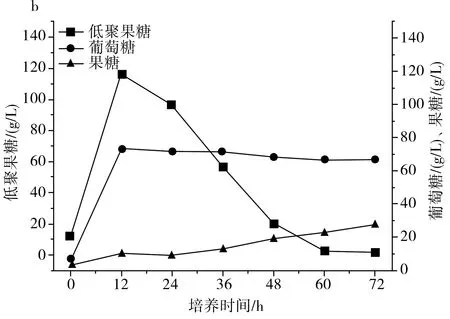

图2 IPE-1(a)、IPE-3(b)、IPE-5(c)发酵性能Fig.2 Fermentation performance of IPE-1 (a), IPE-3 (b), IPE-5 (c)
由图2中a可知IPE-1在整个发酵周期内果糖、葡萄糖的利用状况和低聚果糖产量。在整个发酵周期内,果糖一直维持在一个低水平的状态,葡萄糖在12 h左右达到峰值,12 h至发酵结束缓慢下降,维持在相对稳定的状态,低聚果糖在12 h达到峰值,并在12 h至发酵结束持续下降。整个发酵过程中,低聚果糖的峰值为103.57 g/L,葡萄糖的峰值为64.30 g/L,果糖的峰值为14.6 g/L。
由图2中b可知IPE-3在整个发酵周期内果糖、葡萄糖的利用状况和低聚果糖产量。在整个发酵周期内,果糖维持在较低水平,并在缓慢提高,72 h时达到峰值,葡萄糖在12 h时达到峰值,并在之后维持在相对稳定的状态,低聚果糖在12 h时达到峰值,并在之后持续下降到发酵结束。在整个发酵过程中,低聚果糖的峰值为116.62 g/L,葡萄糖的峰值为73.42 g/L,果糖的峰值为27.68 g/L。
由图2中c可知IPE-5在整个发酵周期内果糖、葡萄糖的利用状况和低聚果糖产量。在0~48 h,果糖含量在逐步上升,并在48 h达到峰值,葡萄糖在12 h达到峰值,并在之后持续下降,低聚果糖在12 h时达到峰值,然后持续快速下降到发酵结束。在整个发酵过程中,低聚果糖的峰值为110.91 g/L,葡萄糖的峰值为49.28 g/L,果糖的峰值为65.90 g/L。
由图1可知,IPE-1和IPE-5发酵液中的菌体浓度在发酵过程中均上升较快,IPE-3发酵液中的菌体浓度与IPE-1和IPE-5相比上升较慢,在60~72 h,IPE-1和IPE-3发酵液中的菌体浓度又开始快速上升,发酵结束时IPE-3的菌体浓度最低,但细胞总酶活最高。
由图2可知,IPE-1、IPE-3和IPE-5发酵液中的低聚果糖主要在最初的12 h内产生,并在12 h之后呈持续下降趋势,IPE-1、IPE-3和IPE-5蔗糖原料在12 h时还有少量,在24 h前,发酵液中的原料蔗糖已消耗完,推测低聚果糖浓度的降低是因为蔗糖原料不足以及葡萄糖浓度的升高,葡萄糖浓度的升高会对低聚果糖的合成起抑制作用,在12 h之后,由于原料耗尽以及葡萄糖的反馈抑制作用,β-D-呋喃果糖苷酶的水解活性大于果糖基化活性,低聚果糖开始持续分解,充当碳源被菌体利用,以维持菌体自身代谢和菌体生长。综合得出,IPE-3为生产低聚果糖的最优菌株。
2.3 发酵条件的优化
2.3.1 发酵罐搅拌转速对IPE-3发酵的影响
在不同的通气量下分批培养的时间曲线,在2.7 L生物反应器中于pH为5.5,25 ℃下以不同的通气量培养出芽短梗霉菌IPE-3,在400,600,800,1000 r/min条件下,低聚果糖产量、细胞酶活、菌体浓度和发酵耗氧情况见图3。
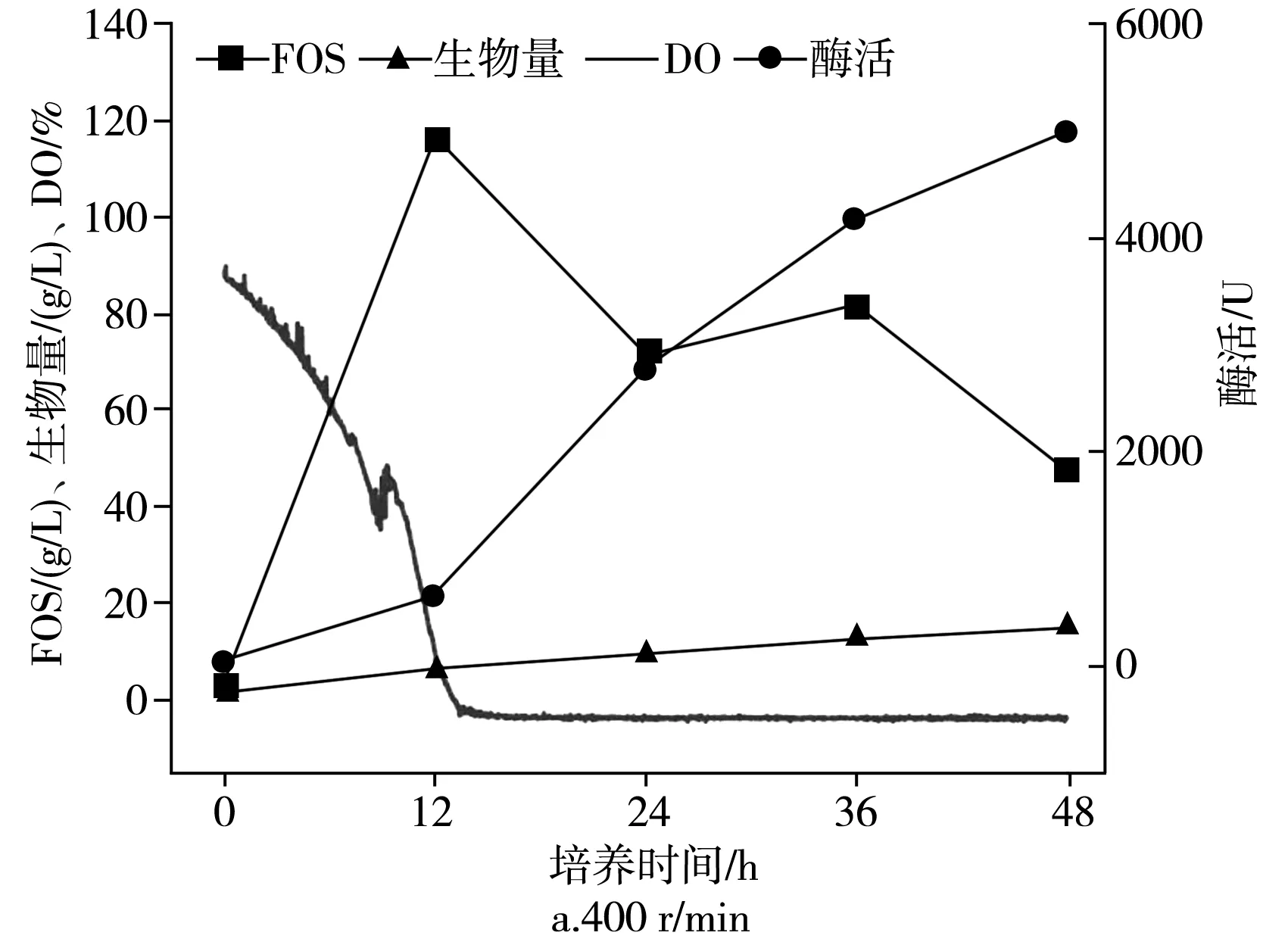


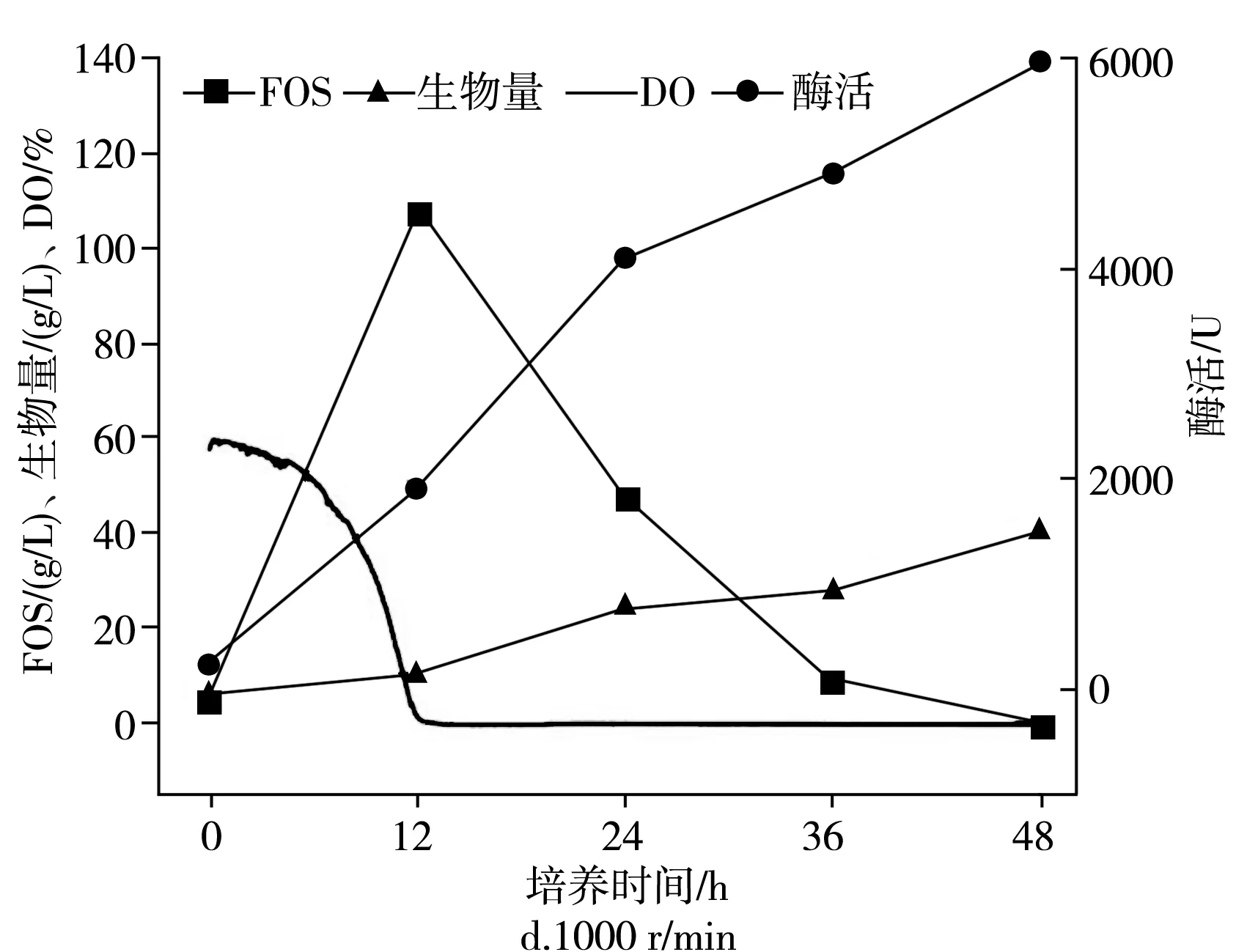
图3 搅拌转速对IPE-3发酵的影响Fig.3 Effect of stirring speed on the fermentation of IPE-3
出芽短梗霉在发酵过程中,DO值随搅拌速度的变化而变化。同时,根据文献报道,出芽短梗霉可以暴露于高剪切速率下,所以制定了从低转速到高转速不同的搅拌速度(400,600,800,1000 r/min)进行分批培养,以研究搅拌速度对低聚果糖生物合成的影响。由图3可知,低聚果糖在12 h时获得了最大浓度,在搅拌转速为400,600,800,1000 r/min下低聚果糖的最大浓度分别为(116.6±5.8),(123.2±6.2),(97.2±4.9),(106.8±5.3) g/L。在600 r/min下获得最大产率为61.6%±3.0%(g FOS/g蔗糖)。同时发现,发酵结束时,酶的活性在400,600,800,1000 r/min下12 h时分别为(636.5±31.8),(1666.3±84),(1691.6±84.6),(1927.2±96.4) U。
当搅拌转速高于400 r/min时,酶活性增长迅速,而当搅拌转速高于600 r/min后,酶活性几乎没有增加。对于菌体浓度,在发酵时逐渐增加,在400,600,800,1000 r/min下发酵12 h时分别为(6.3±0.30),(6.2±0.31),(10.2±0.51),(10.4±0.50) g/L。当搅拌速度高于600 r/min时,菌体浓度急剧增加,而在400 r/min和600 r/min或800 r/min和1000 r/min之间没有太大差异。因此,搅拌转速对低聚果糖的产生、酶产生和细胞生长显示出不同的影响。同时,根据以上数据进一步分析可以发现,低聚果糖的产生和酶活性不一致。同样,尽管细胞的生长和酶的产生随着培养时间的增加而增加,但当时它们并没有耦合。此外,在所有使用的搅拌速度下,培养12 h后,DO值均降至0以下,并且培养12 h后低聚果糖开始下降。可以得出以下结论:高溶氧会促进低聚果糖的增加和产生,而低溶氧会促进细胞的生长和酶的产生。另外,搅拌转速可以增强氧气的溶解,但是不能产生氧气。因此,接下来研究通气量对低聚果糖的影响,因为这是氧气的来源。
2.3.2 发酵罐通气量对IPE-3发酵的影响
在不同的通气量下分批培养的时间曲线,在2.7 L生物反应器中于pH为5.5,25 ℃下以不同的通气量培养出芽短梗霉IPE-3,在0.9,1.8,2.7 L/min通气量下,低聚果糖产量、细胞酶活、菌体浓度和发酵耗氧情况见图4。

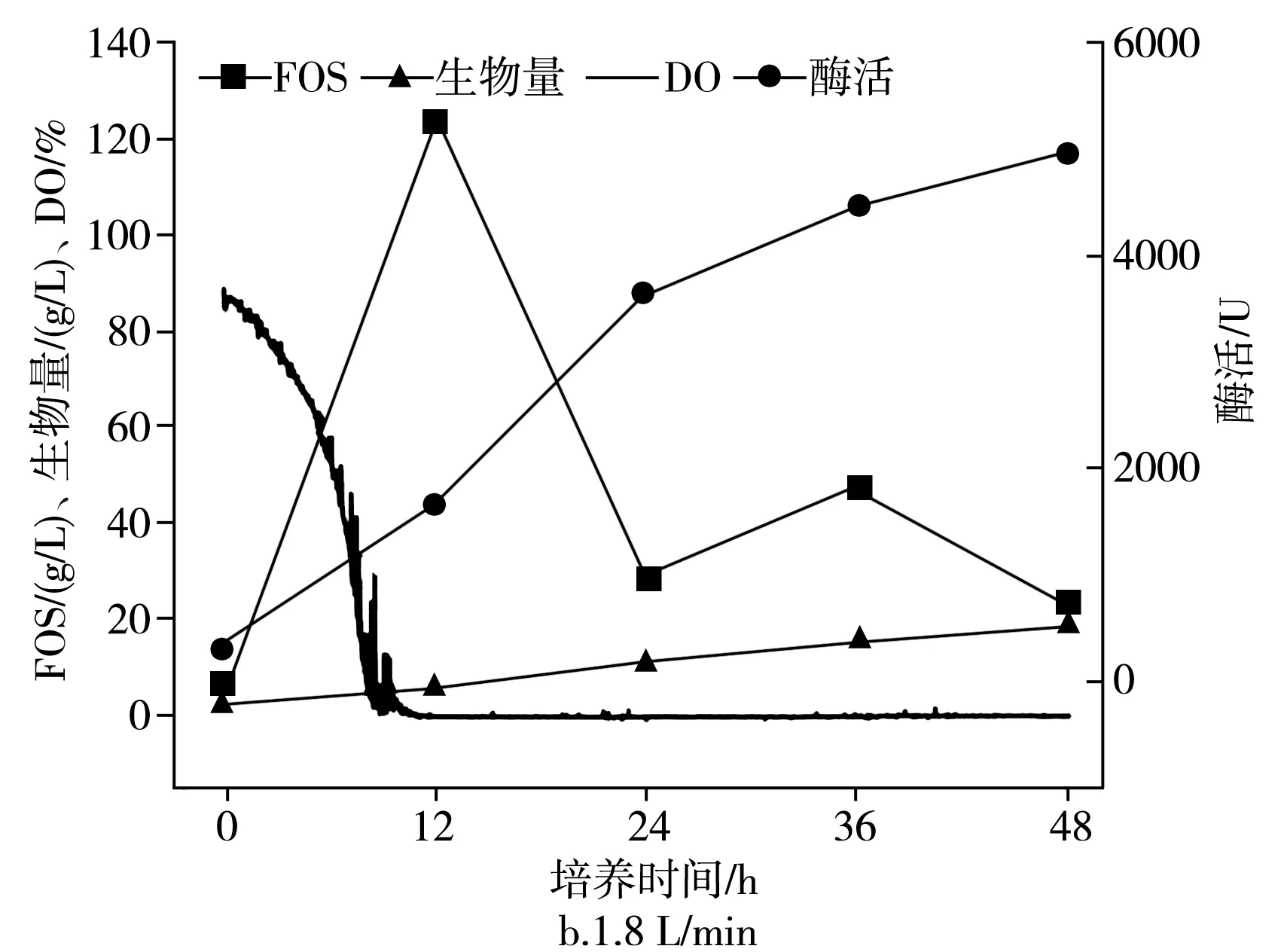

图4 通气量对IPE-3发酵的影响Fig.4 Effect of ventilation volume on the fermentation of IPE-3
由图4可知,低聚果糖在12 h时获得了最大浓度,FOS的最大浓度在0.9,1.8,2.7 L/min的条件下分别为(118.7±5.9),(123.2±6.2),(81.2±4.1) g/L。低聚果糖含量在0.9 L/min和1.8 L/min之间没有太大差异,而在2.7 L/min时则比0.9 L/min和1.8 L/min时低得多。对于菌体的酶的产生和细胞的生长,它们的浓度一直在增加,持续到发酵结束。对于酶活性,在0.9,1.8,2.7 L/min下,在12 h时分别为(1449.6±68.3),(1666.3±83.3),(1440.4±72.0) U。
当发酵培养12 h后,酶活性在2.7 L/min下增长缓慢。对于菌体浓度,在0.9,1.8,2.7 L/min下,在12 h时分别为(6.8±0.34),(6.18±0.31),(12.9±0.51) g/L。培养12 h后,在0.9 L/min条件下的细胞比在1.8 L/min条件下的细胞生长快,这导致在发酵时,在0.9 L/min条件下的酶活性比在1.8 L/min条件下的酶活性低。同时,在2.7 L/min条件下,短梗霉菌细胞在整个发酵过程中生长迅速,远高于在0.9 L/min和1.8 L/min条件下的菌体浓度。因此,推测在2.7 L/min下低聚果糖浓度和酶活性低得多的原因是较高的菌体浓度。对于DO值,在所有通气量条件下,DO值均下降至0以下,这意味着在发酵培养12 h后,通气量的增加无法显著提高DO值,而在第一时间就影响了低聚果糖的产生。推测12 h的原因可能是发酵液中的氧分子无法在水中有效溶解,因此,下一部分将研究发酵过程中罐压的影响。
2.3.3 发酵罐罐压对IPE-3发酵的影响


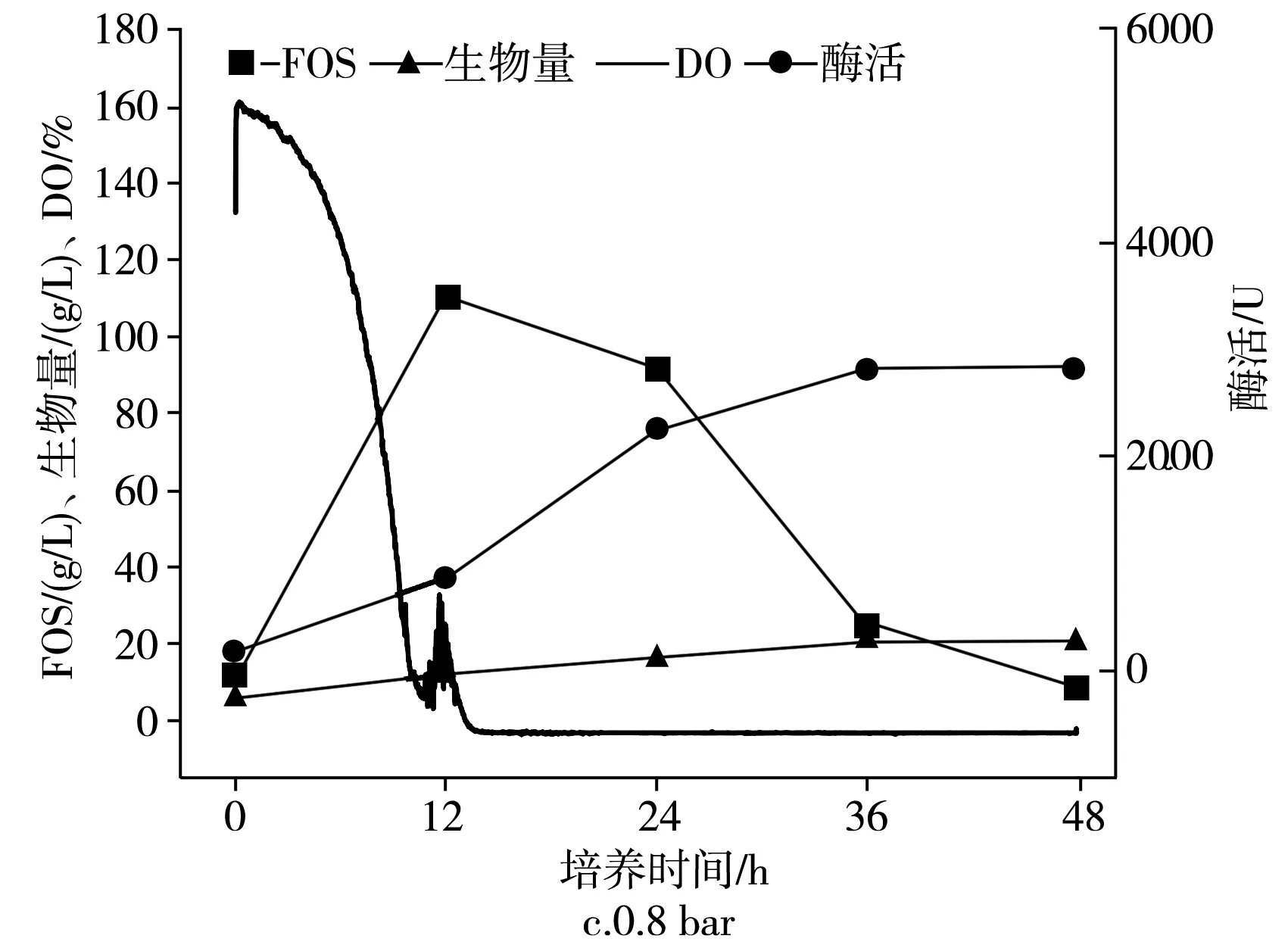
图5 罐压对IPE-3发酵的影响Fig.5 Effect of tank pressure on the fermentation of IPE-3
在生物反应器的不同罐压下分批培养的时间曲线,在2.7 L生物反应器中于pH为5.5、1.8 L/min、25 ℃和不同压力的发酵罐中培养出芽短梗霉菌IPE-3,IPE-3在0,0.4,0.8 bar罐压下,低聚果糖产量、细胞酶活、菌体浓度和发酵耗氧情况见图5。
由图5可知,随着发酵罐罐压的提高,对于低聚果糖的产量而言,在较高的发酵罐罐压下,低聚果糖的产量反而会下降,在12 h,0,0.4,0.8 bar条件下,低聚果糖的浓度分别为(123.2±6.2),(114.2±5.7),(110.4±5.5) g/L。对于菌体浓度而言,在0.4 bar时显著增加,0.4 bar和0.8 bar相比,几乎保持恒定,在0,0.4,0.8 bar下分别为(6.2±0.31),(11.9±0.57),(11.4±0.61) g/L。对于酶活性,在0.4 bar之前在较高的发酵罐罐压下升高,然后下降,在0,0.4,0.8 bar下分别为(1666.3±84),(1954.2±77.7),(863.5±48.2) U。
由图5可知,当生物反应器的罐压提高到0.8 bar时,几乎达到了所用发酵罐的最大值,初始发酵时发酵反应器的溶氧高达161.2%,与0 bar条件下相比,培养12 h并没有得到有效改善。这意味着仅通过一个因素(即搅拌转速、通气量或发酵罐罐压)不能提高DO值。此外,酶产生的趋势也不完全符合细胞生长。例如,菌体浓度在0.8 bar下最高,而酶活性在此压力下最低。因此,碳源进入细胞生长,低聚果糖的产生和酶产生的代谢途径被生物反应器的不同压力所改变,在相同的发酵液成分下,菌体浓度、低聚果糖浓度和酶的浓度在生物反应器的不同压力下也会发生改变。
3 结论
本研究通过对从土壤中筛选和实验室已有的出芽短梗霉菌进行发酵实验,发现IPE-3是一种生产低聚果糖的优秀菌株,在发酵中,IPE-3细胞浓度不高,但是细胞酶活和低聚果糖的产量高,适合作为低聚果糖的生产菌株。对IPE-3进行溶氧控制的研究,通过控制发酵罐的转速、通气量和罐压发现,IPE-3在搅拌转速600 r/min下低聚果糖产量最高,在通气量1.8 L/min下低聚果糖产量最高,在加压条件下低聚果糖的产量会下降。

