长链非编码RNA SNHG16通过miR-141-3p/FOXJ3通路调控肝细胞癌的增殖
吴 涛,杨 柳,聂山茂,张 杨,张 鑫
(泸州市人民医院肝胆外科,四川泸州 646000)
肝细胞癌所具有的病变进展快、预后差等特点,主要与肿瘤的高增殖活性、高转移率及复发率有关[1]。从基因调控角度研究肝细胞癌的发生发展机制,对其基础研究和临床防治均有重要价值[2]。微小RNA(microRNAs,miRNAs)作为表观遗传因子可在转录后调控靶基因调节肿瘤的形成和进展[3]。长链非编码RNA(long non-coding RNA, lncRNA)是指超过200bp单核苷酸序列的统称,不具有编码蛋白的功能,可作为miRNAs的上游调控因子[4]。本研究应用生物信息分析筛选出可能在肝细胞癌中异常表达的长链非编码RNA小核仁RNA宿主基因16(small nucleolar RNA host gene 16,SNHG16)作为研究对象,筛选出其下游有结合位点的miR-141-3p进行实验设计,关注SNHG16介导miR-141-3p/FOXJ3对肝细胞癌细胞增殖的调控作用。
1 材料与方法
1.1 材料
人肝细胞癌细胞株(Hep-3B、Huh7)和人正常肝细胞株(HL-7702)均购自中国科学院上海细胞库,RPMI 1640培养基和胎牛血清均购自美国Gibico公司,Lipofectaminie2000和TRIzol均购自美国Invitrogen公司,逆转录试剂盒购自广州复能基因有限公司,CCK-8试剂盒购自上海汉恒生物科技有限公司,总蛋白提取试剂盒、BCA蛋白定量试剂盒均购自上海碧云天生物技术公司,FOXJ3、β-Actin购自苏州睿瀛生物技术公司,二抗和DAB购自武汉博士德生物技术公司,Dual Luciferase Reporter基因实验试剂盒购天北京普洛麦格生物技术有限公司。PCR仪为美国伯乐公司生产。
1.2 临床资料
选择2019年1月~2020年12月在泸州市人民医院确诊为肝细胞癌并行手术治疗的患者作为研究对象。纳入标准:(1)经病理医师确诊,并符合WHO中的病理诊断标准;(2)临床随访资料完整。排除标准:(1)双原发癌或多原发癌;(2)伴有风湿免疫性疾病;(3)病理形态中伴有其它类型恶性肿瘤成份者。共选择49例,其中男26例,女23例,年龄34~79岁,中位年龄56岁,其中高分化14例,中分化19例,低分化16例。留取术后肿瘤组织和距肿物边缘>3cm的癌旁肝组织(-80℃冰箱中冻存)。研究经医院伦理委员会批准通过。
1.3 方法
1.3.1 细胞培养 Hep-3B、Huh7和HL-7702细胞株复苏后,在37℃,5% CO2的培养箱中应用含有10%胎牛血清的RPMI 1640培养基进行培养,在细胞密度约70%~90%时,进行传代培养,倒置显微镜观察细胞的生长状态。
1.3.2 细胞转染分组 选择生长状态好的Hep-3B、Huh7细胞作为空白对照组(未行转染的细胞)。转染pc-DNA3.1建立空载体转染组,转染pc-DNA3.1-SNHG16建立pc-DNA3.1-SNHG16组、转染pc-DNA3.1-SNHG16-siRNA建立si-SNHG16组、转染 miR-141-3p inhibitor建立miR-141-3p inhibitor组、转染miR-141-3p mimic建立miR-141-3p mimic组、转染pc-DNA3.1-FOXJ3-siRNA建立si-FOXJ3组。实验均设3个复孔。
1.3.3 实时荧光定量PCR 应用实时荧光定量PCR(qRT-PCR)法检测SNHG16和miR-141-3p的表达。TRIzol提取总RNA,检测其纯度。逆转录法获得总的cDNA。SNHG16引物上游:5'-GCTAACGTGTAC TAAACGAGTTCCGCT-3',下游:5'-CCAGTGTACT GCCCAAAGACTTAAAACG-3'。miR-141-3p引物上游:5'-GTGAACATTCATGTTGCCGTCGG-3',下游:5'-GGTGCAACGGTCCGACGTTATTG-3'。以U6为内参,上游:5'-CTCGTTCTTCGCACATATACACA-3',下游:5'-AACGGTGCAGCCGAGGTATCGT-3'。程序设定:95℃预变性30s;变性95℃ 30s,退火60℃ 10s,延伸72℃ 30s,共35个循环,72℃延伸5min。结果以2-ΔΔCt表示。
1.3.4 CCK-8实验 取对数生长期的细胞,洗涤后用0.25%的胰蛋白酶水化,吹打混匀,调整细胞密度至3.0×104个/ml。应用96孔板(板的最外围不加细胞悬液),孔内接种约5000个细胞(各3个复孔)。进行细胞转染后,在24h、48h、72h和96h时分别加入10μl 的CCK-8试剂,1h后用酶标仪测定于450nm处的吸光度值(OD值),绘制细胞活力曲线。
1.3.5 Western blot实验 提取总蛋白后测定蛋白浓度,SDS-PAGE凝胶电泳、转膜、封闭,加一抗、二抗、ECL化学发光法显示蛋白条带,以β-Actin为内参,应用Image J软件测量蛋白条带灰度值。
1.3.6 双荧光素酶报告基因实验 构建含有野生型SNHG16的质粒(WT-SNHG16)和突变型SNHG16的质粒(MT-SNHG16),分别同miR-141-3p mimic、miR-141-3p NC进行共转染;构建含有野生型FOXJ3的质粒(WT-FOXJ3)和突变型FOXJ3(MT-FOXJ3)的质粒,分别同miR-141-3p mimic、miR-141-3p NC进行共转染,观察荧火虫发光值和海肾发光值(对照)。相对荧光素酶活性=荧火虫发光值/海肾发光值。
1.3.7 免疫组化实验 肝细胞癌组织和癌旁肝组织均经常规福尔马林固定、脱水、石蜡包埋、切片后应用免疫组化二步法检测组织中FOXJ3的表达,DAB显色。FOXJ3的表达定位于细胞核,棕黄色为阳性,选择5个高倍视野(400倍)计算百分率,取平均值,以≥25%为阳性,以<25%为阴性,计算阳性率。
1.4 统计学分析
应用SAS 6.12软件进行统计学分析,定量资料应用均数±标准差表示,两组间比较行t检验,多组间比较行方差分析(SNK法行两两比较),率的比较行卡方检验,应用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 生物信息分析结果
生物信息分析显示,SNHG16和miR-141-3p、miR-141-3p和FOXJ3具有可能结合的碱基序列。见图1、2。

图1 SNHG16和miR-141-3p可能结合的位点(Starbase)

图2 miR-141-3p和FOXJ3可能结合的位点(TargetScan)
2.2 肝癌细胞株与正常肝细胞株中SNHG16、miR-141-3p和FOXJ3表达的比较
qRT-PCR法检测SNHG16和miR-141-3p的表达,Western blot法检测FOXJ3的表达。结果显示,肝癌Hep-3B细胞株中SNHG16(1.45±0.19vs1.01±0.21,t=3.54,P=0.012)和FOXJ3(1.26±0.21vs0.85±0.02,t=3.98,P=0.009)的表达量明显高于正常肝细胞株,miR-141-3p的表达量明显低于正常肝细胞株(0.89±0.13vs1.03±0.04,t=2.57,P=0.030)。肝癌Huh7细胞株中,SNHG16(1.56±0.25vs1.04±0.26,t=3.59,P=0.011)和FOXJ3(1.19±0.16vs0.77±0.09,t=2.15,P=0.043)的表达量明显高于正常肝细胞株,miR-141-3p的表达明显低于正常肝细胞株(0.81±0.15vs1.06±0.12,t=2.34,P=0.039)。见图3。

图3 Western blot检测不同细胞系中FOXJ3的表达
2.3 CCK-8实验结果
Hep-3B细胞株:与空白对照组和空载体转染组比较,pc-DNA3.1-SNHG16组细胞活性在48h明显升高(0.59±0.10vs0.45±0.03vs0.42±0.09,F=3.11,P=0.039),si-SNHG16组细胞增殖活性在48h时明显降低(0.32±0.03vs0.45±0.03vs0.42±0.09,F=3.46,P=0.031),均持续至96h(P<0.05)。Huh7细胞株:与空白对照组和空载体转染组比较,pc-DNA3.1-SNHG16组细胞活性在48h明显升高(0.56±0.11vs0.44±0.06vs0.43±0.11,F=3.47,P=0.027),si-SNHG16组细胞增殖活性在48h时明显降低(0.33±0.05vs0.44±0.06vs0.43±0.11,F=3.21,P=0.037),均持续至96h(P<0.05)。见图4。

图4 CCK-8实验结果
2.4 双荧光素酶报告基因实验
双荧光素酶报告基因实验显示SNHG16和miR-141-3p、miR-141-3p和FOXJ3具有靶向关系。见图5。
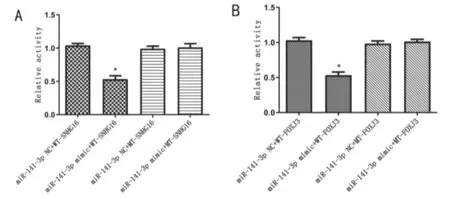
图5 双荧光素酶报告基因实验
2.5 挽救实验
为了证实SNHG16通过miR-141-3p/FOXJ3影响肝细胞癌的增殖,对肝癌Hep-3B细胞株进行了沉默miR-141-3p的挽救实验。结果显示miR-141-3p inhibitor与si-SNGH16、si-FOXJ3与miR-141-3p inhibitor细胞增殖活性均明显高于转染si-SNHG16或si-FOXJ3(P<0.05),即沉默miR-141-3p可部分逆转沉默SNHG16和FOXJ3对细胞增殖的抑制作用。见图6。
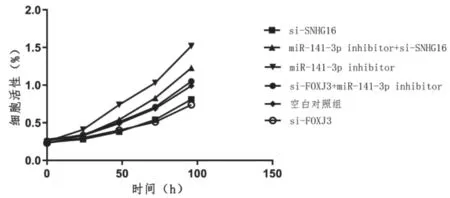
图6 挽救实验(Hep-3B细胞株)
2.6 肝细胞癌和癌旁肝组织中SNHG16和miR-141-3p表达量的比较
肝细胞癌组织中SNHG16的表达量明显高于癌旁肝组织,miR-141-3p的表达量明显低于癌旁肝组织。见表1。
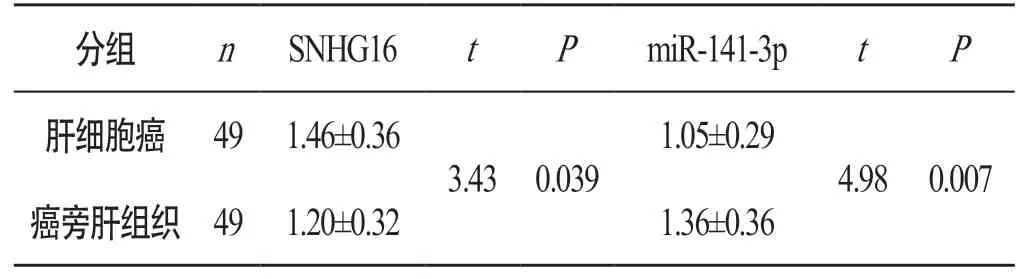
表1 肝细胞癌和癌旁肝组织中SNHG16和miR-141-3p表达量的比较
2.7 肝细胞癌和癌旁肝组织中FOXJ3阳性率的比较
肝细胞癌中FOXJ3表达的阳性率明显高于癌旁肝组织中表达的阳性率。见表2、图7。2.8 肝细胞癌中SNHG16、miR-141-3p、SNHG16、FOXJ3和Ki67指数表达的相关性

表2 肝细胞癌和癌旁肝组织中FOXJ3阳性率的比较

图7 肝细胞癌和癌旁肝组织中FOXJ3的表达
FOXJ3在肝细胞癌中的表达范围是20%~80%,平均值为47%,Ki67在肝细胞癌中的表达范围是10%~70%,平均值为42%。Spearman相关分析显示肝细胞癌中SNHG16与miR-141-3p(r=-0.67,P=0.032)、miR-141-3p 与FOXJ3(r=-0.69,P=0.030)均呈负相关性,SNHG16与FOXJ3(r=0.62,P=0.039)、FOXJ3与Ki67(r=0.74,P=0.002)均呈正相关性。Ki67的表达见图8,相关分析见图9。
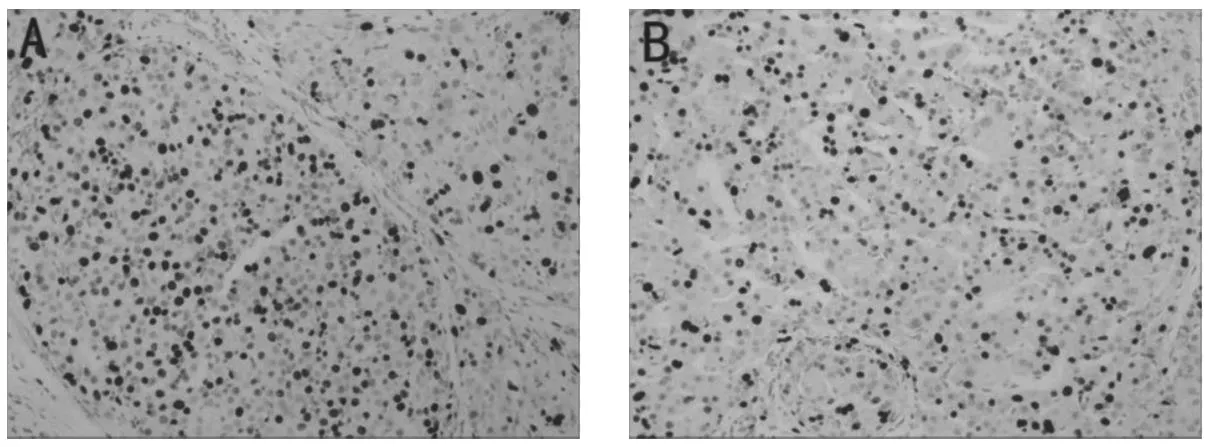
图8 Ki67的表达(IHC×200)

图9 相关分析图
3 讨论
LncRNA由对应的基因转录形成,具有5’帽子和ploy尾巴,通过剪切形成的成熟体,参与剂量补偿效应、表观遗传学调控、细胞周期调节和细胞分化调控[5]。ceRNA机制中,LncRNA通过竞争性结合miRNAs调控其对应的靶基因[6,7]。FOXJ3是miR-141-3p下游的靶基因,其高表达与肝细胞癌的增殖有关[8]。FOXJ3蛋白与目标启动子有互补基序,其结合后它们的C末端反式激活结构域就会启动基因转录,根据被招募相关辅助因子的范围发挥转录激活或抑制作用,是调节细胞增殖的基础。
本实验设计充分利用生物信息技术,经筛选、分析发现,SNHG16在肝细胞癌中可能有促进作用,并发现SNHG16和miR-141-3p、miR-141-3p和FOXJ3具有可能结合的碱基序列。本实验检测到SNHG16和FOXJ3在人肝癌细胞株和人肝细胞癌组织中的表达均升高,miR-141-3p的表达下调,提示3者异常表达在肝细胞癌形成中有重要价值。细胞培养实验发现转染pc-DNA3.1-SNHG16细胞的增殖活性在48h时明显升高,转染si-SNHG16细胞的增殖活性明显降低,提示SNHG16是调节肝细胞癌细胞增殖的重要促进因子,此结果经组织学实验中检测到SNHG16与Ki67正相关性得到间接证实。双荧光素酶报告基因实验直接证实了SNHG16和miR-141-3p、miR-141-3p和FOXJ3具有靶向关系,亦证实了生信分析的结果,提示SNHG16可能与miR-141-3p/FOXJ3通路具有调控关系。FOXJ3高表达与肝细胞癌的增殖有关,是重要的调控细胞分裂的转录因子[9,10]。挽救实验显示,沉默miR-141-3p可部分逆转沉默SNHG16和FOXJ3对细胞增殖的抑制作用,直接证实了SNHG16通过miR-141-3p/FOXJ3通路调控肝细胞癌的增殖作用,此结论在组织学实验检测SNHG16与miR-141-3p、miR-141-3p与FOXJ3、FOXJ3与Ki67的相关性中得到间接证实。SNHG16是一种原癌基因,其下游具有多种miRNAs等相关基因[11,12],其对肿瘤增殖的调控作用强,但是SNHG16与miR-141-3p之间是否通过海绵吸附的方式进行调控尚需要进一步实验证实[13]。miR-141-3p是SNHG16调控中最重要的miRNAs之一,miR-141-3p具有抑癌基因样的作用,下游受控基因众多,功能复杂[14-16]。SNHG16发挥作用时与诱导下游的多种因子有关,如调节miR-200a-3p[17]、miR-98-5p[13]等,这使SNHG16的功能及机制更复杂[18,19]。miR-141-3p/FOXJ3是本研究关注的调控通路,其中的FOXJ3是主要的细胞增殖调节基因。FOXJ3能诱导多个通路调节增殖,如启动周期素或增殖细胞核抗原途径等[20],也有学者认为FOXJ3可通过负反馈抑制细胞凋亡,包括调节BAX和BCL-2基因等[21]。本研究关注的SNHG16调控通路可能是肝细胞癌增殖调控路径之一[22,23],基于此通路进行干预研究可能为肝细胞癌的治疗提供帮助。
总之,肝细胞癌中SNHG16的表达升高,SNHG16通过miR-141-3p/FOXJ3途径促进肝细胞癌的增殖。

