室内饲养对高原鼠兔肠道微生物群落构建过程的影响
张良志 唐显江 任世恩 赵雅琪 张堰铭*
(1 中国科学院西北高原生物研究所,中国科学院高原生物适应与进化重点实验室,西宁810001)(2 青海省动物生态基因组学重点实验,西宁810001)(3 中国科学院大学,北京 100049)
室内饲养是野生动物实验化和疾病模型创建最基本的技术手段(邵义祥,2003)。然而,当野生动物带入室内后,由于生活空间、食物条件以及社群关系等发生一系列的变化(郑强和林永红,1996),进而导致其内分泌失调(Chalifouxet al.,1982)、肥胖(Neumanet al.,2015)、免疫水平下降(Martinet al.,2011) 以及不孕不育等疾病(Crean and Senior,2019)。已有研究表明,圈养可引起大熊猫(Ailuropoda melanoleuca) 肠道菌群多样性显著降低(Guoet al.,2019);与野生相比,动物园饲养的白唇鹿(Przewalskium albirostris) 肠道菌群中拟杆菌门(Bacteroidetes)丰度显著增加,而厚壁菌门(Firmicutes) 丰度则显著降低(Liet al.,2022);在冬季,动物园饲养的藏野驴(Equus kiang) 肠道菌群中厚壁菌门丰度较野外种群显著增加,而拟杆菌门丰度显著降低(Gaoet al.,2019)。室内饲养还可导致穿山甲(Manis pentadactyla) 抗性基因丰度及多样性显著增加(Liuet al.,2021)。然而,迄今为止,有关室内饲养或圈养对肠道微生物群落构建过程的研究基本没有涉及。
过去十余年,微生物群落多样性、稳定性以及构建过程一直是国际生态学研究的热点(Hutchinson,1959;Zhou and Ning,2017)。探讨群落构建可增进对生物多样性维持机制(Weiheret al.,2011)、群落演替(Drake,1990)、种群恢复(Keddy,1999)、物种入侵(Pearsonet al.,2018)以及有害生物防治等方面的理解(Martínez-Salinaset al.,2016),为野生动物资源利用和环境保护提供必要的基础理论。依据物种共存关系和多样性形成机制,生态学家先后提出中性理论和生态位理论以解释群落的构建过程(Hubbell,2001;Chave,2004;Volkovet al.,2004)。中性理论假设所有物种的生态功能是均等的,物种丰度的变异主要受到出生、拓殖、死亡、灭绝以及分化等影响,被称为随机过程 (MacArthur and Wilson,1967;Hubbell,2001;Chave,2004;Etienne and Olff,2004)。与此对应,生态位理论则强调环境因子(温度、pH 值、湿度等)和生物因子(物种特性、种间互作等)是控制群落结构的关键因素,也被称作确定性过程(Peter,2000)。近年来,越来越多的研究表明,随机过程和确定性过程可同时对群落的构建产生作用,并在不同的环境和宿主条件下表现出一定的主次关系(Chase,2010;Ofiţeruet al.,2010;Stegenet al.,2016)。
高原鼠兔(Ochotona curzoniae) 是青藏高原分布最广、种群数量最多的物种,也是高寒草甸生态系统的关键物种(Smithet al.,2019)。高原鼠兔低氧性肺血管收缩反应钝化,无右心室肥大,是最理想的高山生理学和高原疾病研究模型(贺争鸣,2010)。此外,一些高原鼠兔对吗啡极不敏感,对某些寄生线虫极易感染,这些特征使其作为神经系统药物活性研究和感染病因研究的模型被广泛应用于高原医学、低氧生理和抗逆适应等研究。然而,由于高原鼠兔在室内不能正常繁殖,极大地限制了疾病模型的创制和低氧适应研究。
高原鼠兔野生种群肠道菌群结构和功能的研究已有较多的报道,通过测定其季节性特征,确定了该动物肠道菌群结构和功能依植被的营养特征而改变(Fanet al.,2022);随海拔梯度的增加,肠道菌群的构建由随机性向确定性转变(Yuet al.,2022),血液及体表寄生虫的细菌群落也有不同的构建方式(Liet al.,2018)。然而,高原鼠兔繁殖季节及非繁殖季节群落构建过程有怎样的差异,室内饲养是否导致肠道菌群构建过程发生明显的改变以及与室内繁殖病理的关系等均没有得到详细的阐述。
本研究以高原鼠兔为模型动物,采集不同生理阶段的目标动物和室内饲养实验处理,通过16S rRNA 基因测序和分析技术,使用中性模型拟合群落构建过程,回答以下问题:(1)高原鼠兔繁殖季节与非繁殖季节肠道菌群在结构和功能等方面是否存在差异?(2)室内饲养是否导致高原鼠兔肠道菌群结构和功能发生重大改变,群落的构建过程是否也产生相应的变化?以此,为探索高原鼠兔室内繁殖病理及野生动物实验化提供必要的理论基础。
1 研究方法
1.1 粪便样品采集
本研究采样地点为青海省海北藏族自治州刚察县热水镇(海拔:3 650 m;北纬37°09′03″,东经100°28′40″)。样地植被为典型高寒草甸,属高原大陆性气候,年平均气温2℃;四季放牧,全年无休牧期。
采样时间:非繁殖季节,2019 年1 月,冬季(1月,n=15)。采用绳套法,无损伤捕捉高原鼠兔雄性成体(体重120~150 g),捕获个体放置于清洗干净并用75% 酒精消毒的聚乙烯饲养盒中。待其自行排便后,戴一次性PE 手套将新鲜粪便颗粒装入2 mL 冻存管中(Sigma-Aldrich,St.Louis,MO,USA),放入液氮带回实验室,-80℃保存于DWHL398 型超低温冰箱内(美菱,合肥,中国)。粪便采集完成后,将高原鼠兔带回西宁饲养,自由取食饮水,自然光照,饲料为兔颗粒饲料(北京科奥协力饲料有限公司)。饲养至4 月,采集粪便样品并保存。繁殖季节,2019 年4 月,在原采样地,再次采集野外高原鼠兔粪便样品,放入液氮后带回西宁,超低温冰箱保存。所有的实验程序均按照中华人民共和国科学技术部《实验动物管理条例》(2017年修订)执行。
1.2 DNA提取测序和16S rRNA数据处理
使用E.Z.N.A.®soil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)试剂盒进行粪便微生物群落总DNA 提取,提取完成后,1%琼脂糖凝胶电泳检测DNA 质量,使用NanoDrop2000 测定DNA 的浓度和纯度。使用引物338F (5’-ACTCCTACGGGAGGCAGCAG-3’) 和806R (5’-GGACTACHVGGGTWTCTAAT-3’) 对16S rRNA 的V3~ V4 区进行PCR 扩增。扩增程序如下:95℃预变性3 min,27 个循环(95℃,变性30 s,55℃退火30 s,72℃延伸30 s),然后72℃稳定延伸10 min,最后在4℃进行保存;PCR 反应体系:5 × Trans Start Fast Pfu 缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上下游引物(5 μmol/L) 各0.8 μL,Trans Start Fast Pfu DNA聚合酶0.4 μL,模板DNA10 ng,ddH2O补足至20 mL,每个样本3个重复。
将同一样本的PCR 产物混合后,使用2%琼脂糖凝胶回收PCR 产物,使用Axy Prep DNA Gel Extraction Kit (Axygen Biosciences,Union City,CA,USA) 进行回收产物纯化,并用Quantus™Fluorometer (Promega,USA) 对回收产物进行定量。使用NEXTflex® Rapid DNA-Seq Kit 进行建库:(1)接头链接;(2) 使用磁珠筛选去除接头自连片段;(3) 利用PCR 扩增进行文库模板的富集;(4) 磁珠回收PCR 产物得到最终文库。使用Illumina公司的Miseq PE300 平台测序(上海美吉生物医药科技有限公司)。
1.3 数据处理
使用fastp (https://github.com/OpenGene/fastp,version 0.20.0) 软件对原始测序序列进行质控(Chenet al.,2018),使用FLASH (http://www.cbcb.umd.edu/software/flas,version 1.2.7) (Magoč and Salzberg,2011) 软件进行拼接:(1) 过滤reads尾部质量值20以下的碱基,过滤质控后50 bp以下的reads,去除含N 碱基的reads;(2)根据PE reads之间的overlap 关系,将成对reads 拼接成一条序列,最小overlap 长度为10 bp;(3) 拼接序列的overlap区允许的最大错配比率为0.2,筛选不符合序列;(4)根据序列首尾两端的barcode和引物区分样品,并调整序列方向。
使用UPARSE 软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行OTU聚类并剔除嵌合体(Edgar,2013)。利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%(McDonaldet al.,2012)。
1.4 统计分析
肠道菌群alpha 多样性指数的组间差异、主坐标分析、置换多元方差分析均使用R中的“vegan”软件包来完成。菌群组间差异分析使用LEfSe多级物种差异判别分析(http://huttenhower.sph.harvard.edu/galaxy/root? tool_id=lefse_upload);使 用PICRUSt 功能预测软件对扩增子测序结果进行功能预测(Langilleet al.,2013)。预测的功能通路相对丰度使用STAMP软件进行组间差异分析。
1.5 菌群构建过程分析
采用Sloan 中性模型评估野外及室内饲养条件下高原鼠兔肠道菌群构建的重要性(Sloanet al.,2006)。模型预测集合群落(Metacommunity) 中丰度较高的物种主要通过随机扩散方式在不同群落中定殖,丰度较低的物种则因随机漂变而走向灭绝。在特定分组中分析OTUs 在一个样本中(一个个体的肠道菌群) 出现的频次和其在集合群落(组中所有个体)中的平均丰度与模型的拟合优度。根据OTUs 是否偏离中性模型预测的95%置信区间,将一个分组中所有OTUs 划分为3 个部分:高于中性[发生的频率和(或) 比中性模型预测的更多],低于中性[发生的频率和(或) 比预测的更低],中性(预测)。模型中Nm参数是评估物种在群落间的扩散性。N表示集合群落的大小,m表示迁移率,R2表示数据和模型的拟合优度。
2 结果
2.1 野外和室内高原鼠兔肠道菌群多样性变化
经16S rRNA基因测序和数据处理后,将所有样本序列按照最小序列进行抽平,抽平后每个样本共获得66 502条高质量序列,聚类共得到7 501个OTUs。
在繁殖季节,高原鼠兔野外和室内饲养群肠道菌群alpha 多样性存在显著差异,且野外组显著高于室内饲养组。群落丰度指数(Sobs,Chao,Ace)和群落覆盖度指数(Coverage) 在非繁殖季节显著高于繁殖季节(图1a~d);室内饲养组的群落多样性指数(Shannon) 和均匀度指数(Shannoneven) 显著低于野外组(图1e、f)。
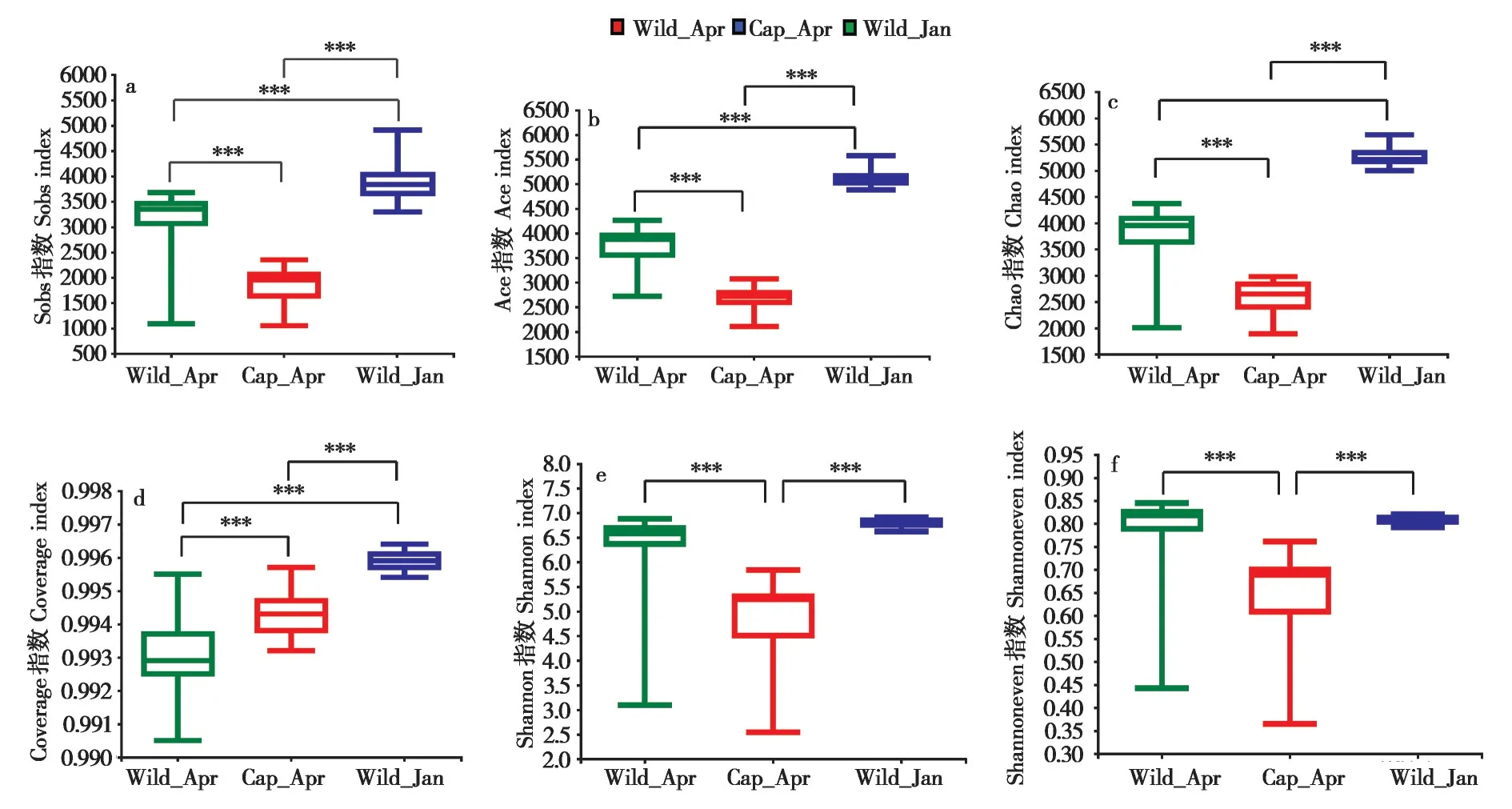
图1 不同组间高原鼠兔肠道微生物alpha多样性指数差异.a:Sobs指数;b:Ace指数;c:Chao指数;d:Coverage 指数;e:Shannon指数;f:Shannoneven指数Fig.1 Differences in alpha diversity of the gut microbiota among three plateau pika groups.a:Sobs index;b:Ace index;c:Chao index;d:Coverage index;e:Shannon index;f:Shannoneven index
野外和室内饲养高原鼠兔肠道菌群的β多样性也存在显著差异。Unweighted UniFrac 聚类结果显示,室内饲养组、野外组繁殖季节和非繁殖季节高原鼠兔菌群结构均存在显著差异,每个组都各自聚类,但野外组之间的相对距离更近(图2a)。Weighted UniFrac 聚类结果显示室内饲养组和野外组分别聚类,而野外组在繁殖季节和非繁殖季节则聚为一类(图2b),菌群结构更相似。

图2 不同组间高原鼠兔肠道微生物结构变化.a:依据不加权UniFrac 距离的PCoA;b:依据加权UniFrac 距离的PCoAFig.2 The structure of the gut microbiota among different plateau pika groups.a:PCoA based on unweighted UniFrac distances;b:PCoA based on weighted UniFrac distances
2.2 野外和室内高原鼠兔肠道菌群优势物种的变化
在门水平,我们选取了相对丰度排名前7位的菌群,这些菌群约占所有菌群的95%以上。室内饲养高原鼠兔肠道高丰度菌群依次为:拟杆菌门(55.90%)、厚壁菌门(33.92%)、螺旋体门(Spirochaetes,3.11%)、Epsilonbacteraeota (1.88%)、p_unclassified_k_norank_d_Bacteria (1.83%)、疣微菌门(Verrucomicrobia,1.07%)和变形菌门(Proteobacteria,0.60%) (图3a,表1)。在野外繁殖季节,高原鼠兔肠道菌群相对丰度从高到低依次为:厚壁菌门(64.20%)、拟杆菌门(22.58%)、Epsilonbacteraeota (6.33%)、螺旋体门(2.18%)、变形菌门(1.13%)、疣微菌门(0.92%) 和unclassified_k_norank_d_Bacteria(0.57%)(图3a,表1)。非繁殖季节,肠道高丰度菌群与繁殖季节基本一致,主要有:厚壁菌门(65.96%)、拟杆菌门(25.27%)、螺旋体门(1.98%)、疣微菌门(1.57%)、变形菌门(1.54%)、Epsilonbacteraeota (1.27%) 和unclassified_k_norank_d_Bacteria(0.67%)(图3a,表1)。
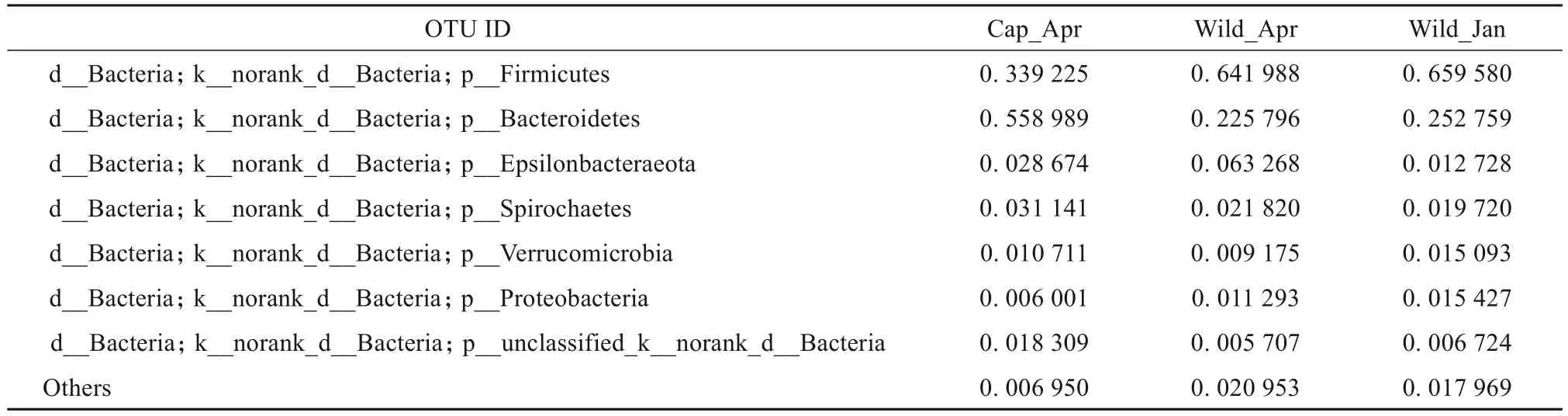
表1 高原鼠兔肠道菌群门水平相对丰度Table 1 The percentage of the bacteria in phylum level of plateau pika

图3 不同组间高原鼠兔肠道微生物组成分析.a:门水平组成;b:科水平组成.Fig.3 Differences in taxonomic compositions of the gut microbiota among different plateau pika groups.a:phylum level;b:family level
在科水平,室内饲养高原鼠兔肠道高丰度菌群依次序:瘤胃球菌科 (Ruminococcaceae,16.56%)、Muribaculaceae (41.27%)、毛螺菌科(Lachnospiraceae,8.17%)、普雷沃氏菌科(Prevotellaceae,8.92%)、理研菌科 (Rikenellaceae,4.06%)、克里斯滕森菌科(Christensenellaceae,2.40%)、Clostridiales_vadinBB60_group (1.70%)、丹毒丝菌科(Erysipelotrichaceae,2.89%)、弯曲菌科(Campylobacteraceae,2.35%)、螺旋体科(Spirochaetaceae,3.11%),约占总菌群的91.44% (图3b,表2)。野外繁殖季节,肠道高丰度菌群依次为:瘤胃球菌科(30.21%)、Muribaculaceae (10.50%)、毛螺菌科(21.17%)、普雷沃氏菌科(5.06%)、理研菌科(5.78%)、克里斯滕森菌科(3.50%)、Clostridiales_vadinBB60_group (5.18%)、丹毒丝菌科(2.78%)、弯曲菌科(5.72%)、螺旋体科(2.18%),占比约为92.09% (图3b,表2);非繁殖季节,则依次为:瘤胃球菌科(35.09%)、Muribaculaceae(8.90%)、毛螺菌科(19.25%)、普雷沃氏菌科(10.23%)、理研菌科(5.04%)、克里斯滕森菌科(4.27%)、Clostridiales_vadinBB60_group (3.15%)、丹毒丝菌科(2.64%)、弯曲菌科(1.13%)、螺旋体科(1.97%),占比为91.67%(图3b,表2)。

表2 高原鼠兔肠道菌群科水平相对丰度Table 2 The percentage of the bacteria in family level of plateau pika
2.3 野外和室内高原鼠兔肠道菌群的组间差异
门水平上,在繁殖季节,高原鼠兔室内饲养组与野外组比较结果显示:拟杆菌门在室内饲养组显著富集,而厚壁菌门、Epsilonbacteraeota、浮霉菌门(Planctomycetes)、迷踪菌门(Elusimicrobia)、绿弯菌门(Chloroflexi)、软壁菌门(Tenericutes)、髌骨细菌门(Patescibacteria)在野外组显著富集(图4a);室内饲养组与野外非繁殖季节比较结果显示:拟杆菌门在室内饲养组显著富集,而厚壁菌门、棒状杆菌门(Rokubacteria)、装甲菌门(Armatimonadetes)、浮霉菌门、变形菌门和硝化螺旋菌门(Nitrospirae)在野外显著富集(图4b);野外繁殖季节与非繁殖季节比较结果显示:Epsilonbacteraeota和软壁菌门在繁殖季节显著富集(图4c)。
科水平上,在繁殖季节,高原鼠兔室内饲养组与野外组比较结果显示:Muribaculaceae、普雷沃氏菌科和葡萄球菌科(Staphylococcaceae)在室内饲养组显著富集,而瘤胃球菌科、毛螺菌科、Clostridiales_vadinBB60_group、弯曲菌科、norank_o_norank_c_KD4-96、链霉菌科(Streptomycetaceae)、Gaiellaceae 和假诺卡氏科(Pseudonocardiaceae) 在野外组显著富集(图4d);室内饲养组与野外非繁殖季节比较结果显示:Muribaculaceae 在室内饲养组显著富集,而瘤胃球菌科、毛螺菌科、克里斯滕森菌科和Clostridiales_vadinBB60_group 在野外组显著富集(图4e);野外繁殖季节与非繁殖季节比较结果显示:弯曲菌科和Clostridiales_vadin-BB60_group 在繁殖季节显著富集,而瘤胃球菌科、普雷沃氏菌科和阿克曼氏菌科(Akkermansiaceae)在非繁殖季节显著富集(图4f)。
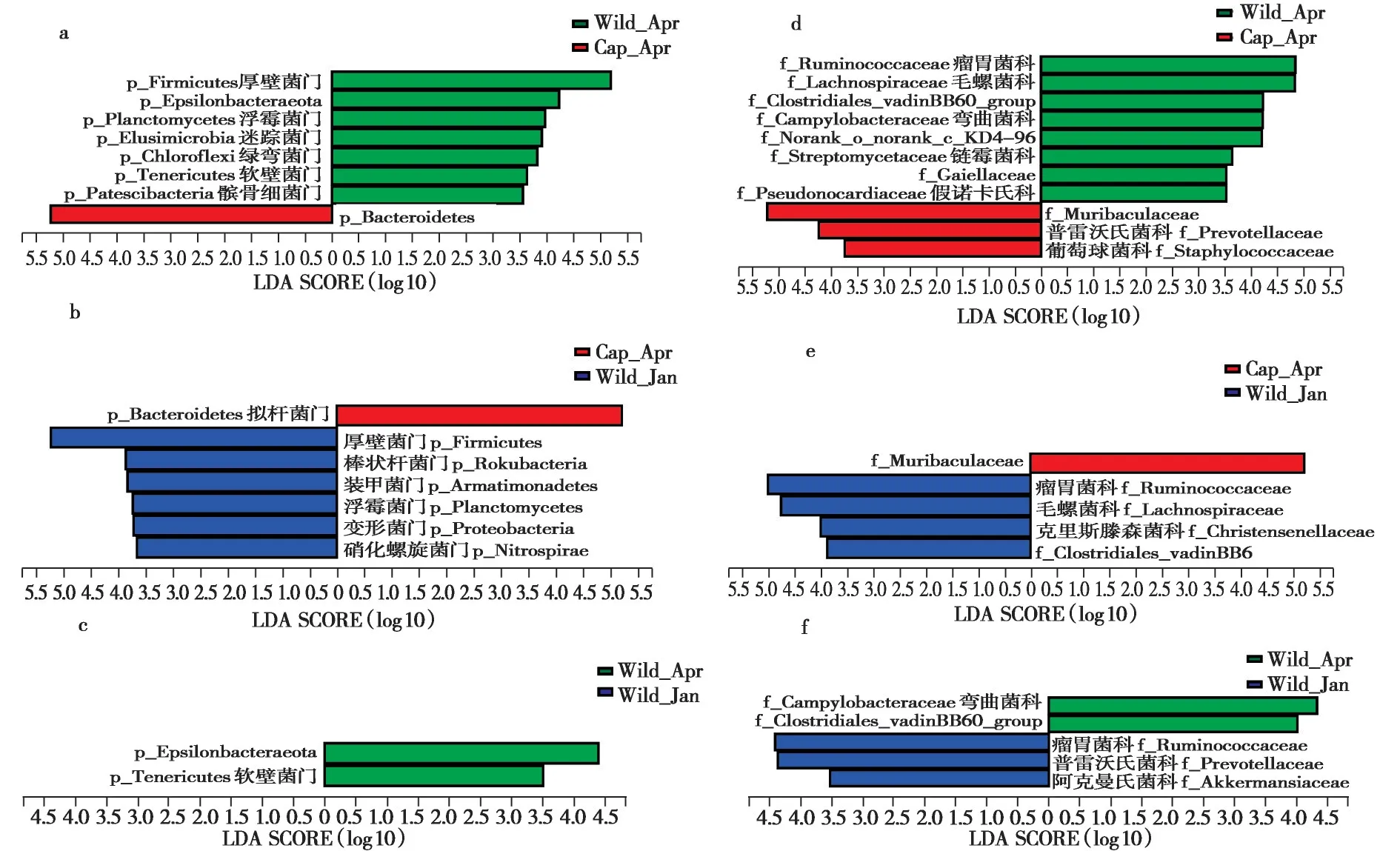
图4 不同组间高原鼠兔肠道微生物相对丰度的差异.a,b,c:门水平的组间两两比较;d,e,f:科水平组间两两比较(LEfSe,LDA >4,P <0.05)Fig.4 Taxonomic alterations of the gut microbiota in different plateau pika groups.Pairwise comparisons of Cap_Apr vs. Wild_Apr;Cap_Apr vs.Wild_Jan;Wild_Apr vs.Wild_Jan in phylum level (a,b,c) and in family level (d,e,f) by the linear discriminant analysis effect size (LEfSe)method(LDA >4,P <0.05)
2.4 野外和室内高原鼠兔肠道菌群功能差异
本研究采用PICRUSt 软件对菌群功能进行预测,并通过STAMP 软件分析了组间功能差异。结果显示在KEEG Level 3 水平上,在繁殖季节,室内饲养组与野外组存在显著差异的通路有细胞通讯(Cell communication) 和心血管疾病(Cardiovascular disease)(图5a);室内饲养组与野外非繁殖季节有显著差异的通路有氨基酸代谢(Amino acid metabolism)、核酸 代 谢(Nucleotide metabolism)、脂质代谢(Lipid metabolism) 和细胞移动(Cell motility)等(图5b);野外繁殖季节和非繁殖季节的差异代谢通路有氨基酸代谢、碳水化合物代谢(Carbohydrate metabolism)、膜转运(Membrane transport)和脂质代谢等(图5c)。

图5 不同组间高原鼠兔肠道微生物菌群功能差异分析.Level 3 水平的KEEG 分析,a:Cap_Apr 和Wild_Apr 比较结果;b:Cap_Apr 和Wild_Jan 比较结果;c:Wild_Apr 和Wild_Jan比较结果,使用welch t-test检验Fig.5 Functional variations of the gut microbiota in different plateau pika groups.Level 3 KEGG pathways were differentially represented between the Cap_Apr vs. Wild_Apr(a),Cap_Apr vs. Wild_Jan(b),Wild_Apr vs. Wild_Jan(c).Differences were assessed by the Welch t-test and are denoted as the corrected P-value
2.5 野外和室内高原鼠兔肠道菌群构建过程
使用中性模型来评估室内和野外高原鼠兔肠道菌群构建的随机和确定性过程。经计算,室内饲养组R2值为0.496 (图6a),野外繁殖季节为0.737 (图6b),非繁殖季节达到0.803 (图6c)。高原鼠兔室内饲养组Nm值显著低于野外组,而野外组繁殖季节的Nm值显著低于非繁殖季节,说明非繁殖季节高原鼠兔肠道菌群存在高度扩散性。这些结果说明野外高原鼠兔肠道菌群群落构建主要是随机性过程,而室内则是确定性过程。

图6 不同组间高原鼠兔肠道微生物菌群构建过程分析.a:Cap_Apr;b:Wild_Apr;c:Wild_JanFig.6 Assembly process of microbiota communities in different groups of plateau pikas.Predicted occurrence frequencies for Cap_Apr (a),Wild_Apr(b)and Wild_Jan(c)
3 讨论
3.1 野外和室内高原鼠兔肠道菌群多样性变化
本研究发现,室内饲养导致高原鼠兔肠道菌群多样性显著降低(图1)。已有研究结果表明,室内饲养或圈养两栖动物(Tanget al.,2020)、鸟类(Wienemannet al.,2011)、哺乳动物(Kohlet al.,2014)和灵长类(Claytonet al.,2016)的肠道微生物群落多样性均显著降低。有学者认为,这些变化可能与食物条件、活动空间以及社群关系变化存在密切关系(Redfordet al.,2012)。研究表明,哺乳动物肠道菌群会随食物来源不同而发生改变(Leyet al.,2008),灵长类动物在圈养条件下肠道菌群发生了类人化现象(humanizes)(Claytonet al.,2016)。高蛋白、高脂肪食物不仅能引起人类肠道菌群多样性的降低,同时也是诸如鱼类、鸟类及植食性哺乳动物肠道菌群多样性丢失最重要的原因。本研究为高原鼠兔提供了兔颗粒饲料,其蛋白和脂肪含量显著高于野外觅食获取的食物,这可能是室内饲养引起高原鼠兔肠道菌群alpha 多样性显著降低最重要的原因之一。其次,室内饲养极大地限制了动物的活动范围,减少了与外界环境的接触。高原鼠兔具有典型的食粪行为,通过觅食同类或其它物种的粪便能够增加菌群的水平传播(Speakmanet al.,2021;Fuet al.,2021)。室内饲养切断了物种间菌群传播途径,因此导致菌群多样性显著降低。再次,环境温度也是影响肠道菌群多样性的因素之一。蜥蜴肠道微生物研究表明,随着环境温度的升高,菌群alpha 多样性减少(Chunbinget al.,2021),而冷暴露能够增加肠道微生物群落的alpha 多样性(Khakisahnehet al.,2020)。尽管本研究没有对室内饲养环境采用加热处理,但西宁地区的海拔明显低于海北州采样地区,且平均温度也高于海北州。因此,本研究室内饲养高原鼠兔alpha 多样性显著低于野外的结果也可能与饲养环境温度较高有关。
有研究表明,食物短缺或宿主生理状况变化会降低肠道微生物群的β 多样性(Xiaoet al.,2019)。从PCoA 图中可以看出,高原鼠兔室内饲养和野外的菌群结构也发生了显著变化。室内饲养与野外环境条件差异极其明显,因而导致室内与野外样本间的距离最远。在室外,1 月高原鼠兔处于繁殖休眠期,而4月正值动情交配高峰期,这种繁殖生理的差异也使两个野外群体出现了明显的分离。
3.2 野外和室内高原鼠兔肠道核心菌群的变化
有学者认为,食物条件是改变哺乳动物肠道微生物核心菌群相对丰度的最重要的因素(Leyet al.,2008)。Clayton 等(2016)发现,拟杆菌门的变化通常与食物中多糖含量有关。拟杆菌(Bacteroides)对食物营养成分具有极其敏感的反应,并能够降解多糖和增加醋酸盐(Kauet al.,2011)。本研究中,室内饲养高原鼠兔肠道拟杆菌显著增加可能与Muribaculaceae 有关。在提供的饲料中,无氮浸出物(主要是碳水化合物,包括淀粉和单糖) 的含量约为52.8% (表3)。高丰度的Muribaculaceae 可以帮助室内高原鼠兔更好地降解食物中的多糖。厚壁菌门、毛螺菌科、Ruminocococaceae、普雷沃氏菌科和Clostridiales_vadinBB60_group 是大多数草食动物肠道微生物群落中最主要的成分,对纤维素和木质素等纤维的发酵和降解至关重要(Penget al.,2021;Tettet al.,2021)。这类菌群的相对丰度在高原鼠兔野外种群中占有较高的比例,且与植被纤维含量呈显著正相关关系。此外,有研究发现Firmicute 与食物消化效率和能量吸收密切相关(Turnbaughet al.,2006)。1月食物最匮乏,高原鼠兔肠道厚壁菌门的相对丰度最高,说明高原鼠兔在适应极端环境过程中肠道菌群也发生了协同变化。

表3 饲养高原鼠兔饲料成分表Table 3 The content of the artificial diets of captive plateau pikas
3.3 野外和室内高原鼠兔肠道菌群功能的变化
本研究功能预测结果显示,野外高原鼠兔繁殖季节和非繁殖季节功能差异较大,而室内饲养组与野外组之间差异较小,可能与菌群的功能冗余有关。菌群功能冗余是保证菌群稳定性的必要条件,能够使菌群对外界环境产生一定的抵抗力和恢复力(Yachi and Loreau,1999;Bäckhedet al.,2005)。有关人类的研究表明,肠道微生物功能高度冗余,功能稳态独立于微生物组成(Tyakhtet al.,2013)。高原鼠兔碳水化合物代谢、脂质代谢、氨基酸代谢及酶家族等代谢通路的丰度在非繁殖季节显著高于繁殖季节。1 月食物最匮乏,环境温度也最低,因此,高原鼠兔肠道菌群必须增加纤维素、蛋白质的降解,使宿主提高食物的利用效率和能量吸收率,以增加产热和维持生存。此外,宿主的生理状态也可能对菌群的功能产生重要影响。随着高原鼠兔从繁殖休眠期进入交配期,高原鼠兔肠道在菌群结构变化的基础上,其功能通路也发生了明显的改变,以匹配宿主生理特征变化。
3.4 野外和室内高原鼠兔肠道菌群组装过程的变化
中性模型拟合结果表明,室内饲养明显降低了随机过程在高原鼠兔肠道菌群组装过程中的重要性。我们的结果与白唇鹿肠道菌群的研究一致(Liet al.,2022)。室内饲养降低随机性对宿主肠道菌群构建过程中的重要性主要源于两方面原因:(1)动物肠道菌群可通过接触及食粪行为在个体间互相传递(Chiyoet al.,2014;Craft,2015;Milleret al.,2018;Boet al.,2020)。室内饲养减少了个体间的直接接触,降低了菌群在个体间的相互传递,因而降低了随机扩散(中性过程) 在群落构建过程中的重要性(Moelleret al.,2017);(2)室内主要采用单一饲料喂养,其食物的多样性以及食物中的纤维含量显著降低(表3)。膳食纤维是肠道菌群的主要营养物质,有利于肠道菌群的定殖并促进菌群的多样性(Tanget al.,2021)。优质的栖息环境,如营养丰富,有利于物种的定殖,增加物种在不同群落中扩散成功率,提高随机过程在群落组装过程中的重要性。该观点在猪肠道及水体微生物研究中得到证实(Pontarp and Petchey,2016;Tanget al.,2021)。对鱼类(Yanet al.,2016) 和虾(Holtet al.,2019)肠道菌群构建的研究表明,宿主的不同生长发育阶段,即宿主生理特征的变化,显著影响确定性过程在菌群构建过程中的重要性。高原鼠兔4 月开始进入繁殖季节,至8 月结束(Li and Sun,1998)。相对于非繁殖季节,其生理特征及性激素水平均发生显著变化(Li and Sun,1998;谢惠春等,2017)。由此可推断,高原鼠兔生理特征的变化也是引起肠道菌群构建方式改变的重要因子。
本研究证明室内饲养和宿主生理状况均可以影响和塑造高原鼠兔肠道菌群的组成和构建过程。由于食物的类人化和单一化以及活动空间的限制性,室内饲养显著降低了高原鼠兔肠道菌群的多样性,造成菌群功能丢失,构建过程由随机性向确定性转变;宿主繁殖状态也会对肠道菌群的组成及群落构建产生影响,非繁殖季节肠道菌群存在高度的扩散性。为探索高原鼠兔室内繁殖成功提供了新的理论基础。

