藏羚集群产羔与其胃肠道寄生虫传播和感染的风险
曹伊凡 尚国珍 李文靖 杨元罡 吴彤 朱亚辉 边疆晖 张瑞强 张同作 赵新全
(1 中国科学院西北高原生物研究所,高原生物适应与进化重点实验室,西宁810001)(2 青海省动物生态基因组学重点实验室,西宁810001)(3 中国科学院大学,北京100049)(4 青海大学农牧学院,西宁 810016)
动物集群有利于降低其被捕食的风险(Parrish and Edelstein-Keshet,1999),但同时也会增加寄生虫病传播和感染的风险(Milneret al.,2013;Brennanet al.,2016)。研究表明,妊娠后期和哺乳期的动物个体因增加对繁殖投入的能量分配而降低对寄生虫的免疫抑制力,使宿主有更高的寄生虫卵排出(Tembelyet al.,1998;Coop and Kyriazakis,1999;Walleret al.,2004;Huntleyet al.,2004;Mandonnetet al.,2005;Beasleyet al.,2010),而临产期动物高密度的聚集将加剧虫卵和幼虫对栖息地的污染(Thamsborget al.,1998;Santinet al.,2004),进而增加寄生虫在群体内的传播强度及个体感染风险(Folstadet al.,1991)。寄生虫常以隐蔽的方式影响宿主健康,尤其在食物匮乏的季节,胃肠道寄生线虫除了吸收营养,还破坏宿主的胃肠道黏膜,影响宿主对食物营养的吸收,以致新生宿主发育受阻(Holmes,1987;Arneberget al.,1996;Fox,1997;Coop and Kyriazakis,1999;Forbeset al.,2000;Samuelet al.,2001;Stienet al.,2002),导致继发感染(Arneberget al.,1996;Irvineet al.,2006),大规模的寄生虫传播、感染可致宿主种群崩溃(Gulland,1992)。寄生于肠道的艾美耳属(Ei-meria)球虫可导致宿主贫血、腹泻、消瘦,严重可导致新生宿主大批死亡(Penninget al.,1971;Pout and Catchpole,1974)。
藏羚(Pantholops hodgsonii)是青藏高原特有动物,主要生活于海拔4 100~5 200 m 的荒漠草原、荒漠草甸草原和高原草原等生境。根据目前藏羚主要的栖息地,可将其分为西藏羌塘、青海可可西里、青海三江源和新疆阿尔金山等地理种群(杨奇森等,2005)。雌性藏羚具有集群产羔的生物学特性,可可西里卓乃湖地区是其重要集群产羔地,每年6 月上旬到7 月上旬集群在此(连新明等,2005;Schalleret al.,2006;Xuet al.,2006;武永华,2007;吴晓民和张洪峰,2011;Karinaet al.,2017),6 月24 日至7 月5 日为其集群产羔期(王艳萍,2005;陈家瑞等,2016),这种在较短时间和一定空间内的高密度聚集,使处于临产期的雌性藏羚有更多的寄生虫卵排出。藏羚粪便中携带的胃肠道寄生虫卵包含12 属:毛首属线虫(Trichurissp.)、斯氏属线虫(Skrjabinemasp.)、奥斯特属线虫(Ostertagiasp.)、毛园属线虫(Trichostrongylussp.)、仰口属线虫(Bunostomumsp.)、食道口属线虫(Oesophagostomumsp.)、细颈属线虫(Nemato-dirussp.)、马歇尔属线虫(Marshallagiasp.)、类园属线虫(Strongyloidessp.)、莫尼茨属绦虫(Monieziasp.)、网尾属(Dictyocaulussp.) 幼虫和艾美耳属球虫(Caoet al.,2020)。其中藏羚艾美耳球虫(Eimeria pantholopensis) 和五道梁艾美耳球虫(E.wudaoliangensis),毛园属、马歇尔属和细颈属线虫卵是藏羚产羔期间感染率高的优势种属(Caoet al.,2020)。这几种均为单宿主寄生虫种(又称土源性寄生虫),发育过程仅需要一个宿主完成其寄生生活,虫卵随宿主粪便排出体外,在自然界适宜的温、湿度下发育成感染性虫卵或幼虫,宿主采食了被虫卵或幼虫污染的草和饮水而感染。如艾美耳属球虫的生活史需在外界适宜的温、湿度条件下,发育为具有感染性的孢子化卵囊而感染宿主,线虫卵需发育到第三期幼虫(L3),才能感染宿主(Anderson and Levine,1966;O’Connoret al.,2006)。研究发现外界温、湿度对宿主粪便寄生虫卵孵化至感染期有重要影响(Anderson and Levine,1966;Graatet al.,1994;Rossanigo and Gruner,1995;O’Connoret al.,2006;Van Dijk and Morgan,2008;Lassenet al.,2014)。
藏羚集群产羔,使产羔地粪便数量增加,寄生虫卵数量随之增加,从而导致产羔区域内牧草和水源被污染,由此假设产羔地可能是藏羚集群产羔传播和感染胃肠道寄生虫病的风险中心。在长期的进化过程中,宿主可通过改变其觅食行为策略来降低感染寄生虫病的风险,通过回避其排泄的新鲜粪便减少侵袭性幼虫的感染(Gruner and Sauve,1982;Cooperet al.,2000;Van der Walet al.,2000;Hutchingset al.,2000,2010;Brambillaet al.,2013),宿主离开产羔地的迁徙行为可减少皮蝇(Hypoderma tarandi) 幼虫的感染率(Folstadet al.,1991)。雌性藏羚每年集群到产羔地产羔及产羔后快速回迁(Schalleret al.,2006;武永华,2007;吴晓民和张洪峰,2011),可能与其回避寄生虫感染风险有关(Schalleret al.,2006)。
本研究依据外界温、湿度是宿主粪便寄生虫卵孵化至感染期的重要限制因子,低温、干燥影响寄生虫卵囊发育(Anderson and Levine,1966;Graatet al.,1994;Rossanigo and Gruner,1995;O’Connoret al.,2006;Van Dijk and Morgan,2008;Lassenet al.,2014)。通过在可可西里卓乃湖产羔地建立微气候观测仪记录藏羚在此停留期间该区域内的气温和湿度,探讨藏羚粪便优势虫卵发育到感染期所需要的时间,以及粪便放置近一年,可能存活虫卵或幼虫数量,旨在揭示卓乃湖产羔地是否会增加集群藏羚传播和感染胃肠道寄生虫病的风险。
1 研究方法
1.1 气候因子数据收集
在距卓乃湖保护站约400 m,海拔4 773 m,北纬35°29′12″,东经91°58′18″的位置,距地面0.5 m处建立温湿度微气候观测仪Em50 (Decagon Devices,Inc Washington USA)。依据藏羚6 月上旬到达产羔地和7 月上旬离开产羔地的行为特征(武永华,2006),设置温湿度记录日期为2018 年6 月9日至7月14日,期间频次为每30 min采集1次。
1.2 新鲜粪便的收集与处理
2018 年6 月9 日09: 00,在海拔4 770 m,北纬35°29′30″,东经91°58′12″ 处发现55 只雌性藏羚。等待藏羚群离开后,共采集新鲜粪便49 份。将49 份粪样充分混合后,随机抽取25~ 30 粒置于1 个直径160 mm、高度60 mm 的PVC 圆圈内,防止风和雨水冲走粪样以及幼虫,共计42 个PVC 粪样圈。分别在第10 天、第15 天、第20 天、第25 天、第30 天和第35 天的09:00 各 收 集7 份 粪样和与其一一对应的粪便周围草样及其表层土样(Hoaret al.,2012),各置于50 mL 的离心管中。本研究收集的粪样、草样和土样均加入10%甲醛溶液固定(Gadelhaqet al.,2018),管口用封口膜封口拧紧瓶盖保存,管上用记号笔记录采集时间和编号。
1.3 寄生虫卵囊、幼虫的提取与发育观察
保存于10%甲醛溶液中的粪便先离心,取其沉淀加清水研磨(草样和土样省略此步骤),40目铜筛过滤,过滤液加清水1 500 r/min 离心沉淀3 min,弃上清液,沉淀加入Sheather氏糖饱和漂浮液(Specific Gravity 1.3) (Samuel and Trainer,1969;Foreyt,1986) 10 mL,应用样品混合振荡器震荡30 s (Vortex-Genie 2,Scientific Industries,Bohemia,New York,USA) 后沿管壁再加Sheather 氏糖饱和漂浮液15 mL 将溅在管壁上的物质冲入离心管中,1 500 r/min 离心漂浮3 min,将漂浮液倒入另一离心管中,加清水离心洗涤3 次,弃上清液吸取沉淀0.1 mL 置于载玻片上进行显微镜检。球虫卵囊内形成4 个明显的孢子囊所需时间,即为球虫卵囊发育到感染期的时间(索勋和李国清,1998),计数不同时间段的球虫孢子化率,孢子化率=[含有4 个孢子囊的卵囊数/ (未形成孢子囊的卵囊数+含有4 个孢子囊的卵囊数)] ×100% (索勋和李国清,1998)。线虫卵仅做定性观察,观察卵囊发育到蝌蚪期、第一期幼虫、第二期幼虫和第三期幼虫(感染期) 最早呈现的天数(Hsu and Levine,1977;Rossanigo and Gruner,1995),球虫、线虫卵的形态识别依据Cao 等(2019,2020),线虫幼虫形态鉴别依据人和动物寄生线虫图谱(中国农业科学院兰州兽医研究所,2002)。
1.4 粪便中线虫卵的越冬存活数量检测
2018 年7 月3 日收集的238 份藏羚新鲜粪样除用于虫卵感染种类和感染率检测外(Caoet al.,2020),将多余的大约140 g 粪样混匀后均等分成10 份,放入尼龙网袋中,并置于PVC 圆圈内,固定于地面上,于2019 年4 月25 日收集粪便样品装入自封袋中。剪取样圈内草样,刮取其表层土样(Hoaret al.,2012),均放入50 mL 离心管中,管口用封口膜封口拧紧瓶盖保存,并在离心管上记录采样时间和编号,并与粪便样品一一对应。将粪样、草样和土样分别置入1 000 mL 烧杯中加200 mL 清水浸泡后在冰箱(4℃) 冷藏12 h,之后粪便样品研磨(草样和土样省去此步骤),通过40 目铜筛过滤,1 500 r/min 离心沉淀3 min,沉淀中加入Sheather 氏糖饱和漂浮液(Specific Gravity 1.3)(Samuel and Trainer,1969;Foreyt,1986),振荡器震荡3 min,1 500 r/min 离心漂浮3 min。取上层漂浮液经500目网筛过滤,筛上物通过自来水缓慢冲洗去除糖液,随后将筛上物用水冲入离心管中,离心沉淀,取其沉淀在数码显微(DMBS-223IPL-5)10×和20×进行显微镜检查,将移动的幼虫记为活幼虫,对其拍照或录像。
1.5 数据统计
通过Shapiro-Wilk 检验数据分布,本研究中的寄生虫感染数据服从指数分布,且这些数据之间存在一定的相关性,即所采集样本间不完全独立,取样时间为重复变量,因此,数据采用广义线性混合模型 (Generalized linear mixed models,GLMM) 进行分析,Logit 作为关联函数,采用仅考虑自变量解释效果的marginal R2(R2margi) 和全效应(自变量加随机变量) 解释效果的conditional R2(R2cond)分别评价模型。球虫孢子化率为因变量,气温、相对湿度为自变量,时间作为随机变量。数据分析使用SAS v.9.2 (SAS Institute Inc.,Cary,NC,USA)完成。显著水平为0.05,球虫孢子化数据表示为平均值±标准误(mean±SE)。
2 结果
2.1 卓乃湖藏羚产羔地附近温、湿度
2018 年6 月9 日至7 月14 日,卓乃湖地区的气温波动幅度较大,最高气温9.5℃,最低气温0.8℃,平均气温5.0℃。期间的最高湿度可达95%,最低湿度为64%,平均相对湿度为81%(图1)。

图1 可可西里卓乃湖产羔地平均气温和相对湿度Fig.1 Average temperature and relative humidity from the Zhuonai Lake calving ground in the Hoh Xil
2.2 卓乃湖产羔地藏羚粪便中球虫卵囊的孢子化率和线虫卵的发育
2018年6月9日至7月14日,42份新鲜粪便中藏羚艾美耳球虫卵在第10 天、第15 天、第20 天、第25 天的孢子化率均为0,第30 天和第35 天的孢子化率分别为18.9% 和54.0% (图2),气温(F1,34=24.74,P<0.000 1) 和相对湿度(F1,34=32.69,P<0.000 1) 均对该球虫孢子化产生影响(GLMM,R2margi=0.318,R2cond=0.977);五道梁艾美耳球虫在第10 天、第15 天、第20 天、第25 天的孢子化率均为0,第30天和第35天的孢子化率分别为13.5%和30.4%,气温(F1,34=3.78,P=0.060 1)和相对湿度(F1,34=4.81,P=0.035 2) 对该球虫的孢子化产生显著影响(GLMM,R2margi=0.285,)。优势毛园属、马歇尔属线虫卵在第15 天均有卵囊发育至桑葚期,第20 天有卵囊发育至蝌蚪期,而细颈属在第20 天有卵囊发育至桑葚期,第30 天有卵囊发育至蝌蚪期,第35 天卵内均形成第一期幼虫,其对应的草样和土样均没发现带鞘的第三期侵袭性幼虫。
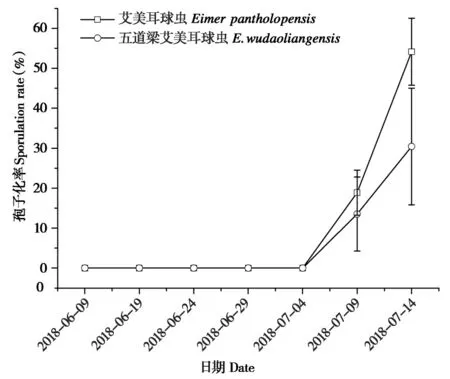
图2 可可西里卓乃湖产羔地藏羚粪便中优势球虫种孢子化率Fig.2 Sporulation rate of dominant coccidia species from feces of Tibetan antelope at Zhuonai Lake calving ground in the Hoh Xil
2.3 卓乃湖产羔地藏羚粪便中寄生虫卵的越冬存活
2018年7月3日放置于卓乃湖地面的粪样10份,于2019 年4 月25 日收集该粪样及其对应的草样和土样,经室内镜检发现10 份粪样中仅有3 份样品各检出1 个马歇尔属卵内存活幼虫,2 个细颈属卵内存活幼虫,其对应的草样和土样均没有检出活的带鞘幼虫。说明藏羚粪便中仅有马歇尔属和细颈属线虫卵能在卓乃湖产羔地越冬存活。
3 讨论
外界温度是球虫卵囊开始孢子化的重要启动因子 (Landers,1953;Edgar,1955;Graatet al.,1994),若温度低于8℃或高于35℃,球虫的孢子化过程将会停止(Edgar,1955)。低温0℃~ 5℃对有些艾美耳球虫卵囊只能延缓或暂时抑制孢子的形成,待温度变暖时仍能继续孢子化过程(索勋和李国清,1998)。藏羚在可可西里卓乃湖集群产羔期该区域内平均温度为5℃,平均相对湿度为81%,其新鲜粪便中藏羚艾美耳球虫卵在第25 天、第30 天和第35 天的孢子化率分别为0、18.9%和54.0%;五道梁艾美耳球虫卵在第25 天、第30 天和第35 天的孢子化率分别为0、13.5%和30.4%,但艾美耳属球虫卵囊在室内恒温25℃培养仅需6 d就能全部孢子化(Caoet al.,2019),说明卓乃湖的低温环境延缓了艾美耳属球虫卵孢子化的启动时间及其孢子化过程。同样温度对自由生活阶段的线虫卵发育和存活也有重要影响(Rossanigo and Gruner,1995;O’Connoret al.,2006),本研 究表明,藏羚感染的主要线虫优势种隶属于毛园科,主要包括毛园属、马歇尔属和细颈属。有研究表明,在5℃和35℃时,毛园科线虫卵不能孵化到第三期幼虫(朱天鹿等,1965;Salih and Grainger,1982;O’Connoret al.,2006)。粪便中的毛园属线虫卵于5℃时需要15 d 发育到第一期幼虫而停止继续发育(Gibson and Everett,1967),当气温为4℃~10℃时,约需要28 d 形成第一期幼虫,而在牧草上至少需要56 d 才能发现第三期幼虫(Salih and Graingeret al.,1982;O’Connoret al.,2006);细颈属线虫卵在温度低于11.5℃时不能发育到感染期(Van Dijk and Morgan,2008);马歇尔属线虫卵在8℃孵化为第一期幼虫需22 d (朱天鹿等,1965)。5℃和35℃时,毛园科线虫卵不能孵化到第三期幼虫(朱天鹿等,1965;Salih and Grainger,1982;O’Connoret al.,2006)。藏羚在可可西里卓乃湖产羔期间该区域内平均气温为5℃,平均相对湿度为81%,上述3 种毛园科的优势线虫卵在卓乃湖产羔地第30 天和第35 天仅能发育到蝌蚪期或卵内仅呈现第一期幼虫,不能发育到感染期,该研究结果与上述报道一致。
寒冷和干燥是寄生虫活力的重要限制因子(Halvorsenet al.,1999;Carlssonet al.,2012,2013;Lassenet al.,2014)。在卓乃湖产羔地放置近一年的粪便中,镜检发现仅有1 个马歇尔属线虫和2 个细颈属线虫卵内存活幼虫,对应的草样和土样均没有带鞘的第三期感染性幼虫。Kutz 等(2012) 发现,细颈属和马歇尔属线虫卵囊从卵细胞发育到三个时期幼虫均可在卵壳内进行,幼虫受其卵壳保护并能在极端寒冷的北极越冬存活。Ash 和Atkinson(1986)的研究表明,寒冷刺激能增加细颈属线虫卵内海藻糖含量,提高其应对寒冷环境的能力。由此说明,细颈属线虫和马歇尔属线虫能在寒冷干燥的卓乃湖越冬存活可能与卵内海藻糖含量集聚,以及幼虫受卵壳庇护有关(Rossanigo and Gruner,1995;郑润宽等,1997;Kutzet al.,2012)。而众多的研究表明,其他8 个线虫属卵及其幼虫(Caoet al.,2020)均不能适应寒冷干燥的气候环境(朱天鹿等,1965;Salih and Grainger,1982;邓世金等,1986;景志忠等,1993;O’Connoret al.,2006;Kutzet al.,2012)。
躲避寄生物感染是动物行为进化过程中所面临的主要选择之一(Hart,1990;Schalleret al.,2006;Curtis,2014)。长距离迁徙能够降低动物对已污染栖息地的利用,进而有效降低宿主感染寄生虫的风险(Hallet al.,2014)。Folstad 等(1991) 和Hoar 等(2012) 对高纬度北极驯鹿(Rangifer tarandus) 的研究表明,驯鹿的迁徙距离与寄生物感染呈负相关,长距离迁徙能有效降低其对皮蝇幼虫和奥斯特属线虫的感染率。Hall 等(2014) 指出,宿主减少在繁殖地的驻留时间,可降低其感染寄生物的风险。雌性藏羚经过近300~400 km 迁徙到可可西里卓乃湖区域集群产羔(吴晓民和张洪峰,2011;Karinaet al.,2017),势必对产羔地造成严重的寄生物污染。先前的研究发现,产羔期间粪便寄生虫卵囊检出率达100% (Caoet al.,2020),而藏羚在产羔地仅停留(24 ± 3) d (Karinaet al.,2017),表明雌性藏羚产羔后迅速回迁可能与其躲避寄生虫感染有关。此外,栖息地严酷恶劣的环境不利于寄生物存活发育而有助于环境自然净化(Altizeret al.,2011)。在卓乃湖产羔地,藏羚粪便中的优势寄生虫卵发育到感染期至少需要30 d,且冬季卓乃湖产羔地寒冷干燥的气候条件,使在产羔地集中排放的寄生虫卵历经近一年的自然净化可有效降低对翌年集群藏羚感染和传播的风险,这可能是藏羚集群迁徙到可可西里卓乃湖产羔的重要原因之一。
本研究表明藏羚集群停留在卓乃湖的时间短于其胃肠道寄生虫孵化至感染期的时间,且依据本研究观察该集群点除了产羔期(仅1个月)外,其余时间均无藏羚存在,因此有利于产羔地的自然净化。由此本研究揭示卓乃湖藏羚产羔地的低温环境延缓了粪便中寄生虫卵发育到感染期的时间,以及藏羚产羔后的迅速回迁和对产羔地的短时利用,将是可可西里卓乃湖产羔地集群藏羚避免增加寄生虫病感染风险的关键因素。
藏羚集群有利于降低其被捕食的风险,而迁徙到寒冷和干燥的高海拔地区产羔将有利于降低其感染胃肠道寄生虫病的风险,Bolger 等(2008)提出有蹄类动物迁徙廊道的中断是引起其种群崩溃的重要原因。由此优先和有效管护藏羚产羔地的原生态、完整的迁徙路线以及藏羚不受干扰的迁徙行为是维护其种群健康发展的重要途径。其次,青藏高原气候的暖湿化(傅伯杰等,2021) 和藏羚种群数量上升(蔡振媛等,2019),将可能增加其感染胃肠道寄生虫的风险,建议在可可西里索南达杰保护站设立监测点开展长期检测。再次,有必要探讨新疆阿尔金山和西藏羌塘国家级自然保护区迁徙与非迁徙雌性藏羚寄生虫感染状况,这对进一步揭示雌性藏羚集群迁徙到高海拔、低气温和植被贫瘠地区产羔的内在生物学机制具有重要意义。
致谢:感谢三江源国家公园管理局和可可西里管理处对藏羚粪便样品收集给予大力帮助和支持。

