珊瑚菜抗盐相关基因GlERF11克隆与盐胁迫表达分析*
徐 瑶,任宏伟,孙唯航,张馨方,田雪梅,谭玲玲,袁 涛,高 婷**
(1. 青岛农业大学生命科学学院/山东省高校植物生物技术重点实验室 青岛 266109;2. 青岛农业大学建筑工程学院 青岛 266109)
药用植物在遭受外界的生物胁迫与非生物胁迫时,其体内的代谢水平会发生变化,包括初生代谢与次生代谢两方面[1]。代谢产物在植物细胞的液泡中进行累积,代谢产物的累积会降低植物细胞内的渗透势,使得外界的水分子更有利于被植物细胞吸收,为植物在面对非生物胁迫时提供了优势[2-5]。
在分子水平上,逆境胁迫会导致植物部分转录因子基因表达量发生变化,进而对植物代谢水平进行调控,从而适应外界的逆境胁迫。与植物抗逆相关的转录因子家族蛋白主要有ZIP、WRKY、AP2/ERF、MYB和NAC 等[6]。其中AP2/ERF 类转录因子在植物非生物胁迫中发挥了重要作用,AP2/ERF 转录因子家族蛋白全称为APETALA2 乙烯响应原件结合因子家族蛋白,其结合靶标位点为DRE/CRT 顺式作用元件,进而对下游基因进行调控,改变下游基因的表达量,使植物细胞响应生物与非生物胁迫,最终发挥相应的生物学功能[7-12]。在杨亚苓等人的研究中显示,花椰菜AP2/ERF 转录因子ERF056 在盐胁迫下呈下调表达,负向响应盐胁迫[13]。研究发现,AP2/ERF 转录因子不仅参与了植物逆境胁迫,同时它也参与了植物的次生代谢产物调控、合成以及累积过程。Lu等人研究发现,青蒿素AaERF1、AaERF2 与AaERF3基因对青蒿素合成起正调控作用[14]。张蒙等人研究发现TcERF12和TcERF15 能够分别抑制和激活红豆杉中TASY(紫杉烯合酶)的表达[15]。Kathleen等人研究发现烟草中的AP2/ERF 转录因子ORC1 的过量表达能够促进烟草中生物碱次生代谢产物的合成[16]。罗红梅等人研究发现丹参中的AP2/ERF转录因子SmAP2/ERF152参与调控丹参酮的合成[17]。
珊瑚菜(Glehnia littoralisFr.Schmidt ex Miq.)属于伞形科芹亚科珊瑚菜属的单种属多年生药用草本植物,大多数生长在海边沙地,属于濒危物种[18]。珊瑚菜药食同源,市场供不应求。如何提升珊瑚菜产量与品质是珊瑚菜育种工作者的重要任务。本课题组对珊瑚菜抗逆相关基因进行发掘,为了获得珊瑚菜ERFs抗盐相关基因,我们对珊瑚菜转录组中筛选的ERFs相关基因进行初步盐处理表达分析,其中c43768_g1基因在盐处理后表达量相较对照组明显上升。将c43768_g1 转录组序列在NCBI 网站上进行blast 比对,结果显示该转录组序列对应的氨基酸序列与胡萝卜DcERF11氨基酸序列(XP_017234597.1)最为相似,相似度为71.35%,因此将c43768_g1 转录组序列命名为GlERF11。本文首次对珊瑚菜AP2/ERF 超家族的GlERF11基因进行了克隆并开展生物信息学分析;同时对GlERF11基因进行了盐处理前后的表达分析。旨在为该基因的功能鉴定及后续珊瑚菜遗传学、育种学等研究奠定基础,如进一步增强珊瑚菜抗盐抗逆能力,有望提高盐碱地的利用率并改善我国土地环境。
1 实验材料
1.1 植物材料
珊瑚菜幼苗(由青岛农业大学药用植物园苗圃提供)。
1.2 实验试剂
本实验的主要试剂包括:植物多糖多酚植物总RNA 提取试剂盒(北京天根生化科技有限公司);HiScript®III RT Super Mix for qPCR (+gDNA wiper)反转录试剂盒(南京诺唯赞生物科技有限公司);SMARTer®RACE5′/3′Kit 试剂盒(大连宝生生物工程有限公司);SYBR®Premix Ex Taq ™II 定量试剂盒(大连宝生生物工程有限公司);TIAN Midi Purification Kit琼脂糖凝胶DNA 回收试剂盒(上海生工有限公司);Ex Taq 酶(宝日医生物技术(北京)有限公司)。
1.3 实验仪器
本实验的主要仪器包括:5424 小型台式离心机(德国Eppendorff Centrifuge 公司);PCR 仪(美国安捷伦公司);实时荧光定量PCR 仪(美国ABI 公司);SIM-F140AY65 制冰机(日本三洋公司);Tanon500 凝胶成像分析仪(上海领成公司);核酸电泳系统(美国BIO-RAD 公司);压力蒸汽灭菌锅(上海申安公司);Nano Drop One 超微量分光光度计(美国Thermo公司)。
1.4 使用软件与网站
使用软件:DNAMAN 6.0,WPS 2010,Primer 5.0,Pymol 1.5,MEGA 5,clustalx 2.0,Bioedit7.0。
使用网站:NCBI (https://www.ncbi.nlm.nih.gov/),Protscale (https://web. expasy. org/protscale/),TMHMM Server (http://www. cbs. dtu. dk/services/TMHMM/),SOMPA (https://npsa-prabi. ibcp. fr/cgi-bin/npsa_automat. pl? page=npsa_sopma. html),SWISS-MODEL(https://swissmodel.expasy.org/),ITOL (https://itol.embl.de/)。
2 实验方法
2.1 珊瑚菜转录组数据分析
由本实验室提供珊瑚菜转录组数据,使用关键词ERF11对珊瑚菜转录组数据库注释信息进行搜索,获得c43768_g1 基因核酸序列。使用NCBI 网站ORF finder 功能寻找c43768_g1 转录组序列的正确开放阅读框蛋白序列,随后使用protein blast 功能寻找相似度最高的同源蛋白序列,以确定其蛋白功能以及蛋白序列的完整性。
2.2 GlERF11基因cDNA克隆与测序
使用Primer 5.0 软件对c43768_g1 转录组序列开放阅读框序列设计引物。提取珊瑚菜幼苗总RNA,反转录获得cDNA,通过PCR 进行扩增,扩增产物电泳验证胶回收后连接到18-T 载体上。将构建完毕的18-T载体转入大肠杆菌感受态细胞中,AMP(氨苄青霉素)抗性的LB 固体培养基筛选培养。次日挑取饱满圆形的大肠杆菌进行菌液PCR,将阳性菌株送测。
2.3 GlERF11基因3’Race克隆与测序
使用Primer 5.0 软件,依据其部分cDNA 序列(5′端完整,3′端不完整)对c43768_g1 转录组序列开放阅读框分别设计长、短3’Race PCR 引物,将扩增后测序结果与原序列进行拼接,从而获得该基因的全长cDNA序列。
2.4 GlERF11生物信息学分析
使用NCBI 网站的CD Search 功能,寻找该基因全长cDNA 的保守结构域。使用Protscale 网站分析该蛋白的理化性质,使用TMHMM Server 网站分析跨膜结构域。使用SOMPA 与SWISS-MODEL 网站进行蛋白质二级或三级结构预测。
2.5 GlERF11基因盐胁迫表达分析与差异表达分析
从种植苗圃中挑选健康的刚生长出真叶的珊瑚菜幼苗,用蒸馏水洗净表面泥沙,吸干多余水分备用。在培养皿中铺上干净的滤纸,并在滤纸上倒入适量的200 mmol.L-1的NaCl 溶液,将洗净的珊瑚菜幼苗铺在培养皿的滤纸上,放入黑暗培养箱中培养。分别在0 h、3 h、6 h、12 h、24 h、36 h 各取样一次,样品全株及时放入液氮中速冻粉碎,随后提取RNA,随后反转录。使用TB Green™Premix Ex Taq™II (Tli RNaseH Plus)荧光定量试剂盒与Appliedbiosystems 实时荧光定量PCR仪对不同样品中的GlERF11基因表达量进行荧光定量分析。使用NCBI设计定量引物,使用2-ΔΔCT数据分析法对荧光定量数据进行分析(表1)。

表1 GlERF11基因克隆及RT-qPCR所用的引物序列
3 结果与讨论
3.1 GlERF11 cDNA克隆与3’RACE 克隆
3.1.1GlERF11cDNA克隆
为了获得珊瑚菜GlERF11cDNA 序列,通过已有的转录组GlERF11序列设计引物,对珊瑚菜GlERF11cDNA 序列进行PCR 克隆以及测序,如图1-图2 所示,GlERF11电泳条带位置与转录组GlERF11开放阅读框长度一致,对电泳条带回收测序,测序结果显示与转录组序列基本一致。从而证明已获得了珊瑚菜GlERF11的cDNA序列。
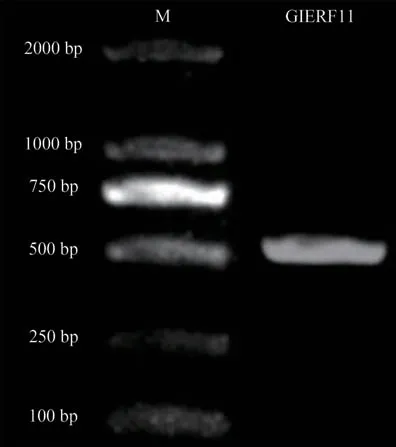
图1 GlERF11cDNA克隆电泳图

图2 GlERF11 cDNA克隆测序比对结果
3.1.2GlERF11基因cDNA3’RACE克隆
对GlERF11 基因进行3’Race PCR,电泳结果如图3 所示,通过对GlIPT 基因3’UTR 长度进行推测,PCR正确片段长度大约在250-500 bp 之间,因此对图3 中正确的的DNA 条带进行回收,连接18-T 并测序。将测序结果与原序列进行拼接从而获得GlERF11 基因的全长cDNA 序列。用NCBI 提供的Open Reading Frame Finder(ORF Finder)进行开放阅读框分析得到该序列长1019 bp,ORF(Open Reading Frame)为537 bp,120 bp 5′非转译区(5′UTR),250 bp 3′非转译区(3′UTR)和28 bp polyA 尾,编码177个氨基酸,编码的蛋白质相对分子质量为19710.95 Da(图4)。

图3 GlERF11 3’RACE PCR电泳图

图4 GlERF11cDNA全长序列与氨基酸序列
3.2 GlERF11蛋白生物信息学分析
3.2.1 GlERF11蛋白保守结构域预测
将GlERF11 蛋白序列于NCBI 在线网站进行保守结构域预测。预测结果如图5 所示,GlERF11 蛋白的第22-79 个氨基酸编码区属于AP2 超家族保守结构域。

图5 GlERF11蛋白保守结构域预测
3.2.2 GlERF11蛋白理化性质分析
对GlERF11 蛋白进行了亲疏水性预测以及蛋白跨膜结构域预测,如图6-图7所示,GlERF11蛋白相对分子质量为19710.95 Da,等电点为6.31。不稳定系数为52.48,说明该蛋白不稳定。总平均亲水性为-0.534,为亲水性蛋白,GlERF11 蛋白在第43 个氨基酸位点,最低峰值是-2.744,在第158 个氨基酸位点,最高峰值是1.911,预测该蛋白无跨膜结构域。

图6 GlERF11蛋白质亲疏水性预测
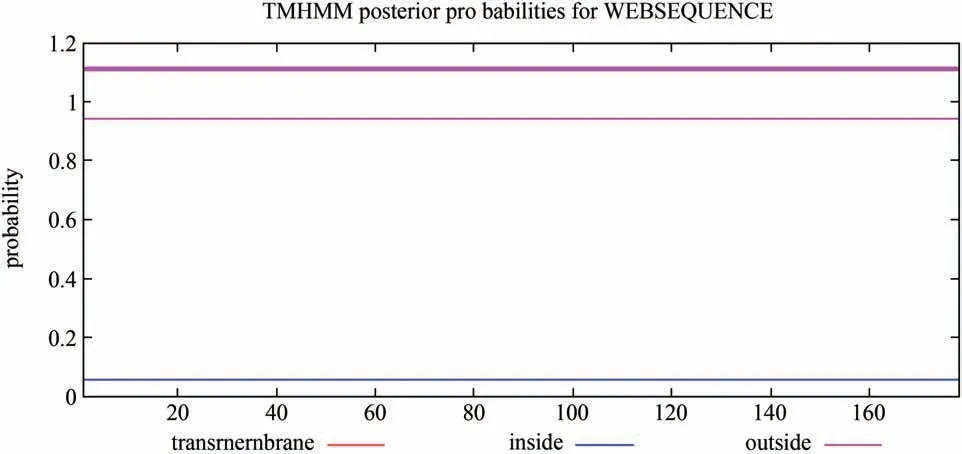
图7 GlERF11蛋白跨膜结构域预测
3.2.3 GlERF11蛋白二级结构预测
对珊瑚菜GlERF11 蛋白二级结构进行预测。如图8 所示,GlERF11 二级结构中有21 个氨基酸参与形成了α-螺旋,占11.8%。36 个氨基酸参与了延伸链的形成,占20.22%。117 个氨基酸参与了无规卷曲的形成,占65.73%。GlERF11 主要结构均为延伸链和无规卷曲,α-螺旋是最为稳定的蛋白质空间结构,其中α-螺旋的比例仅为11.8%,因此推测此蛋白不稳定。

图8 GlERF11蛋白的二级结构预测
3.2.4 GlERF11蛋白三级结构预测
对已知功能蛋白拟南芥AtERF11 与未知功能蛋白珊瑚菜GlERF11 进行三级结构预测,结果如图9 所示,预测GlERF11蛋白结构包含285个氨基酸,占编码氨基酸总数的93.14%,可信度较高。GlERF11 与AtERF11 预测蛋白空间结构较为相似,普遍包含无规则卷曲、β-片层、ɑ-螺旋三种空间结构,推测两者蛋白在功能上可能存在一定的保守性与相似性。

图9 AtERF11和GlERF11蛋白三级结构预测
3.2.5 GlERF11蛋白系统进化分析与氨基酸比对
对不同物种的ERF11 蛋白进行了氨基酸序列比对与系统进化树分析,如图3~6所示,GlERF11与胡萝卜Daucus carota,刺苞菜蓟Cynara cardunculus以及向日葵Helianthus annuus的ERF11 蛋白亲缘关系较近,与密花豆Spatholobus suberectus,玉米Zea mays以及粟Setaria italica等物种的ERF11蛋白亲缘关系较远。通过GlERF11 蛋白与其他物种ERF11 蛋白氨基酸比对结果(图10)发现,图中所有物种的ERF11蛋白存在部分保守性基序,从而说明图中各个物种的ERF11 蛋白存在一定的同源性,同时对图中所有物种的ERF11 蛋白进行三级结构预测,结果显示蛋白结构均与GlERF11 蛋白结构相似,保守结构域预测结果显示,图中所有蛋白氨基酸序列均包含一个AP2 DNA binding domain 的蛋白保守结构域。该保守结构域至少存在两个基序,第一个基序位于β-sheet 1 与βsheet 2 预测区,序列为RGVRXRPWGRYAAEIRDP(X为任意氨基酸)。第二个基序位于β-sheet 3 预测区,序列为RVWLG(图11)。
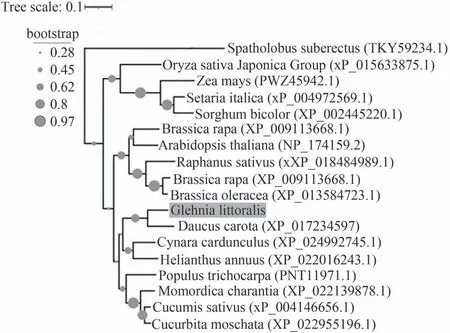
图10 ERF11蛋白系统进化树

图11 GlERF11蛋白与其他物种氨基酸比对
3.3 盐处理下珊瑚菜GlERF11基因荧光定量表达分析
对不同时间段盐胁迫处理下的珊瑚菜幼苗的GlERF11基因进行了荧光定量表达分析,结果如图12所示。珊瑚菜GlERF11基因表达量在盐胁迫3 h 时间段显著上调,在6 h 时间段显著下调,在12 h 显著上调,在24 h 显著下调,呈现出节律性变化。说明GlERF11基因响应了盐胁迫,参与了珊瑚菜的盐胁迫反应。

图12 珊瑚菜盐胁迫处理GlERF11基因表达量变化
4 讨论
珊瑚菜是一种重要的盐生药用植物,其干燥根是药典收载的重要中药材北沙参。有研究表明:在珊瑚菜种子萌发阶段和幼苗生长期均具有较好的耐盐性,在100 mmol·L-1NaCl 处理的珊瑚菜幼苗生长状态和生长量正常,当溶液中浓度超过200 mmol·L-1时生长开始受到抑制,在300 mmol·L-1处理条件下开始出现植株死亡,存活率为50%左右[19]。对于珊瑚菜抗盐基因的研究,对揭示药用植物抗盐抗逆机理具有重要价值。
AP2/EREBP 是植物中最大的转录因子家族之一,根据AP2 结构域数量可以分为两种,其中只具有一个AP2 结构域的为ERF 亚族,其属于乙烯响应因子,在调节植物生物和非生物逆境反应中发挥重要作用[20-21]。研究表明很多物种的ERF11基因参与抗逆胁迫。Marieke 等人发现:在甘露醇处理下拟南芥AtERF11基因表达量受到诱导呈上调趋势[22]。在白桦(Betula platyphylla)中,ERFs 基因的表达存在组织差异性,并且在盐胁迫下BpERF11基因呈上调的表达趋势,说明其参与白桦对盐胁迫的响应[23]。刘悦等人在杨 树(Populus simonii × P.nigra)中克隆并获得了PsERF11基因,并对该基因进行了生物信息学和表达分析。实验结果显示该基因在杨树组织中存在差异表达,同时响应盐胁迫与干旱胁迫[24]。在大白菜(Brassica pekinensis(Lour.) Rupr.)和苹果(Malus × domesticaBorkh.)中,ERF11基因也参与了植物的生物胁迫[25-26]。本研究通过RACE 技术得到珊瑚菜抗盐相关基因GlERF11的全长cDNA 序列,将其与NCBI 上植物的同源蛋白序列进行比对,发现GlERF11 蛋白存在1 个AP2 蛋白保守结构域。利用生物信息软件进行序列分析,从而全面研究基因信息;通过qPCR 分析盐胁迫下的珊瑚菜幼苗,结果显示:在200 mmol·L-1NaCl 的不同时间处理该基因表达量均有显著上调;在12 h 处理下,该基因的表达量增幅最大,是空白的2 倍多。说明了GlERF11基因响应盐胁迫,从而参与珊瑚菜的抗盐过程。本研究为ERFs 家族基因促进珊瑚菜抗盐的分子机制研究提供依据,后续功能鉴定及机理解析实验有待进一步开展。
乙烯作为一种植物激素不仅调节生长发育、果实成熟,还能在植物体内快速传递环境信号,进而使植物对胁迫做出应答[27]。一些转录因子可以通过响应乙烯来调节植物的盐胁迫。如大部分具有较高水平ERFs的烟草乙烯不敏感突变体,对环境胁迫表现出明显的抗性[28-29]。推测乙烯响应因子GlERF11 可能通过结合结构基因的上游顺势作用元件来调控下游基因的表达,即GlERF11 可能是通过调节乙烯的生成进而协调相应信号途径之间的相互作用,参与珊瑚菜的抗逆过程,有待后续研究。
此外,植物在受到外界环境的影响压迫时,体内的次生代谢物一般会大量产生,进而来抵御恶劣环境。如有研究表明:一定量的环境胁迫可以增加甘草中甘草苷、甘草酸等有效成分的积累,进而提高其相关品质[30-31]。抗性与高品质存在一定关联性,珊瑚菜的抗性优良品种很可能也是高产优质品种。因此,对于珊瑚菜抗盐基因的研究,不仅有利于开发利用耐盐植物资源、提高国家盐碱地的利用率,并且对提高药用植物的产量及优化中药材品质都有一定现实意义。