基于整合药理学策略及药效验证探讨交泰丸抗心律失常分子机制*
陈金红,刘志超,樊博雅,梁嘉钰,邓芳隽,李晓凤,丛紫东,杜武勋**
(1. 潍坊医学院康复医学院 山东 261053;2. 天津中医药大学研究生院 天津 301617;3. 天津中医药大学第二附属医院 天津 300150)
1 引言
心律失常是一种由心脏电传导系统引起的心脏电生理活动异常,从而导致心脏兴奋频率或节律异常的疾病,主要表现有心悸、心慌、胸闷、头晕等[1-2]。心律失常的出现常提示潜在的心脏疾病,或是非心脏病变。当今社会随着生活和工作压力增大,心律失常发病率呈逐年增长趋势,病死率也日渐攀升[3]。流行病学调查显示,通过24 h 或48 h 动态心电图检测,室早的检出率高达40%-75%[4]。此外,2016 年、2017 年和2018 年心房颤动导管消融占总消融手术的比例分别为23.1%、27.3%和31.9%[5]。近几十年来,虽然射频消融术等非化学药物治疗方法不断涌现,但药物治疗仍然是最常用的治疗方法。然而,抗心律失常药物的致心律失常作用亦不容忽视[3],其间,中医药因其疗效显著,且不良反应少而在抗心律失常方面发挥着越来越重要的作用[6]。
心律失常属于中医“心悸”“怔忡”“惊悸”范畴,现代医学将心悸分为心虚胆怯证、心脾两虚证、阴虚火旺证、心阳不振证、水饮凌心证、瘀阻心脉证、痰火扰心证等证型[7]。交泰丸为心肾不交证的代表方剂,其中黄连苦寒,入心经,降心火;肉桂辛热,入肾经,暖肾水,如此交通心肾,治疗心火燔盛、肾阳不足导致的怔忡、心悸、失眠等疾病。《素问·六微旨大论》言:“出入废则神机化灭,升降息则气立孤危。故非出入,则无以生长壮老已;非升降,则无以生长化收藏。”“升降出入,无器不有。”可见气机的升降出入是生命活动的基本形式,如肺主肃降,肾主纳气,脾主升清,胃主降浊,心火下潜,肾水上腾,肝气升发,胆汁降泄等等。由于升降有序,出入衡常,故能动静相召,上下相临,阴阳交泰,气血和畅,生生化化,品物咸章。“一气周流”理论是黄元御学术思想的高度概括,《四圣心源》是其在精熟《黄帝内经》、《难经》、《伤寒论》、《金匮要略》等经典基础上,结合自身临证经验著成的代表著作。《四圣心源·神惊》[8]有:“神发于心而交于肾,则神清而不摇,神不交精,是生惊悸,其原由于胆胃之不降。”脾气左升,胆火右降,则上下水火相济,阴阳和合,神清而心宁。若脾陷胃逆,相火浮动,灼伤心阴,致心火外泄,肾水不温,使上下分崩,一气不能循环周流,终致心神被扰,发为心悸。由此看来,心肾不交是导致心律失常的重要机制,以黄连-肉桂为代表的药对组合,其意在“心”与“肾”水火阴阳的相互交通,清上温下,使心火下潜,肾阳固藏,从而使心神有根而得以养。
2 研究思路与方法
整合药理学是揭示多组分药物的多靶标作用特征背后的复杂药理机制的方法之一[9]。众所周知,中药复方因其具有多种成分,可通过多种靶向作用发挥其临床功效,因此具有多种药理作用[10]。导师杜武勋教授多年来致力于气化理论及该理论指导下的对心律失常治疗作用的机制研究,在中药临床有效性的基础上,深入开展中药复方对心律失常作用机制的挖掘和评价。为了系统的从分子水平揭示交泰丸治疗心肾不交型心律失常的作用机制,建立药物-靶标-疾病之间的模块关联,本文通过中医药整合药理学研究平台,从微观生物层面筛选交泰丸抗心律失常的关键活性成分和靶标,对交泰丸治疗心律失常的分子机制进行探讨及分析,并结合动物实验分析其在关键药效机制上相关分子水平,以阐释其新的研究方向(图1)。
3 研究与分析
3.1 基于TCMIP的交泰丸抗心律失常分子机制研究
3.1.1 数据库的建立
利用整合药理学平台[11](http://www.tcmip.cn/)的中药活性成分数据库,结合2015年版《中国药典》规范药材命名及成分名称,进行虚拟数据资料建库。检索“黄连”“肉桂”,保留活性成分与靶点,自主命名数据,作为备用。
3.1.2 中药化学成分来源及靶标预测
通过TCMIP 中“中药靶标预测及功能分析”模块及手工检索目标药物活性成分,收集交泰丸中黄连、肉桂的化学成分,并将其二维结构(mol)与DrugBank(https://www. drugbank. ca/)数据库中认证药物(approved)进行化学指纹比对,利用Tanimoto 系数对结果进行评分,选定评分>0.8 的作为交泰丸的潜在机制靶标[12]。
3.1.3 疾病、证候靶标预测
以“Arrhythmia”为疾病关键词,在GeneCard(https://www.genecards.org/)数据库、DisGENET 数据(https://www. disgenet. org/)、DrugBank 数 据 库(https://www.drugbank.ca/)、OMIM 数据库(https://omim.org/)检索疾病相关靶标,利用Uniprot 数据库(https://www.uniprot.org/uniprot/)转换蛋白名称,获取基因名称。最后利用Microsoft Office Excel 进行合并去重,建立疾病数据库。
再以“Arrhythmia”作为疾病关键词录入整合药理学平台疾病/证候靶标数据库中进行检索,证素输入:“心悸”“心烦”“头晕”“耳鸣”“不寐”“舌红少苔”“脉细数”等关键词,提取相应证候靶标信息。
3.1.4 PPI网络构建、关联网络可视化及分析
通过整合药理学平台的网络分析模块蛋白互相作用网络进行拓扑分析,选取中药靶点-疾病基因的关键节点(hubs),作为交泰丸活性成分的潜在靶点。通过TCMIP 分析平台对关键靶基因进行GO 功能富集分析和KEGG 富集分析,选取统计值P 值排名前20 的通路,构建完整的“中药-证素-疾病-靶标-通路”多维网络。利用Jvenn(http://www.bioinformatics.com.cn/static/others/jvenn/example.html)在线绘图[13],获取韦恩图。
3.1.5 结果
(1) 交泰丸化学成分、靶标预测结果及分析
TCMIPV2.0 平台对黄连、肉桂化学成分的分析结果:黄连共收集了14个化学成分,包括小檗碱(Berberine)、木兰花碱(Magnoflorine)、黄连碱(Jatrorrhizine)等,其中潜在靶标212 个。肉桂共收集了9 个化学成分,为肉桂醛(Cinnamaldehyde)、丁香酚(Eugenol)、棕榈油酸(Zoomaric acid)等,其中潜在靶标61个。
对黄连、肉桂候选靶标进行基因功能分析和通路富集分析,发现其具有的功能信息主要有调节胺的运输、对含氧化合物的反应、腺苷酸环化酶调节性G 蛋白耦联受体信号通路、儿茶酚胺分泌的调节、血清素受体信号通路、血液循环等。富集到的通路主要有神经活性配体-受体相互作用、钙信号通路、cAMP 信号通路、花生四烯酸代谢、叶酸生物合成等。
(2) 心律失常疾病靶标及相关基因
研究者将心律失常疾病靶标合并去重后共收集到靶标850个。其中与交泰丸密切相关的共同靶向基因共计9个,如韦恩图(图2)。这些靶点的作用机制主要从调控氧化应激[14]、电压门控K+通道[15]、电压门控Na+通道[16]、内侧前额叶皮层(mPFC)的激活[17]、蛋白激酶A(PKA)[18]、维持结缔组织合成与降解之间的平衡[19]、调节钙离子水平[20]等共同调节作用下发挥作用。

图2 心律失常疾病靶标及相关基因韦恩图
(3) 心律失常心肾不交证证素靶标
根据中医学对心肾不交证的描述,划分证素包括心悸、心烦、头晕、耳鸣、不寐、舌红少苔、脉细数等。其中心悸、心烦包含56 个相关靶标,头晕、耳鸣、不寐包含111 个相关靶标,舌红少苔、脉细数包含21 个相关靶标。
(4) 交泰丸治疗心律失常的GO富集分析
对交泰丸治疗心律失常的候选靶标进行基因功能分析,罗列出P值前20位的条目(表1),其基因功能主要包括基因表达的正调控、MAPK 级联激活、SRP 依赖的共翻译蛋白靶向膜、细胞因子介导的信号通路、调节心室心肌细胞动作电位、通过心脏传导调节心率等方面。

表1 交泰丸治疗心律失常的候选靶标的GO富集分析
(5) 交泰丸治疗心律失常的KEGG富集分析
对交泰丸治疗心律失常的候选靶标进行KEGG富集通路分析,罗列出P值前20位的条目(表2),可见其主要与促红细胞生成素激活RAS、下游信号转导、RAF激活、酪氨酸激酶受体2(tyrosine kinase receptor 2,Tie2)信号通路、树突状细胞膜表面的一种新型凝集素受体(dendritic-cell specific ICAM-3 grabbing no nintegrin,CD209(DC-SIGN))信号、通过干细胞因子-酪氨酸激酶受体(stem cell factor,SCF- tyrosine kinase receptor,KIT)发出信号等通络相关。
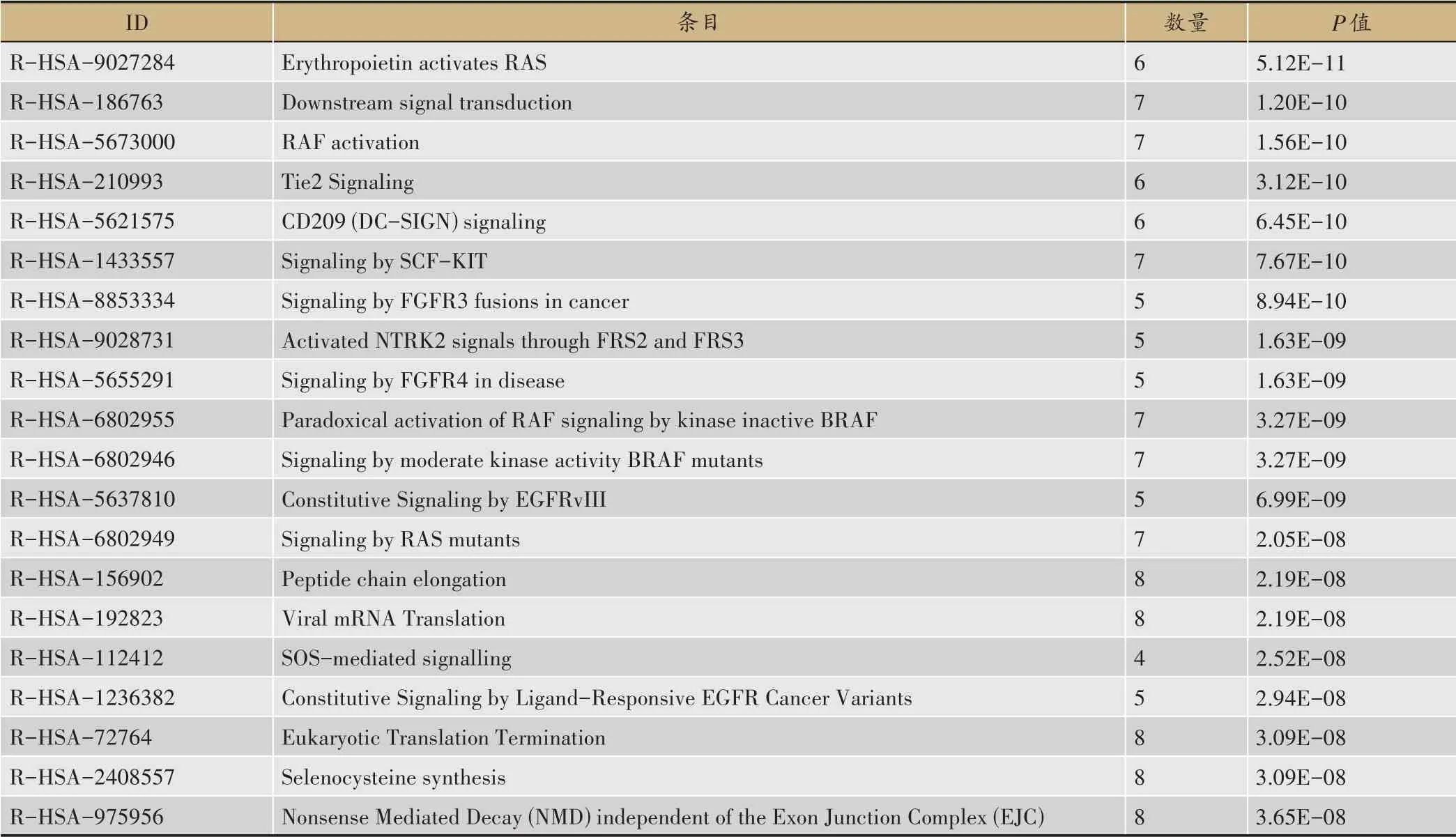
表2 交泰丸治疗心律失常候选靶标的KEGG富集分析
(6) 交泰丸治疗心律失常的“中药-证素-疾病-靶标-通路”可视化多维关联网络
应用整合药理学平台V2.0“中医药关联网络挖掘”功能,选择“疾病-证候-方剂”模块,构建可视化多维关联网络(图3),不同颜色的节点是按照基因间相互作用的紧密度进行聚类。由图3 可以看出,交泰丸中黄连-肉桂药对作用于59 个潜在靶标,其通过HRAS、TP53、VHL、PIK3CA、CASR、CREBBP、RAF1、JAK2等核心靶标参与了促红细胞生成素激活RAS、下游信号转导、RAF 激活、Tie2 信号通路、CD209(DCSIGN)信号、通过SCF-KIT 发出信号等27 个信号通路。
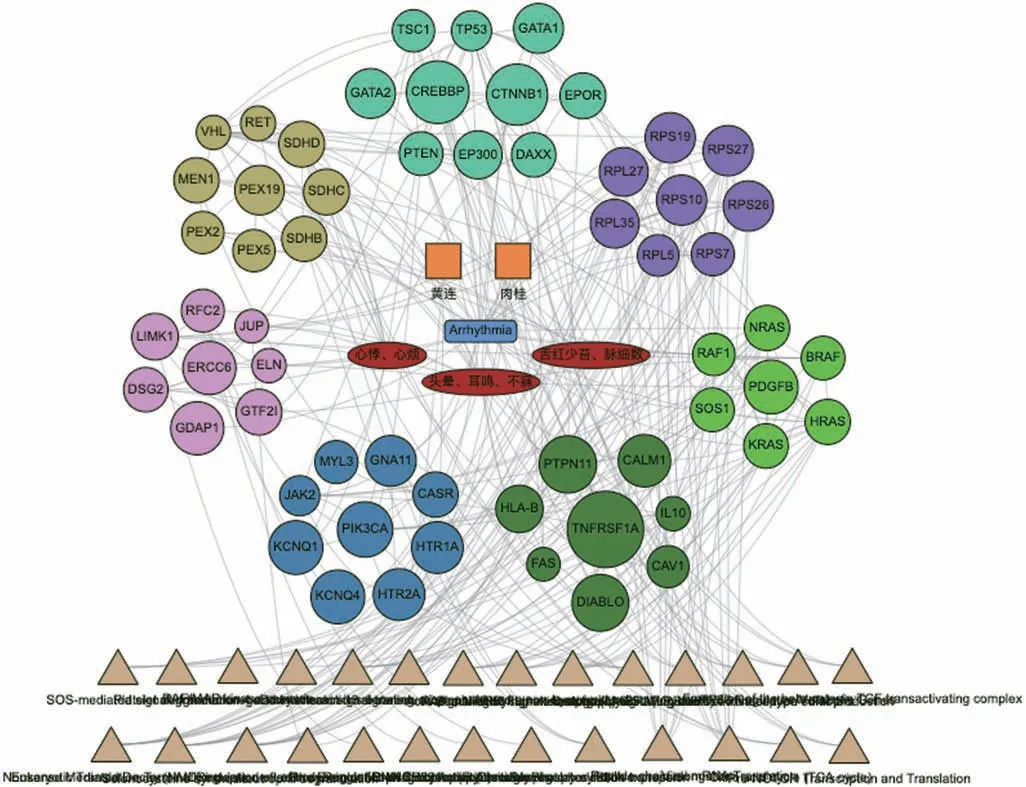
图3 交泰丸治疗心律失常的“中药-证素-疾病-靶标-通路”可视化多维网络关联
3.2 交泰丸通过调控RAS 系统及交感神经活性干预心律失常的药效研究
3.2.1 实验材料与动物模型建立
SPF 级健康雄性SD 大鼠32 只(200-240 g),由中国人民解放军军事医学科学院实验动物中心提供,合格证号SCXK(京)2019-0010,在天津市放射研究所实验动物中心饲养,适应性喂养1 周后进行实验。大鼠随机分为对照组(N)、模型组(M)、交泰丸组(J)、阳性药组(Meto)4组,每组8只。大鼠给药剂量按照成人口服剂量进行等效剂量换算[20]:N 组及M 组按10 mL/kg/天灌胃0.9%生理盐水;J 组按1.7 g/kg/天灌胃黄连(15 g)肉桂(1.5 g)水煎液;Meto 组按2.57 mg/kg/天灌胃酒石酸美托洛尔片(倍他乐克)水溶液。各组于造模前14 天开始按10 mL/kg/天灌胃给药。最后1 次给药后30 min,除N 组外,其余各组大鼠称重,用20%乌拉坦5 mL·kg-1(1 g·kg-1)腹腔注射麻醉,对大鼠进行心电图监测。记录基线心电图10 min 后,以32 μg·kg-1体重尾静脉推注肾上腺素(Epi)[22],制造心律失常模型,继续监测心电图10min。采用酶联免疫吸附法(ELISA)测定血管紧张素Ⅱ(AngⅡ)、儿茶酚抑素(CST)、神经肽Y(NPY),试剂盒均购买于天津津科生物科技有限公司。
3.2.2 样本采集
心电图监测结束后,各组大鼠经眼球后静脉丛取静脉血0.5 mL,置于肝素化EP 管中,4℃,3000 rpm 下离心10 min,分离血浆,ELISA 法测定AngⅡ、CST、NPY。
3.2.3 统计学方法
采用SPSS26.0 进行统计学分析,实验数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
3.2.4 结果
(1) 交泰丸抑制Epi诱导心律失常的AngⅡ高表达
与对照组相比,模型组大鼠AngⅡ明显升高(P<0.01)。交泰丸预处理后,AngⅡ表现出明显回调趋势(P<0.01)。倍他乐克预处理后,AngⅡ水平下降(P<0.05)。交泰丸组、阳性药组与对照组相比已无明显差异(P>0.05),表明两组治疗后AngⅡ趋于正常范围,且交泰丸组疗效最明显。
(2) 交泰丸抑制Epi诱导心律失常的CST高表达
与对照组相比,模型组大鼠CST 明显升高(P<0.01)。交泰丸预处理后,CST 水平呈下降趋势(P<0.05)。倍他乐克预处理后,CST 水平回调(P<0.05)。交泰丸组与对照组相比已无明显差异(P>0.05),表明交泰丸治疗后CST趋于正常范围,疗效最明显。
(3) 交泰丸抑制Epi诱导心律失常的NPY高表达
与对照组相比,模型组大鼠NPY 明显升高(P<0.01)。交泰丸预处理后,NPY 水平呈下降趋势(P<0.05)。但阳性药组并未表现出明显回调(P>0.05)。交泰丸组与对照组相比已无明显差异(P>0.05),表明交泰丸治疗后NPY趋于正常范围(表3、图4)。
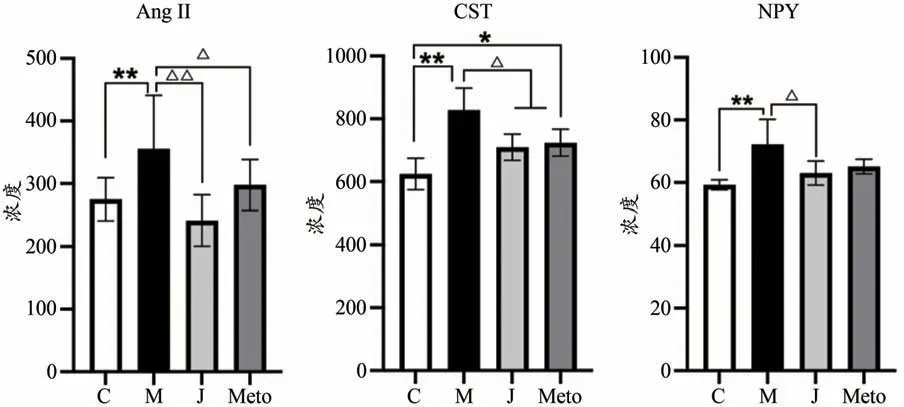
图4 交泰丸抑制Epi诱导心律失常的AngⅡ、CST、NPY高表达
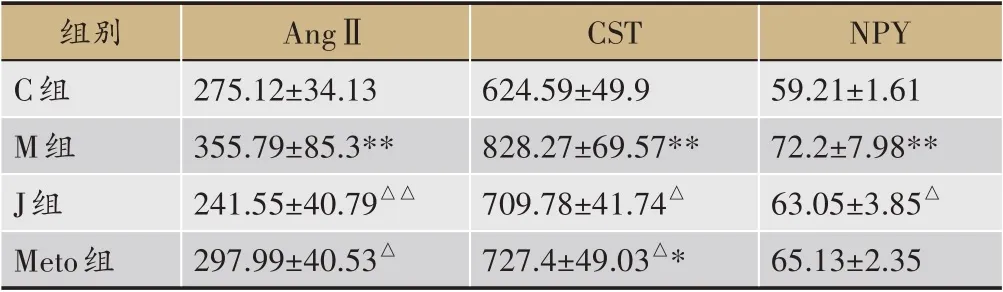
表3 交泰丸抑制Epi诱导心律失常的AngⅡ、CST、NPY高表达
4 讨论
黄连已被广泛应用于各种心脑血管系统疾病中[23],其成分小檗碱的抗心律失常作用在1989 年被首次报道[24]。研究发现,黄连中的小檗碱是有效的抗氧化剂和消炎剂,它可以抑制NOX 2,4的过表达,并在炎性刺激下降低巨噬细胞和内皮细胞中ROS 的产生[25-26]。现代药理学研究表明,肉桂可以通过增加冠脉流量改善冠脉循环及心肌营养状况,对冠心病、心律失常等心血管疾病有防治作用[27]。Hwa 等[28]从肉桂中鉴定并提取化合物2-甲氧基肉桂醛(2-MCA),通过实验证实该化合物能改善成年大鼠缺血再灌注模型的局部缺血/再灌注(I/R)损伤,其机制可能是通过降低TNF-α 活化的内皮细胞中血管细胞黏附分子1(VCAM-1)的表达以及诱导血红素氧合酶1(HO-1)的生成来实现的。同时,交泰丸可以调控大鼠血液和组织中神经递质的含量,如促肾上腺皮质激素(ACTH)、促肾上腺皮质激素释放因子(CRF)、肾上腺分泌的皮质酮(CORT)、5-羟色胺(5-HT)、多巴胺(DA)、去甲肾上腺素(NE)和肾上腺素(E)[29-30],这可能是其实现交通心肾的作用机制之一。此外,本次整合药理学结果表明,交泰丸不仅可以调节儿茶酚胺的分泌,且与肾素-血管紧张素系统(RAS)关联密切,RAS是体内重要的内分泌调节系统之一,对心血管系统内环境的稳定有重要影响[31]。血管紧张素Ⅱ(AngⅡ)是RAS 的主要活性成分,局部增多的血管紧张素Ⅱ(AngⅡ)直接或间接刺激交感神经,增强对冠脉和心肌的收缩作用,增加心肌耗氧量,以致能量耗竭,细胞内钙超载,造成心律失常[32]。不少研究证据表明,抑制RAS 系统可以降低心律失常的风险[33-35]。
基于上述结果,本研究以RAS 系统关键活性成分AngⅡ,以及交感神经活性抑制因子CST、神经递质NPY 为观察指标,初步验证交泰丸干预心律失常的药效途径。AngⅡ可诱发室性心律失常,参与房颤的发生与维持[36]。多项研究表明,心律失常患者血浆和心脏AngⅡ浓度均较高,阻断体内AngⅡ生成是缓解心律失常重要环节之一[37-39]。AngⅡ作用于AT1 受体,通过激活重要靶点PKC抑制心肌细胞Ikr/HERG,对心脏电活动和心肌肥厚心衰的发展产生作用[40]。还有研究发现AngII 可以减小Ito电流密度,使心肌复极化变缓,最终导致心律失常[41],多项研究都证实了AngII是心律失常病理生理改变的关键环节。本项研究发现模型组大鼠推注肾上腺素后血浆AngⅡ明显升高,交泰丸相比阳性药可以更好的抑制这一现象。CST是一种可有效抑制儿茶酚胺释放与分泌的内分泌神经肽类物质,随着交感神经系统激活而释放增加,通过调节心脏副交感和交感神经活性,起到调整心脏功能的作用[42-44]。人类心室肌的神经纤维主要以交感神经为主,交感神经系统活性的升高是室性心律失常发生的重要环节[45-47]。交感神经兴奋时,心肌兴奋性增加,进而提高心率及血液中儿茶酚胺含量,相关研究表明CST通过作用于孤束核的突触发挥调节自主神经活性作用,从而改善压力感受器敏感性和心率变异性[48]。CST的异常改变可通过调节影响心脏功能而加重房颤等心律失常的发病率[49-50]。本项研究发现模型组大鼠推注肾上腺素后血浆CST 明显升高,说明交感神经被显著激活,而交泰丸组CST 更接近正常组水平,证明其在病理情况下对交感神经有抑制作用。NPY 是交感神经末梢分泌的神经递质之一,广泛分布于神经系统中,与精神类相关疾病密切相关,其作用于突触前膜Y1、Y2 受体,进而影响心肌自律性,其中主要表现为抑制迷走神经兴奋时减慢心率的作用[51-52]。有研究提示血浆NPY 水平是影响心衰患者死亡率的独立因素[53]。本项研究发现模型组大鼠推注肾上腺素后血浆NPY 明显升高,提示肾上腺素导致交感神经系统过度兴奋,经交泰丸治疗后,NPY 水平明显回调,说明其对自主神经系统有自稳调节功能。
上述几种物质不是单一作用,而是相互联系。如AngII 与受体结合后可通过交感神经末梢的正反馈使NPY 分泌增加,交感神经兴奋释放NPY 后,又可诱导CST 的生成[54]。RAS 与交感神经系统是心血管疾病中的重要调节机制和维持动态自稳的核心调控系统,通过调节RAS 系统又可以对交感神经的激活产生影响[55]。近年来越来越多的证据表明两者在心律失常等心血管疾病诊断治疗中的作用[56-57],为心血管疾病的监测与调控提供了新思路。
5 结论
近年来,心律失常成为心源性猝死发生的主要因素之一[58]。导师杜武勋教授在临证诊疗中以气化理论为基础,以交泰丸为底方,对心律失常具有较好的临床疗效。本研究借助中医药整合药理学研究平台V2.0 和国际通用靶标、基因数据库,结合了中药成分、证候要素、疾病靶标的多层次研究,较为完善的完成了中药-证素-疾病-靶标-通路的衔接性研究,从分子角度阐释中药复方疗效内涵。同时,通过肾上腺素诱导大鼠制造心律失常模型,进一步证实交泰丸通过调控RAS 系统与交感神经系统干预心律失常的分子机制,为临床诊疗提供思考方向和依据。